甲磺酸达比加群酯胶囊微生物限度检查方法的建立
2014-03-08王嘉南
贾 雷,王嘉南
(1.淄博职业学院药学系,山东淄博255015;2.北京师范大学生命科学学院,北京100875)
甲磺酸达比加群酯胶囊微生物限度检查方法的建立
贾 雷1,王嘉南2
(1.淄博职业学院药学系,山东淄博255015;2.北京师范大学生命科学学院,北京100875)
目的探讨建立甲磺酸达比加群酯胶囊的微生物限度检查的方法。方法依据《中国药典》2010年版(二部)收载的微生物限度检查法应用指导原则进行方法学验证试验。结果试验表明甲磺酸达比加群酯胶囊对枯草芽孢杆菌和金黄色葡萄球菌具有较强的抑制作用。结论推荐采用薄膜过滤法进行本品的细菌计数;采用常规检验方法进行真菌及酵母菌计数和控制菌检查。
甲磺酸达比加群酯胶囊;微生物限度检查;方法学验证
达比加群酯(dabigatran etexilate,商品名Pradaxa)是一种新型非肽类直接凝血酶抑制剂,由德国勃林格殷格翰(Boehringer Ingelheim)公司研发。甲磺酸达比加群酯胶囊是一种新型口服抗凝药物,通过在体内直接抑制凝血酶起到抗凝作用[1],临床用于非瓣膜房颤患者的卒中和全身栓塞预防[2,3],具有口服、强效、无需特殊用药监测、药物相互作用少、不良反应小等优点[4]。在建立甲磺酸达比加群酯胶囊的微生物限度检查方法过程中,发现该药对枯草芽孢杆菌和金黄色葡萄球菌具有较强的抑菌活性,在对其进行微生物限度检查时,需要消除其抑菌活性再进行试验。我们依据《中国药典》2010年版(二部)[5]收载的微生物限度检查法应用指导原则,对甲磺酸达比加群酯胶囊微生物限度检查进行了方法学研究,建立了该品种的微生物限度检查方法。
1 仪器与试药
1.1 仪器 MJX-251B-Z型真菌培养箱(上海博迅实业有限公司医疗设备厂);BPX-162型电热恒温培养箱(上海博迅实业有限公司医疗设备厂);YXQ-LS-70A型立式压力蒸汽灭菌器(上海博迅实业有限公司医疗设备厂);HR40-Ⅱ-B2生物安全柜(青岛海尔特种电器有限公司);ZH-2型涡旋混合器(天津药典标准仪器厂)。
1.2 试药 甲磺酸达比加群酯胶囊(自制,批号:131201、131202、131203);营养肉汤培养基、营养琼脂培养基、改良马丁液体培养基、玫瑰红钠琼脂培养基、胆盐乳糖培养基、MUG培养基(青岛高科园海博生物技术有限公司);枯草芽孢杆菌(Bacillus subtilis)[CMCC(B)63501]、金黄色葡萄球菌(Staphylococcus aureus)[CMCC(B)26003]、大肠埃希菌(Escherichia coli)[CMCC(F)44102]、白色念珠菌(Candida albicans)[CMCC(F)98001]、黑曲霉(Aspergillusniger)[CMCC(F)98003](山东省食品药品检验所提供)。
2 方法与结果
2.1 菌液制备 取经35℃培养24 h的金黄色葡萄球菌、枯草芽孢杆菌、大肠埃希菌的营养肉汤培养物各1 mL,分别用0.9%无菌氯化钠溶液进行10倍稀释,其中金黄色葡萄球菌稀释至10-7、枯草芽孢杆菌稀释至10-5、大肠埃希菌稀释至10-7,做活菌计数备用。
取经26℃培养24 h的白色念珠菌改良马丁液体培养物1 mL,用0.9%无菌氯化钠溶液10倍稀释至10-5,做活菌计数备用。
取经26℃培养10 d的黑曲霉斜面培养物,加5 mL含0.05%聚山梨酯80的0.9%无菌氯化钠溶液,将黑曲霉孢子洗脱,吸取出孢子悬液1 mL,用含0.05%聚山梨酯80的0.9%无菌氯化钠溶液10倍稀释至10-4,做活菌计数备用。
2.2 菌液的检验 取上述金黄色葡萄球菌、枯草芽孢杆菌、大肠埃希菌的稀释液各1 mL,用45℃营养琼脂培养基20 mL注皿,各平行测定两皿,35℃培养3 d,逐日观察计数,应约为50~100 CFU·mL-1。
取上述白色念珠菌稀释液及黑曲霉菌孢子混悬液各1 mL,用45℃琥红琼脂培养基20 mL注皿,各平行测定两皿,26℃培养5 d,逐日观察计数,应约为50~100 CFU·mL-1。
2.3 供试液制备 取样品10 g,置研钵中,加入45℃含10%聚山梨酯80的pH 7.0无菌氯化钠-蛋白胨缓冲液适量,研磨均匀,稀释至200 mL,混匀,作为1∶20的供试液。
2.4 细菌、真菌及酵母菌计数方法的验证
2.4.1 常规法(1 mL/皿、0.5 mL/皿、0.2 mL/皿)
试验组:取1∶20供试液1、0.5或0.2 mL和“2.1”项下制备的菌液1 mL,用45℃培养基20 mL注皿,各平行测定两皿,35℃或26℃培养2~5 d,逐日观察结果,计数。
菌液组:测定每一菌株所加的试验菌数(同菌液检验)。
供试品对照组:取1∶20供试液1、0.5或0.2 mL,用45℃培养基20 mL注皿,各平行测定两皿,35℃或26℃培养2~5 d,逐日观察结果,计数。
2.4.2 薄膜过滤法(200 mL/膜) 试验组:取1∶20供试液1 mL置于含0.1%蛋白胨溶液50 mL的微生物限度检查无菌过滤器中,用0.1%蛋白胨溶液冲洗,每次100 mL,共200 mL,在最后一次冲洗液中加入50~100 CFU试验菌,取出滤膜贴于营养琼脂平板培养基中,35℃培养2~3 d,逐日观察,计数。
菌液组:测定每一菌株所加的试验菌数(同菌液检验)。
供试品对照组:取1∶20供试液1 mL置于含0.1%蛋白胨溶液50 mL的微生物限度检查无菌过滤器中,用0.1%蛋白胨溶液冲洗,每次100 mL,共200 mL,取出滤膜贴于营养琼脂平板培养基中,35℃培养2~3 d,逐日观察,计数,作为供试品本底菌数。
2.4.3 回收率计算 按如下公式计算试验组的加菌回收率:为该株阳性菌的回收率。试验组的加菌

2.4.4 验证试验结果 见表1~4。
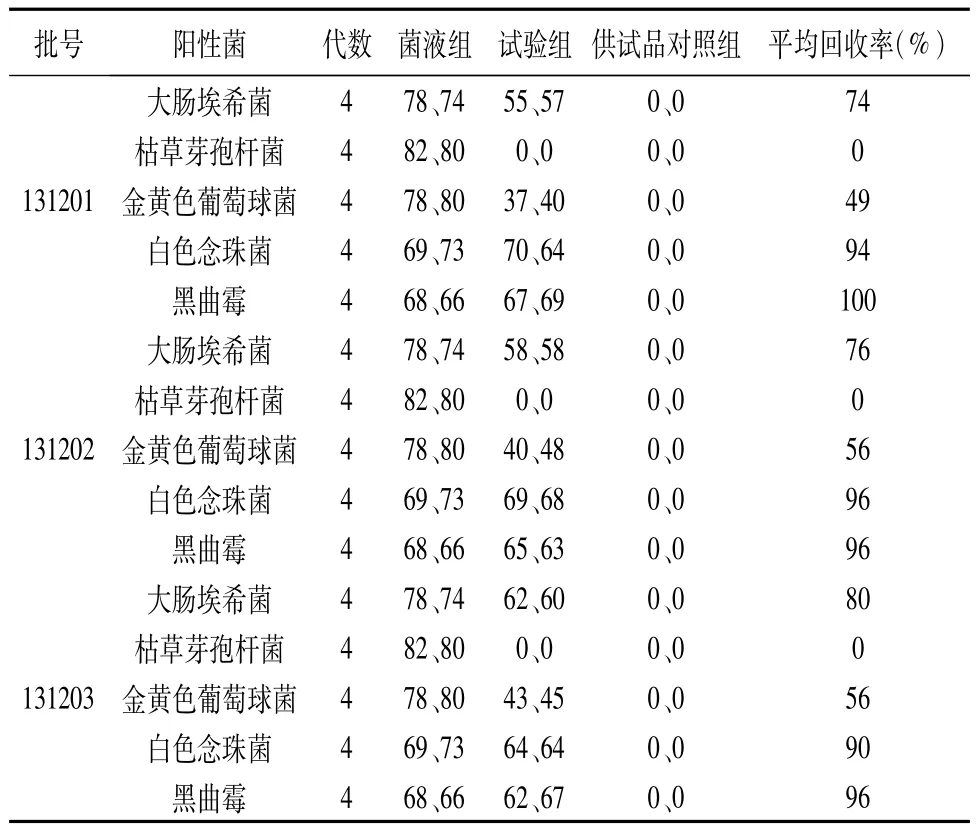
表1 平皿法(1 mL/皿)验证试验结果
由表1结果可以看出:3批供试品接种5株阳性试验菌株进行验证试验,采用平皿法(1 mL/皿)时,枯草芽孢杆菌、金黄色葡萄球菌的平均回收率小于70%,说明有抑菌活性,细菌计数需要采用平皿法(0.5 mL/皿)继续验证;白色念珠菌和黑曲霉的平均回收率均大于70%,说明无抑菌活性,可以采用平皿法(1 mL/皿)进行真菌及酵母菌计数。
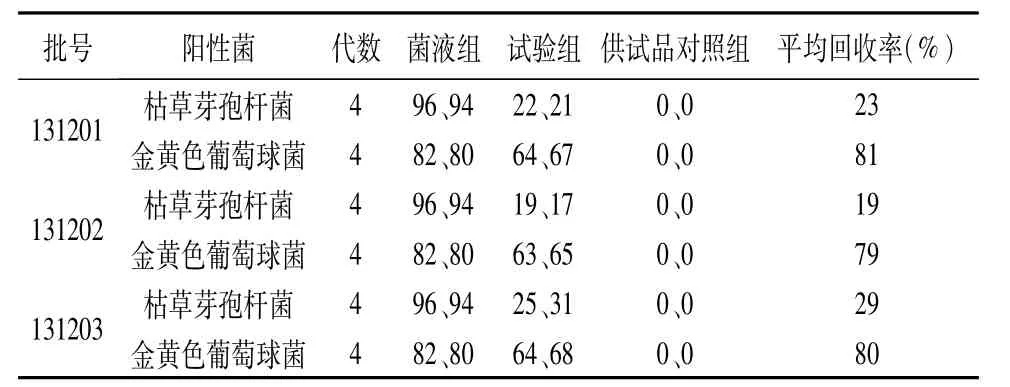
表2 平皿法(0.5 mL/皿)验证试验结果
由表2结果可以看出:采用平皿法(0.5 mL/皿)时,3批供试品枯草芽孢杆菌的平均回收率小于70%,说明有抑菌活性,细菌计数需要采用平皿法(0.2 mL/皿)继续验证。

表3 平皿法(0.2 mL/皿)验证试验结果
由表3结果可以看出:采用平皿法(0.2 mL/皿)时,3批供试品枯草芽孢杆菌的平均回收率仍然小于70%,说明有抑菌活性,细菌计数需要采用薄膜过滤法继续验证。
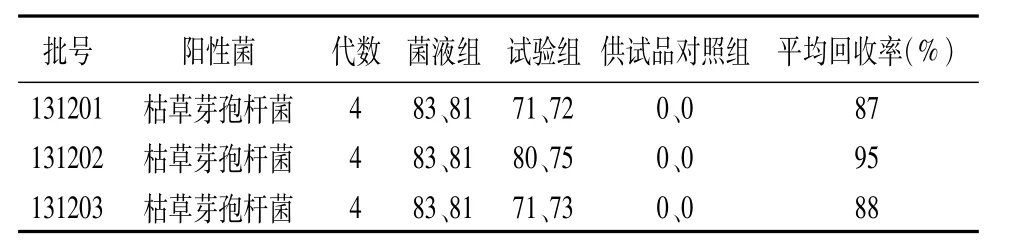
表4 薄膜过滤法(200 mL/膜)验证试验结果
由表4结果可以看出:采用薄膜过滤法(200 mL/膜)时,3批供试品枯草芽孢杆菌的平均回收率均大于70%,说明没有抑菌活性,可以采用薄膜过滤法(200 mL/膜)进行细菌计数。
2.5 大肠埃希菌检查方法的验证 试验组:取1:20供试液20 mL加入到100 mL胆盐乳糖培养基中,同时加入“3.1菌液制备”项下制备的大肠埃希菌液1 mL,置35℃培养24 h;取增菌液0.2 mL加入到5 mLMUG培养基的试管中,置35℃培养,于5、24 h在366 nm紫外线下观察,观察后沿管壁加入数滴靛基质试液观察结果记录。
供试品对照组:取1∶20供试液20 mL加入到100 mL胆盐乳糖培养基中,置35℃培养24 h;取增菌液0.2 mL加入到5 mLMUG培养基的试管中,置35℃培养,于5、24 h在366 nm紫外线下观察,观察后沿管壁加入数滴靛基质试液观察结果记录。

表5 大肠埃希菌常规法验证试验结果
由表5结果可以看出,3批供试品接种大肠埃希菌进行验证试验,试验组均能检出大肠埃希菌,而供试品对照组未检出大肠埃希菌,可以采用该方法进行大肠埃希菌的检查。
3 讨论
在日常药品检验工作中,各级药品检验机构对微生物限度检查做了大量的方法学验证试验[6~8],建议在国家药品质量标准修订时收录经过验证的微生物限度检查的具体方法,实现数据共享,减少重复工作量。
对口服制剂中微生物污染状况的控制均是各国药品质量控制的重要指标[9,10]。当药品本身具有抗菌活性时,应首先消除其抗菌活性,才能保证检验结果的有效性[9]。甲磺酸达比加群酯胶囊对枯草芽孢杆菌具有抑制作用,枯草芽孢杆菌作为敏感菌株,可以被选择用作该药品微生物限度检查的阳性试验菌株,这将大大提高检验结果的准确性。
经方法学验证,推荐甲磺酸达比加群酯胶囊微生物限度检查标准方法如下:取样品10 g,置研钵中,加入45℃含10%聚山梨酯80的pH 7.0无菌氯化钠-蛋白胨缓冲液适量,研磨均匀,稀释至200 mL,混匀,作为1∶20的供试液。取1∶20的供试液1 mL,采用薄膜过滤法(200 mL/膜)进行细菌计数的检查,采用平皿法(1 mL/皿)进行真菌及酵母菌计数的检查;取1∶20的供试液20mL,采用常规法进行大肠埃希菌的检查。
[1]李杏翠,陈晶,徐小薇.新型凝血酶抑制剂—达比加群酯[J].中国药学杂志,2011,46(9):718-720.
[2]邵丽娜,白小涓.达比加群酯在非瓣膜性心房颤动抗凝治疗中的作用及进展[J].临床心血管病杂志,2008,24(10):723-725.
[3]Rain.RE-COVER研究:新型口服抗凝药达比加群酯对急性静脉血栓栓塞治疗有效[J].中国处方药,2010,7(1):69.
[4]吕超君,谭初兵,周植星,等.新型口服抗凝药达比加群酯[J].中国新药与临床杂志,2012,31(3):113-116.
[5]国家药典委员会.中华人民共和国药典2010年版(二部)[S].北京:中国医药科技出版社,2010:附录,107-116.
[6]于风平,杨美琴,特玉香,等.含大黄、黄芩、黄连和黄柏药材的中成药微生物限度检查法的建立[J].药物分析,2010,30(3):558-562.
[7]于风平,代秀梅.防风通圣丸微生物限度检查方法学验证[J].中国药师,2010,14(11):1679-1681.
[8]卓小萍,洪美华.14种中成药微生物限度检查方法验证[J].中国药师,2008,12(12):1473-1475.
[9]李玉芹.浅谈目前无菌检查和微生物限度检查存在的问题[J].中国药事,2007,21(12):1011-1012.
[10]赵陶钧,于风平.藿胆丸微生物限度检查方法学验证实验[J].临床合理用药杂志,2013,6(22):42-44.
The establishment ofm icrobial lim it testmethod of Dabigatran Etexilate M esylate Capsules
JIA Lei1,WANG Jia-nan2
(1.School of Pharmaceutical Sciences,Zibo Vocational Institute,Zibo 255015,China;2.School of Life Sciences,Beijing Normal University,Beijing 100875,China)
ObjectiveTo establish amethod ofmicrobial limit test for Dabigatran Etexilate Mesylate Capsules.M ethodsValidation ofmicrobiological limit tests according to Chinese Pharmacopoeia edition 2010.ResultsDabigatran Etexilate Mesylate Capsules has strong inhibiting effect on Bacillus subtilis and Staphylococcus aureus in bacterium.ConclusionThe membrane filtrationmethod was used in the test of bacterium.The routinemethod was used in the test ofmold and yeasts.The routinemethod was used in the test of pathogenic bacterium.
Dabigatran Etexilate Mesylate Capsules;Microbial limits test;Validation
R927.11
A
2095-5375(2014)10-0589-003
贾雷,男,副教授,研究方向:药理学,E-mail:jleizb@163.com
