鱼酱油曲的制备工艺优化及其对蓝圆鲹的发酵作用
2014-03-01章超桦曹文红广东省水产品加工与安全重点实验室广东普通高等学校水产品深加工重点实验室广东海洋大学食品科技学院广东湛江524088
张 豪,章超桦,曹文红(广东省水产品加工与安全重点实验室,广东普通高等学校水产品深加工重点实验室,广东海洋大学食品科技学院,广东湛江524088)
鱼酱油曲的制备工艺优化及其对蓝圆鲹的发酵作用
张 豪,章超桦*,曹文红
(广东省水产品加工与安全重点实验室,广东普通高等学校水产品深加工重点实验室,广东海洋大学食品科技学院,广东湛江524088)
以低值鱼(蓝圆鲹)、麸皮、面粉为原料,采用单菌种制曲,并进行低盐液态发酵速酿鱼露,以中性蛋白酶酶活力值和发酵后鱼露中的氨基态氮的含量为评定指标,通过单因素实验及响应面分析法确定鱼酱油曲的最佳制备工艺为:鱼与麸皮质量比8∶2,菌种添加量0.9%,培养时间36h,培养温度35℃。此条件下成曲的中性蛋白酶酶活力值达到1130.85U/mL。发酵条件为:曲液添加量为10%,盐度为15%,鱼与水质量比1∶1,发酵温度37℃。在发酵14d后,鱼露中的氨基态含量达到0.681g/100mL,总可溶性氮达到0.695g/100mL。鱼露呈红褐色、颜色较暗,无悬浮物与沉淀物,具固有香味,无异臭味。研究表明该曲液能够实现速酿发酵低盐鱼露的目的。
蓝圆鲹,制曲,发酵,鱼露
鱼露(fish sauce),在我国也称为鱼酱油,主要是以海洋低值鱼(鳀鱼、沙丁鱼、蓝园鲹等)等为主要原料,与一定比例的海盐(通常鱼∶盐=3∶1或2∶1)混合,利用鱼体自身所含的组织蛋白酶等各种酶,以及在多种微生物的共同作用下,对原料鱼中的蛋白质、脂肪等成分进行分解、发酵而成的香气浓郁,色泽棕红透亮的液体调味品[1]。传统鱼露发酵一般是在常温下自然发酵1~3年,所以缩短鱼露发酵周期,进行快速发酵一直是研究重点。其中外加曲发酵是目前鱼露快速发酵的主要方式之一[2-3]。
本研究以低值鱼(蓝圆鲹)代替传统固体制曲中的豆粕来作为氮源,麸皮为碳源,利用米曲霉沪酿3.042单菌种制备液体曲[4],在单因素研究的实验基础上应用响应面对制曲工艺进行优化,希望能得到一种较好的制备液体曲的工艺。同时利用该液体曲进行低盐液态速酿鱼露发酵,以期能够实现速酿鱼露的目的。
1 材料与方法
1.1 材料与仪器
蓝圆鲹 湛江水产品批发市场;麸皮、面粉等 湛江农产品贸易市场;米曲霉沪酿3.042 上海佳民酿造食品有限公司;氢氧化钠、甲醛(36%~37%) 分析纯,国药集团上海化学试剂有限公司。
ER-T22型绞肉机 广州番禺嘉宏食品机械有限公司;01J2003-04型立式压力蒸汽灭菌器 上海博迅实业有限公司;sky-1102C型恒温培养摇床 上海苏坤实业有限公司;SW-CJ-2FD型超净工作台 上海博迅实业有限公司医疗设备厂;SLI-700型SLI-700恒温培养箱 上海爱朗仪器有限公司;PHS-2C型pH计 上海精科;UX2200H型电子天平 SHIMADZU CORPORATION JAPAN;L1100型双目微生物显微镜 广州市广精精密仪器有限公司;UV-2550型紫外可见分光光度计 日本岛津公司。
1.2 实验方法
1.2.1 检测方法 孢子数的测定:血球计数板法(SB/T 10315-1999);蛋白酶活力的测定:福林法(SB/T 10317-1999);氨基态氮(AA-N)的测定:电位滴定法[5];总氮(TSN)的测定:微量凯式定氮法;pH:数字式pH计测定;非酶褐变指数(A420nm):采用Hendel的方法[6];颜色:Sirima Dissaraphong方法测定[7];水分测定:常温干燥法[8]。
1.2.2 制曲工艺 种曲制备工艺流程:鱼+麸皮+面粉+水→蒸料→冷却→接种→培养→种曲。
1.2.2.1 原料处理 取新鲜蓝圆鲹清洗干净,沥干,用绞肉机绞碎后,加2倍水进行匀浆,得到匀浆液。另取麸皮,加等质量的水进行润湿。然后按照不同的鱼与麸皮质量比进行混合,混合后加入0.5%的面粉于0.12MPa灭菌、蒸料20min。
1.2.2.2 孢子悬浮液的制备[9]米曲霉沪酿3.042采用PDA培养基进行斜面活化,一般2~3d即可结束。活化后的米曲霉在斜面上密生嫩黄色的孢子,无杂菌、无夹心,具有曲子特有香气,无霉臭及其他异味。取已活化好的斜面菌种一支,加入5mL无菌水,轻轻将表面的孢子刮下,将该孢子悬浮液置于已灭菌50mL三角瓶内,瓶中预先放置数粒无菌玻璃球,充分振摇后用灭菌的脱脂棉进行过滤,并用无菌水冲洗滤渣2~3次,最终使滤液体积达到10.0mL,待测孢子悬浮液即得。
1.2.2.3 种曲的制备 将熟料等分于经灭菌的三角瓶中,以不同比例接入孢子悬浮液,于不同温度,不同时间进行制曲。
1.2.2.4 粗酶液的制备 制曲完成后,在6500r/min条件下离心10min,离心后取上清液即得粗酶液。
1.2.3 制曲工艺单因素实验 鱼酱油曲曲液品质的主要影响因素有鱼与麸皮质量比(以下简称鱼麸比)、菌种添加量、培养时间、培养温度等。为了考察各个因素对制曲效果的影响,首先进行单因素实验,以鱼麸比(9∶1、8∶2、7∶3、6∶4、5∶5)、菌种添加量(0.3%、0.6%、0.9%、1.2%、1.5%)、培养时间(24、36、48、60、72h)、培养温度(27、32、37、42、47℃)作为考察因素,以主要的中性蛋白酶酶活力作为测定指标。
1.2.4 响应面优化制曲工艺 根据单因素实验结果,依据设计软件JMP7.0进行实验设计、统计分析和构建模型。根据中心组合实验设计原理,设计四因素三水平的响应分析实验,选取鱼麸比、菌种添加量、培养时间和培养温度4个因素,分别以X1、X2、X3、X4表示,每一个自变量的低、中、高实验水平分别以-1、0、1进行编码,以中性蛋白酶酶活力值为响应值(Y),各因素编码值见表1。通过响应面分析对提取条件进行优化。

表1 响应面分析因子和水平表Table 1 Factors and levels of response surface experiments
1.2.5 鱼酱油曲对蓝圆鲹的发酵作用 在响应面优化所得的最佳条件下制得的液体曲按不同的曲液添加量,对蓝圆鲹进行发酵,在单因素基础上对发酵工艺进行四因素三水平的正交实验优化(表2),找出最优的盐度、鱼与水混合比例(以下简称料水比)、曲液的添加量和温度,确定出较优的发酵工艺。并跟踪监测各种发酵指标,了解该曲对蓝圆鲹的发酵作用。

表2 正交实验因素和水平表Table 2 Factors and levels of orthogonal test
1.2.6 发酵过程理化指标的测定 在发酵期间,每隔2d取发酵液20mL于50mL的三角瓶中,并用封口袋封口,沸水浴10min后过滤,滤液用于各项理化指标的测定[10]。
1.3 数据处理
采用Excel和JMP7.0软件进行数据统计。所有样品均作三次平行,数据以“平均值±标准差”表示。
2 结果与讨论
2.1 制备鱼酱油曲的单因素实验
以中性蛋白酶酶活力值为测定指标,分别考察鱼麸比、菌种添加量、培养时间及培养温度对指标的影响。
2.1.1 鱼麸比对中性蛋白酶酶活力值的影响 将不同比例的熟料分装于已灭菌的三角瓶中,菌种添加量为0.6%(孢子浓度为3.25×109个/mL),于32℃恒温摇床(转速140r/min)内培养48h。其结果如图1所示。
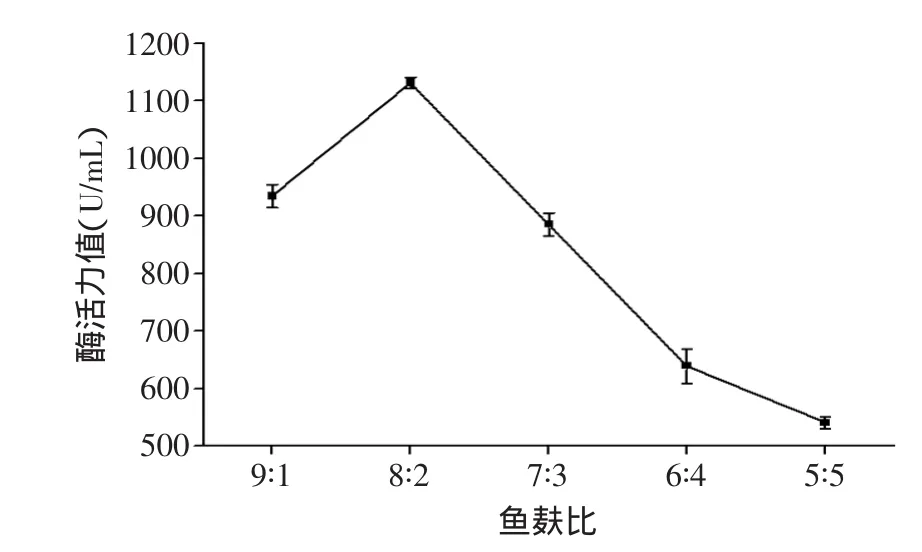
图1 鱼麸比对中性蛋白酶活力的影响Fig.1 The effect of materialrate on neutral activity
从图1看出,在鱼麸比8∶2时(即鱼与麸皮质量比8∶2),酶活力值最大。随着鱼麸比的减小(即碳氮比的增大)反而呈下降趋势,反映在图1中就是酶活力值降低。米曲霉的生长需要适当的碳氮源比例,所以原料中鱼与麸皮的配比会对米曲霉的生长有一定的影响[11]。相比于传统的大豆固体曲来讲,成曲酶活力还很低,这是因为传统的米曲霉适宜利用植物蛋白,而对水产动物蛋白的利用率较低。
2.1.2 菌种添加量对中性蛋白酶酶活力值的影响 将鱼麸比8∶2的熟料分装于已灭菌的三角瓶中,按不同的菌种添加量(孢子浓度为3.25×109个/mL)进行接种,于32℃恒温摇床(140r/min)内培养48h。考察不同菌种添加量对中性蛋白酶活力的影响。
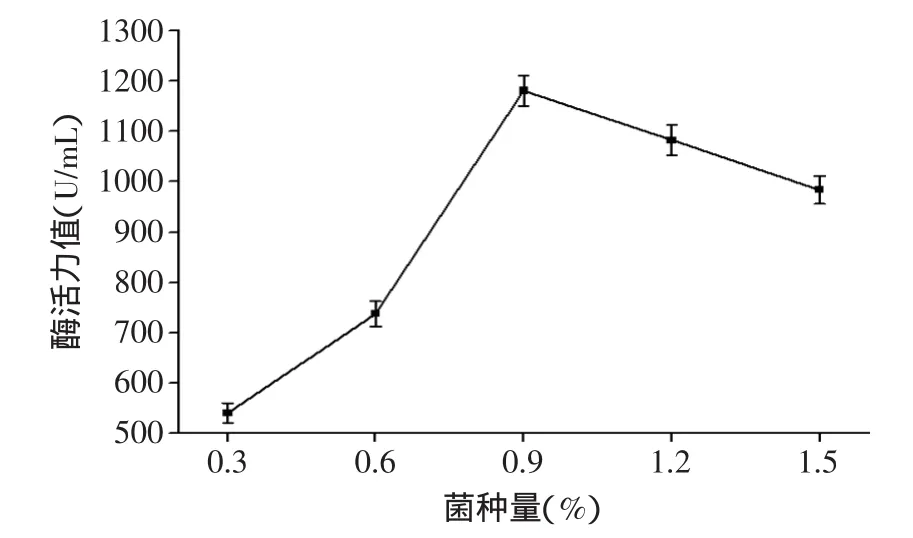
图2 菌种添加量对中性蛋白酶活力的影响Fig.2 The effect of bacteria additive rate on neutral activity
由图2得出,随着米曲霉孢子液添加量增加,酶活力值显著增大,但孢子液添加量超过0.9%以后,酶活力值呈下降趋势。这是因为米曲霉在生长的过程中会消耗大量的营养成分,同时产生大量的次级代谢产物,添加量过大,会导致短时间内营养成分的大量消耗以及次级代谢产物的大量生成,无法利用米曲霉进一步生长繁殖,从而影响曲液的酶活力值。因此取0.9%为最佳孢子液添加量[12]。
2.1.3 培养时间对中性蛋白酶酶活力值的影响 将鱼麸比8∶2的熟料分装于已灭菌的三角瓶中,菌种添加量为均0.9%(孢子浓度为3.25×109个/mL),于32℃恒温摇床(转速140r/min)内培养不同的时间,其见图3。从图3可以看出,对于制曲时间,从24到72h,曲液酶活力值整体呈下降趋势,在制曲的过程中,随着时间的推移,米曲霉会逐渐生长趋于老化,会影响所分泌酶系的活力,考虑到曲霉对原料鱼的利用情况,所选最佳制曲时间为36h。
2.1.4 培养温度对中性蛋白酶酶活力值的影响 将鱼麸比8∶2的熟料分装于已灭菌的三角瓶中,菌种添加量为均0.9%(孢子浓度为3.25×109个/mL),于不同温度的摇床(转速140r/min)内培养36h,结果见图4。
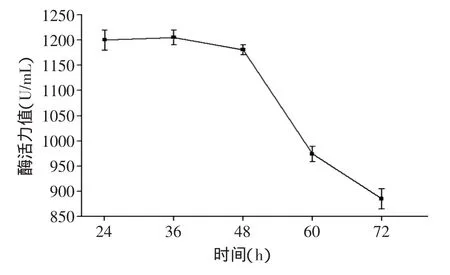
图3 培养时间对中性蛋白酶活力的影响Fig.3 The effect of time on neutral activity
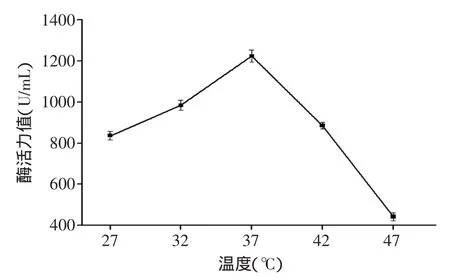
图4 培养温度对中性蛋白酶活力的影响Fig.4 The effect of temperature on neutral activity
如图4所示,对于制曲温度,随着温度的升高,酶活力值显著增大,到37℃为最大,超过37℃以后,酶活力值急剧下降。这可能由于温度过高,导致米曲霉生长极其缓慢甚至停止生长,也就是俗称的“烧曲”。因此所选最佳制曲温度为37℃。
2.2 鱼酱油曲制备工艺的响应面分析与优化
2.2.1 响应面实验设计结果 依据设计软件JMP7.0进行实验设计、统计分析和构建模型,根据Box-Behnken的中心组合实验设计原理,综合单因素实验结果,以鱼麸比(X1)、菌种添加量(X2)、培养时间(X3)和培养温度(X4)值为自变量,以中性蛋白酶酶活力值(Y)为因变量,实验设计及结果见表3。
2.2.2 拟合回归方程的建立 以中性蛋白酶酶活力值(Y)为因变量,以鱼麸比(X1)、菌种添加量(X2)、培养时间(X3)和培养温度(X4)值为自变量,建立回归方程如下:Y=1178.72+2.35X1-16.31X2+3.26X3-140.31X4-57.97X1X2-12.44X1X3+16.16X2X3-3.74X1X4-27.22X2X4+13.21X3X4-113.49X12-116.66X22-193.39X32-238.3X42。回归方程的方差分析结果见表4。
由表4方差分析可知,模型Prob>F值小于0.01,表明回归方程是极显著的。失拟项的Prob>F值大于0.05,说明所得方程与实际拟合中非正常误差所占的比例小,表示所得回归方程是好的[13]。同时模型相关系数R2=0.9618,说明该方程能够很好地反映响应值,因此,可以用此模型方程对制曲条件进行预测分析。
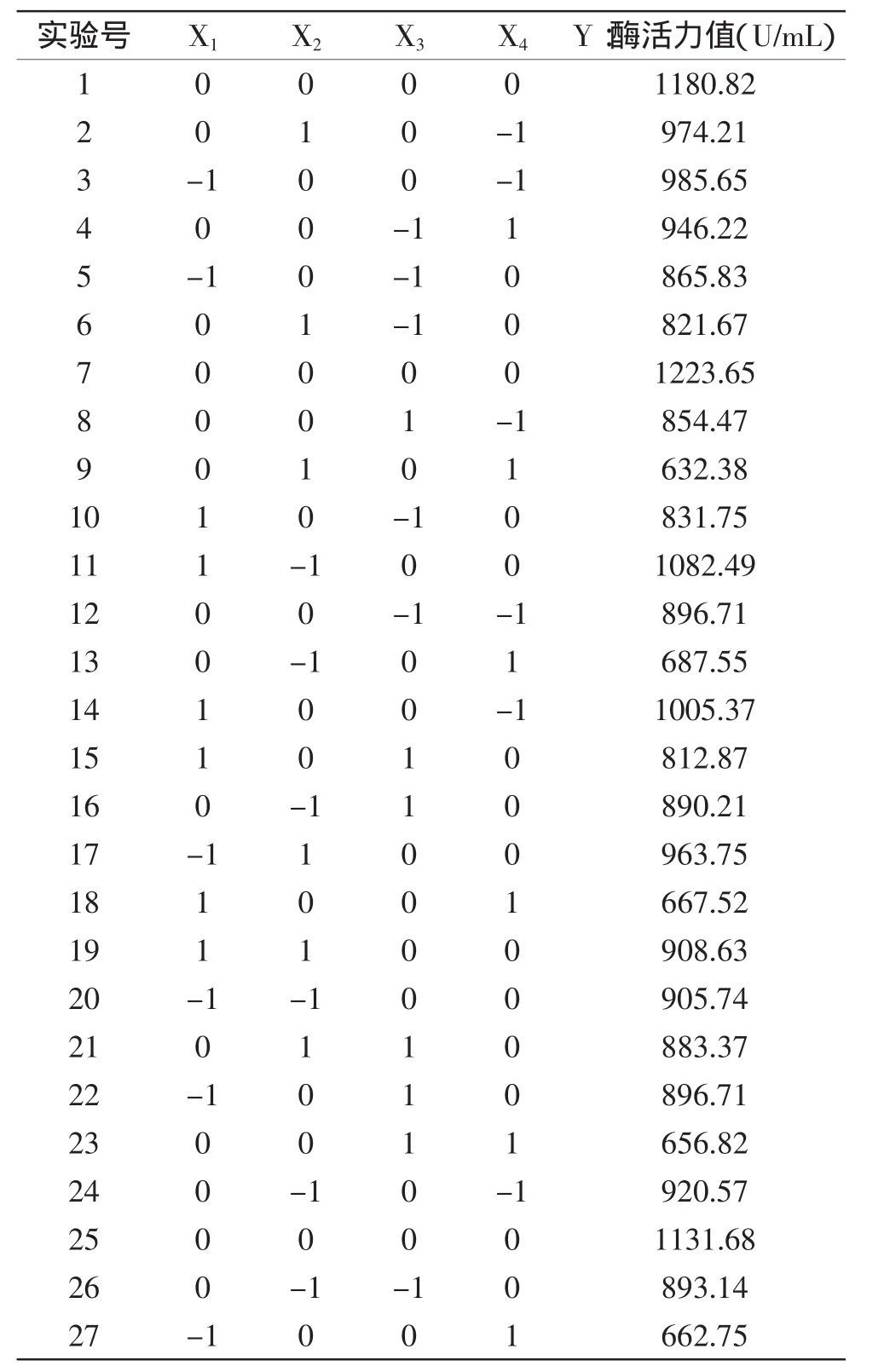
表3 响应面实验方案及结果Table 3 Projects and results of response surface experiments
2.2.3 响应面分析 通过表4中:F(X1)=0.03,F(X2)= 1.51,F(X3)=0.06,F(X4)=111.43,得各因素对制曲条件的影响程度由大到小为:培养温度>菌种添加量>培养时间>鱼麸比。在4个因素交互作用下,交互项X1X2、X1X3、X2X3、X1X4、X2X4、X3X4的F值分别为6.33、0.29、0.49、0.03、1.40、0.33,表明只有X1X2的交互作用影响显著,即鱼麸比与菌种添加量的交互作用影响显著,它们之间的交互作用响应面图见图5,其他因素间交互作用影响不显著。由图5可以看出,鱼麸比与菌种添加量对中性蛋白酶酶活力值的影响较大,随着鱼麸比的增加及菌种添加量的增多,酶活力值呈先升后降趋势。其主要原因在于米曲霉在生长的过程需要适宜的碳氮比。菌种量过多或过少都会影响到米曲霉后期的生长,进而影响其分泌蛋白酶系。因此,只有适宜的鱼麸比及菌种添加量,所制得的液体曲质量才会较理想。
2.2.4 响应面优化及验证 通过JMP7.0预测刻画功能,得到制曲工艺的最佳条件为:鱼麸比8∶2、菌种添加量0.88%,培养时间36.04h,培养温度34.56℃。考虑实际操作条件,将上述最佳制曲条件修正为:鱼麸比8∶2、菌种量0.9%、培养时间36h、培养温度35℃。该条件下平行3次测中性蛋白酶活力均值为1130.85U/mL,相对误差为0.98%。说明了该响应面模型具有较好的预测能力,因此可利用该响应面对制曲过程进行预测分析。
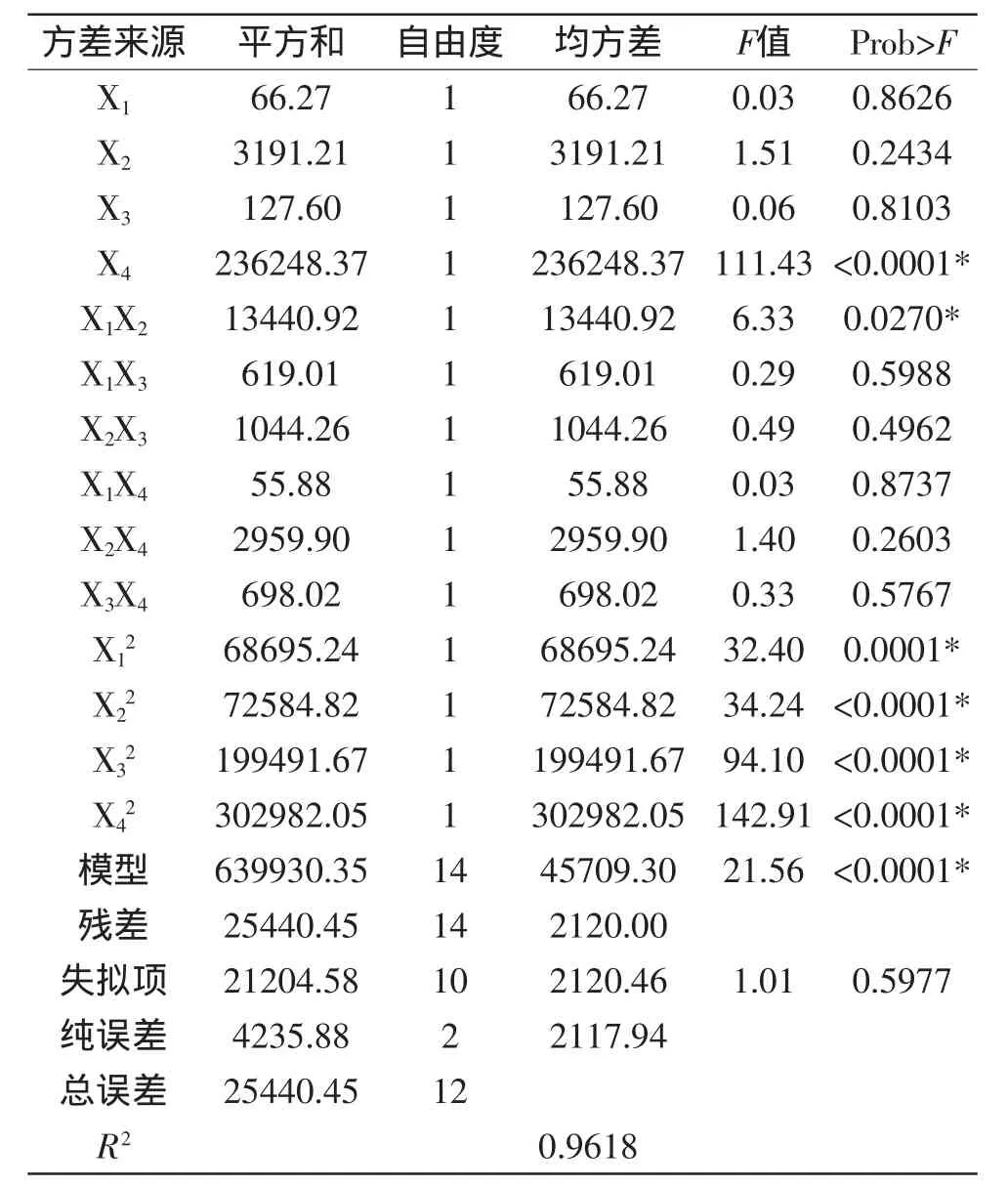
表4 回归方程的方差分析结果Table 4 Analysis results of response surface experiments
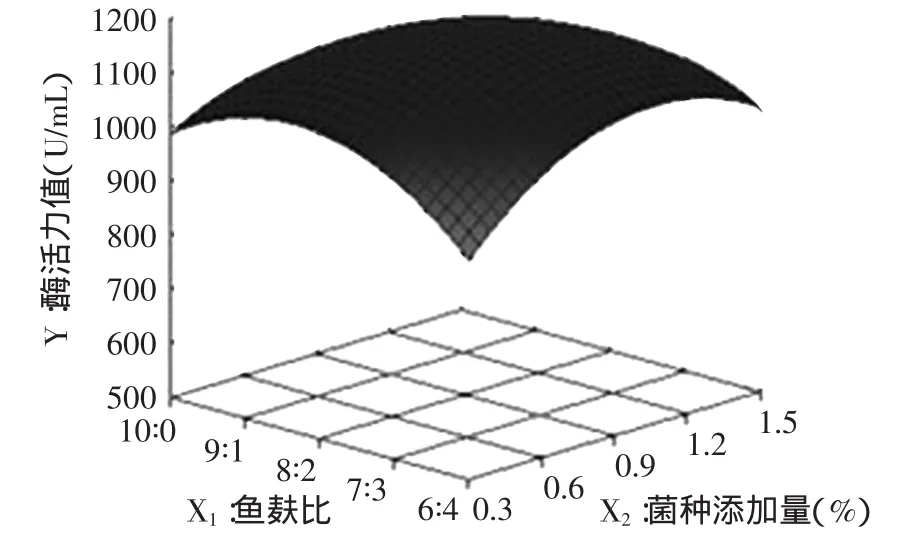
图5 Y=F(X1:鱼麸比,X2:菌种添加量)对中性蛋白酶酶活力值影响的响应曲面图Fig.5 Response surface plot of the effects of X1and X2on the neutral activity
2.3 鱼酱油曲对蓝圆鲹的发酵作用
2.3.1 低盐发酵蓝圆鲹工艺的优化 通过前期单因素实验及参考文献[14]初步确定了发酵的基本条件为:曲液添加量10%、盐度10%、料水比1∶1.5、温度37℃。在此条件下发酵14d基本完成了对蓝圆鲹的低盐发酵过程。考虑到各个因素这件的交互作用,通过L9(34)正交实验进行工艺优化,结果见表5。
由表5可以得出,各因素对发酵的影响由主到次的顺序为:D(温度)、A(加盐量)、C(曲液添加量)、B(料水比)最优发酵条件为A2B2C1D2,即:加盐量为15%,料水比为1∶1,曲液添加量为10%,发酵温度为37℃。在此条件下进行三次平行验证实验,所测氨基态氮的含量达到0.681g/100mL,与实验组6比较接近,高于其他组结果,在保证底物浓度的前提下,最终选择在最优条件A2B2C1D2下进行发酵。
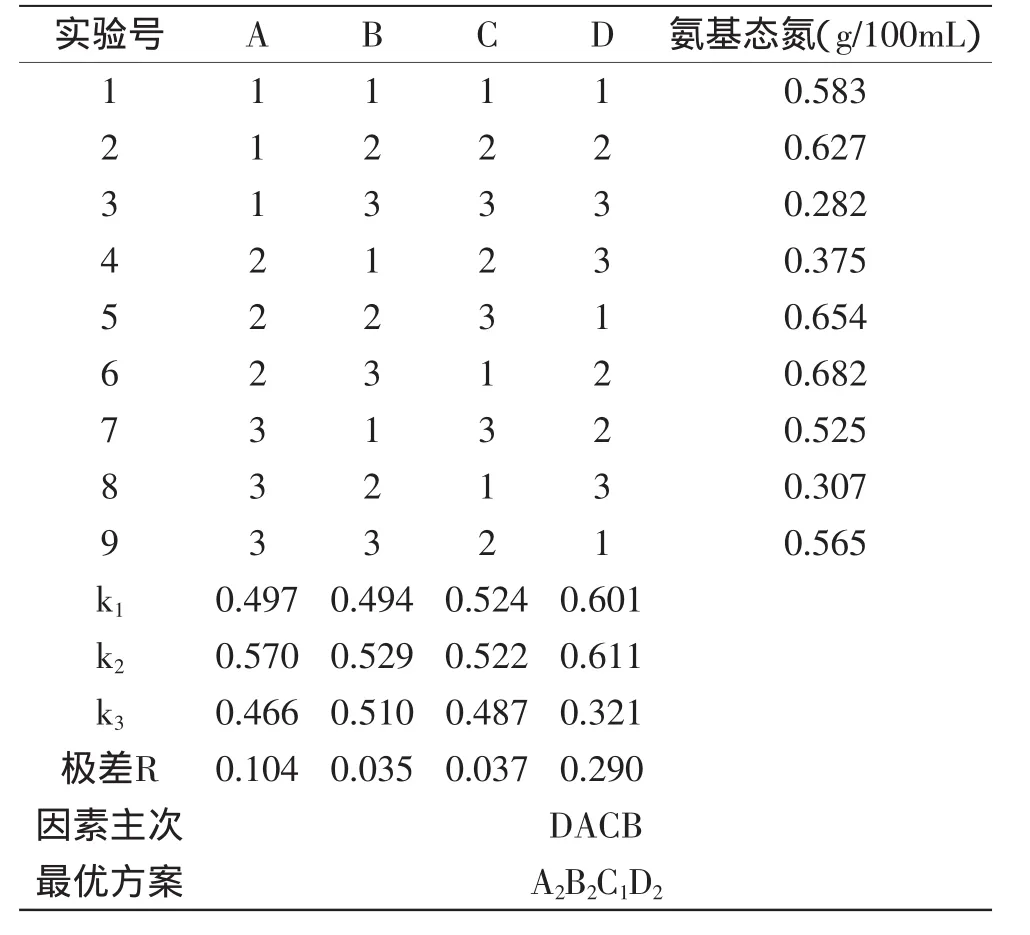
表5 发酵条件正交实验表Table 5 Orthogonal test results of fermentation
2.3.2 发酵过程理化指标的测定
2.3.2.1 发酵过程中可溶性氮(TSA)及氨基态氮(AA-N)含量的变化 总可溶性氮(TSN)是鱼露质量分级的重要指标之一,主要为游离的氨基酸氮、小分子肽氮及可溶性蛋白氮等。从总体(图6)来看,在发酵期间总氮量随时间的增长有明显增加的趋势,初期总氮含量是0.128g/100mL,至酿造14d时增加至0.695g/100mL。同时氨基酸作为鱼露中重要的呈味物质,氨基酸态氮含量的大小能够反映发酵液的老化程度及风味特点[15]。从图6可知,随着发酵时间的增加,氨基态氮含量也明显增多,到第14d时含量为0.681g/100mL,接近国家二级鱼露标准。
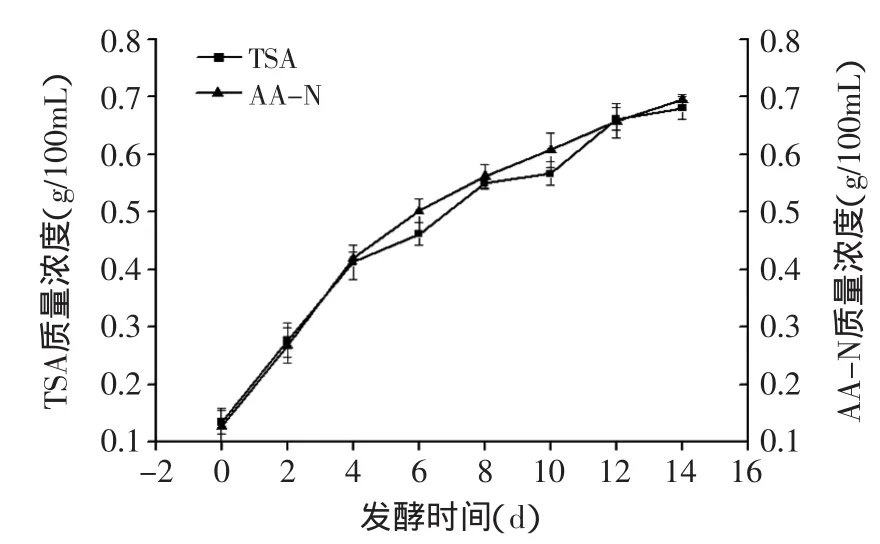
图6 发酵过程中氨基态氮(AA-N)与总氮(TSA)的变化Fig.6 Changes of amino-nitrogen and total nitrogen during fermentation
2.3.2.2 发酵过程中pH及总酸的变化 由图7可知,在发酵的过程中pH有较大的上升趋势,在第10d以后,pH增加的趋势平缓,并有下降的趋势。总酸含量有明显的增加,但其总量还很低。在发酵的过程中,曲液中的蛋白酶将鱼蛋白降解成胺、氨等碱性物质会致使pH升高,而发酵液中微生物所分泌的有机酸等物质又会使pH下降,这二者共同影响pH的变化[16],发酵的初期,曲液的蛋白酶活力值较大,发酵液中的微生物较少,所降解的碱性物质会导致pH升高,随着发酵时间的增加,曲液酶活力逐渐降低,发酵液中微生物逐渐增多,酸性物质逐渐增多,pH上升趋势平缓,并会有下降的趋势。
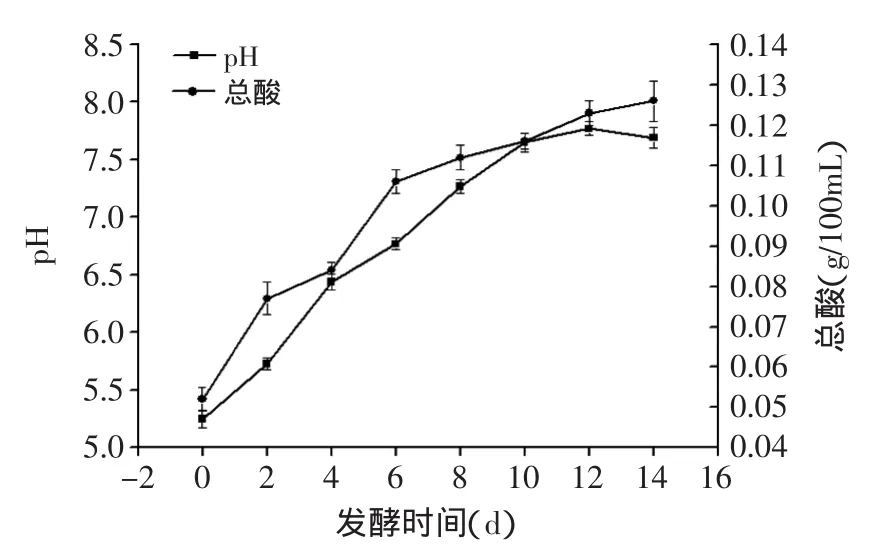
图7 发酵过程中pH及总酸含量的变化Fig.7 Changes of pH and titrable acidity during fermentation
2.3.2.3 发酵过程中非酶褐变指数及颜色的变化 从图8可以看出,发酵液的非酶褐变指数逐步增大,第10d后增长稍微缓慢,发酵液的褐变反应主要为非酶褐变反应,在发酵液中大部分游离氨基酸和短肽可与微生物所产生的次级代谢产物(一些还原糖及多糖衍生物)参与Maillard反应形成吡嗪等物质[17-18]。同时发酵液色差的L*值与b*值都呈现下降趋势,但是其分值较大,而a*值则呈现上升趋势。但分值还较小,表明发酵液亮度较暗、呈现偏黑色,较接近于酱油的颜色,表明该曲液能促进发酵液颜色的形成,这与非酶褐变指数的测定结果一致。
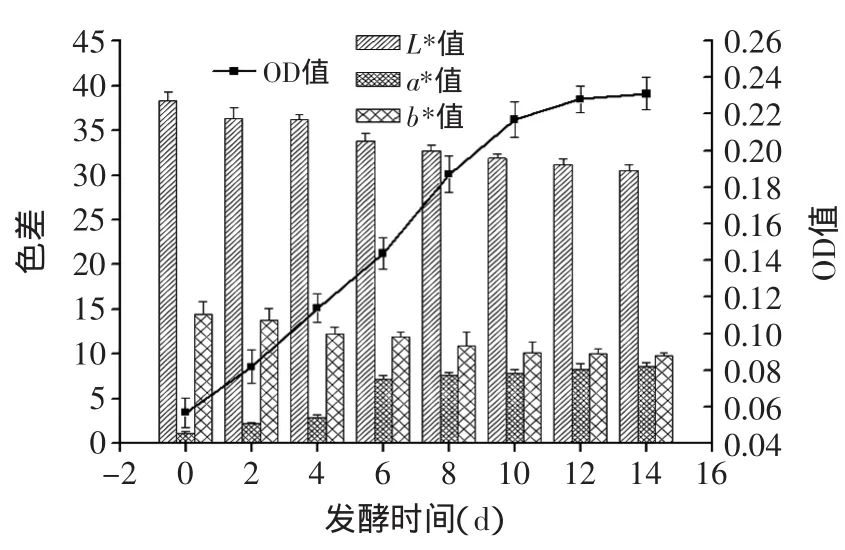
图8 发酵过程中非酶褐变指数及颜色的变化Fig.8 Changes of non-enzyme browning index and the color during fermentation
3 结论
本实验在单因素实验的基础上,利用响应面法对鱼酱油制曲工艺进行了优化,得到了鱼酱油制曲工艺的二次回归模型方程,并进一步确定了制曲的最佳工艺条件为:鱼麸比8∶2、菌种添加量为0.9%、培养时间36h、培养温度35℃。该条件下平行3次测定中性蛋白酶活力均值为1130.85U/mL,相对误差为0.98%。并初步利用该曲进行速酿发酵鱼露,确定在盐度15%、料水比1∶1、曲液添加量为10%、温度为37℃的条件下进行发酵,在发酵的第14d,发酵液中的氨基态氮含量达到0.681g/100mL,总可溶性氮含量达到0.695g/100mL。同时,鱼露呈红褐色,无悬浮物和沉淀物,具固有香味,无异臭味。表明该鱼酱油曲在恒温条件下能够实现速酿发酵低盐鱼露的目的。
[1]陶红丽,朱志伟,曾庆孝,等.鱼露快速发酵研究进展[J].食品研究与开发,2009,34(2):79-82.
[2]Uchida M,Ou J,Bi-Wen Chen,et al.Effect of soy sauce Koji and lactic acid bacteria on the fermentation of fish sauce from freshwater silver carp Hypophthal michthys molitrix[J].Fisheries Science,2005,71(2):422-430.
[3]张雪花,陈有容,内田基晴,等.鲢及其加工废弃物发酵鱼露的比较[J].上海水产大学学报,2000,9(3):226-230.
[4]毋瑾超,朱碧英,胡锡钢,等.鱼肉液体制曲的工艺条件[J].湛江海洋大学学报,2002,22(3):33-37
[5]王启军.食品分析实验[M].北京:化学工业出版社,2011:28-30.
[6]Hendel C E,Bailey G F,Taylor D H.Measurement of nonenzymatic browning of dehydrated vegetables during storing storage[J].Food Technology,1950(3):44-48.
[7]Dissaraphong S,Benjakul S,Visessanguan W,et al.The influence of storage conditions of tuna viscera before fermentation on the chemical,physical and microbiological changes in fish sauce during fermentation[J].Bioresource Technology,2006,97:2032-2040.
[8]上海酿造科学研究所.发酵调味品生产技术[M].北京:中国轻工业出版社,1999,516-668.
[9]谢善慈,杨瑞.米曲霉制曲条件的研究[J].酿酒科技,2009,24(3):43-45.
[10]晁岱秀.分段式快速发酵鱼露工艺的研究[D].广州:华南理工大学,2010:31-45.
[11]胡晓刚,马莺,何胜华,等.米曲霉Y29制曲条件研究[J].食品科技,2007,7(3):38-41.
[12]孔繁东,霍奕璇.鱼酱油制曲菌种筛选及制曲条件研究[J].中国酿造,2012,31(10):86-89.
[13]徐向宏,何明珠.实验设计与Design-Expert、SPSS应用[M].北京:科学出版社,2010:154-155.
[14]何雪莲.罗非鱼加工下脚料发酵生产鱼露的研究[D].儋州:华南热带农业大学,2007:25-28.
[15]Byun M W,Lee K H,Kim D H,et al.Effect of gamma radiation on sensory qualities,microbiological and chemical properties of salted and fermented squid[J].Journal of Food Protection,2000,63:934-939.
[16]晁岱秀,朱志伟,曾庆孝.低盐外加曲发酵潮汕鱼露的理化性质变化[J].食品与生物技术学报,2010,29(5):410-415.
[17]Hjalmarsson G H.Fish sauce from capelin(Mallotur villosus)as affected by harvest season[M].University of Iceland,Reykjav’k,Iceland,2001:78-82.
[18]Kawashima K,Y amanaks H.Free amino acids responsible for the browning of cooked scallop adductor muscle[J].Fisheries Science,1996,62(2):293-296.
Optimization of koji-making technology for preparing fish sauce and its fermentation of blue scad
ZHANG Hao,ZHANG Chao-hua*,CAO Wen-hong
(Guangdong Provincial Key Laboratory of Aquatic Products Processing and Safety,Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution,College of Food Science and Technology,Guangdong Ocean University,Zhanjiang 524088,China)
Using low-value fish,bran and wheat flour as raw materials,fermentation technology of low-salt liquid-state fish sauce was researched by adopting only one kind of bacterium koji-making.Using the contents of enzyme active of neutral protease and the amino nitrogen as indexes,according to single factor tests and response surface method,the optimum koji-making conditions were as follows:material rate was 8∶2,adopting bacterium was 0.9%,cultural time was 36h,and cultural temperature was 35℃.Under this optimal condition,the neutral protease activity was as high as 1130.85U/mL.The fermentation technology conditions of fish sauce were as follows:adding fish liquid koji-making was 10%,salinity was 15%,material rate was 1∶1,and fermentation temperature was 37℃.Under such conditions,the content of amino nitrogen reached 0.681g/100mL and the content of total soluble nitrogen also could reach 0.695g/100mL after 14d.In addition,red-brown and transparent,no suspension and no precipitate were the major characteristics of the fish sauce prepared at optimal fermentation condition.This study showed that the fish liquid koji-making could reach low-salt liquidstate fish sauce.
blue scad;koji-making;fermentation;fish sauce
TS201.3
A
1002-0306(2014)14-0215-06
10.13386/j.issn1002-0306.2014.14.039
2013-10-09 *通讯联系人
张豪(1987-),男,在读硕士研究生,研究方向:水产品高值化加工与利用研究。
广东省水产蛋白改性技术研究团队专项经费(2011A020102005)。
