2种苯磺酸氨氯地平片的相对生物利用度及生物等效性对比分析
2014-02-27张丽娜张懋璠闫笛韩操谭博宋岩孟胜男
张丽娜,张懋璠,闫笛,韩操,谭博,宋岩,孟胜男
(1.沈阳医学院附属中心医院重症医学科,沈阳110024;2.中国医科大学药学院药剂学教研室,沈阳110001)
2种苯磺酸氨氯地平片的相对生物利用度及生物等效性对比分析
张丽娜1,张懋璠2,闫笛1,韩操1,谭博1,宋岩1,孟胜男2
(1.沈阳医学院附属中心医院重症医学科,沈阳110024;2.中国医科大学药学院药剂学教研室,沈阳110001)
目的研究2种苯磺酸氨氯地平片的相对生物利用度及其生物等效性。方法采用双周期、随机、交叉试验设计,将20名男性健康受试者随机分成2组,单剂量、交叉口服受试制剂及参比制剂苯磺酸氨氯地平片10 mg,采集不同时间点的静脉血样,用超高效液相色谱—串联质谱法测定给药后不同时间氨氯地平的血药浓度。结果受试试剂及参比试剂的主要药代动力学参数如下:Tmax分别为(6.32±0.85)h和(5.95±1.23)h;Cmax分别为(6.231±1.734)ng·mL-1和(6.138±1.352)ng·mL-1;T1/2分别为(39.89±9.43)h和(40.02±7.49)h;AUC0-144分别为(273.473±97.167)ng·h·mL-1和(278.314±80.340)ng·h·mL-1;AUC0-∞分别为(303.480±106.054)ng·h·mL-1和(306.412±91.351)ng·h·mL-1。受试制剂对参比制剂的相对生物利用度为(99.7±20.2)%。统计分析结果表明2种苯磺酸氨氯地平片在不同制剂间和不同周期间差异无统计学意义(P>0.05)。结论苯磺酸氨氯地平片的受试制剂与参比制剂具有生物等效性。
氨氯地平片;相对生物利用度;生物等效性;超高效液相色谱—串联质谱法
苯磺酸氨氯地平是新一代长效钙离子拮抗剂,它通过对细胞外钙离子进入细胞内的抑制,从而控制心肌和平滑肌的收缩,降低外周血管阻力,主要适用于治疗心绞痛和高血压[1]。该药有服药量低、药效持续时间长的特点,可单独使用,也可与血管紧张素Ⅱ受体抑制剂、血管紧张素转化酶抑制剂、利尿剂等联合应用。虽然关于氨氯地平血药浓度测定的文献较多[2~6],但由于苯磺酸氨氯地平的血药浓度较低、分析时间较长、灵敏度也不高,因此我们根据其化学结构特性和相关文献[7~9],采用超高效液相色谱—串联质谱法(ultraperformance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)测定人血浆中苯磺酸氨氯地平浓度,并对不同厂家的苯磺酸氨氯地平进行生物利用度和等效性评价,为临床用药提供参考。
1 材料与方法
1.1 研究对象
选择健康成年男性志愿者20名,平均年龄(22.52±1.22)岁,身高(177.15±5.54)cm,体质量(70.17±6.10)kg。血、尿常规,肝、肾功能,血压,心电图及胸透等均正常。受试前2周至试验结束不服用其他药物。由本人签署知情同意书,经沈阳医学院
附属中心医院伦理委员会批准。
1.2 试剂
受试制剂(T)(苯磺酸氨氯地平片,规格:2.5 mg/片,批号:国药准字H20113529,杭州国光药业有限公司);参比制剂(R)(苯磺酸氨氯地平片,商品名:络活喜,规格:5 mg/片,批号:国药准字H10950224,辉瑞制药有限公司);苯磺酸氨氯地平对照品(中国药品生物制品检定所,批号:100374200903,纯度99.0%);内标盐酸普萘洛尔对照品(中国药品生物制品检定所,批号:100783-200401,纯度99.0%);乙腈、甲酸为色谱纯,其余试剂均为分析纯;空白人血浆(沈阳医学院附属中心医院)。
1.3 主要仪器
ACQUITY Ultra Performance LCTM超高效液相色谱系统(美国Waters公司);Tandem Quadrupole Detector质谱检测器(含电喷雾离子化源以及Masslynx 4.1数据处理软件,美国Waters公司);XW-80A旋涡混合仪(上海精科实业有限公司);Adventurer电子分析天平AR1140(奥豪斯国际贸易有限公司);SIGMA 2K-15型高速低温离心机(美国Sigma公司);Milli-Q Plus纯水器(Millipore中国有限公司)。
1.4 方法
1.4.1 血样采集:本试验采用双周期自身交叉试验设计,受试者随机分为2组,每组10名。受试者每次试验时分别服用受试或参比制剂,每次用药间隔2周。受试者于试验前1 d晚21时前开始禁食,禁食12 h,第2日早上7时单次空腹口服受试制剂或参比制剂10 mg,200 mL温开水送服。试验2 h后可适量饮水,4.5 h和9.5 h后进食低脂标准餐。分别于给药前(0 h)及给药后1、2、4、6、8、12、24、36、48、96、120、144 h,各取上肢静脉血3~5 mL,置于肝素预抗凝EP管中,常温静置0.5 h后,3 500 r/min离心10 min,分离上层血浆约2 mL,-40℃避光保存备用。
1.4.2 色谱条件:ACQUITY UPLCTMBEH C18色谱柱(50 mm×2.1 mm,1.7 μm);流动相:乙腈∶0.2%甲酸溶液(V/V)=60∶40,流速:0.2 mL·min-1;柱温:35℃;进样量:5 L。
1.4.3 质谱条件:离子源:ESI源(电离子喷雾离子化源)、离子喷射电压3 500 V、温度350℃;源内气体1(N2)压力40 psi;源内气体2(N2)压力60 psi;气帘气体(N2)压力25 psi。正离子方式检测。扫描方式:多反应离子监测方式;苯磺酸氨氯地平和普萘洛尔的DP电压为55 V;碰撞气(N2)压力:中等;用于定量分析的离子反应分别为m/z 409.00→238.10(氨氯地平)和m/z 260.19→116.10(普萘洛尔,内标),扫描时间0.2 s。
1.4.4 血浆样品处理方法:取500 L血浆样品,置于玻璃试管中,分别加入流动相50 L、内标溶液(20 ng·mL-1普萘洛尔溶液,用流动相配制)50 L,漩涡混合1 min,加入提取溶剂乙醚3 mL,充分漩涡混合3 min,3 000 r/min离心10 min,取上层有机相于40℃水浴氮气吹干,残余物于100 L流动相复溶,进样5 L进行UPLC-MS/MS分析。
1.4.5 溶液配制:(1)氨氯地平储备液:苯磺酸氨氯地平对照品27.7 mg(相当于氨氯地平20.0 mg),置于100 mL量瓶中,以乙腈水(60∶40,v/v)溶液溶解并稀释至刻度,摇匀,作为氨氯地平母液(0.20 mg·mL-1)。精密吸取0.5 mL母液置100 mL容量瓶中,以乙腈水溶液稀释至刻度得氨氯地平标准储备液(1.00 μg·mL-1),于冰箱(4℃)内保存备用。(2)内标溶液:盐酸普萘洛尔对照品22.5 mg(相当于普萘洛尔20.0 mg)置100 mL容量瓶中,用乙腈水稀释定容至刻度,摇匀,得浓度为0.20 mg·mL-1的普萘洛尔母液。精密吸取母液1 mL置100 mL容量瓶中,用乙腈水(60∶40,V/V)溶液稀释至刻度,得浓度为20 μg·mL-1的标准溶液。精密吸取20 μg·mL-1的标准溶液100 mL置100 mL容量瓶中,用乙腈水稀释并定容至刻度,得浓度为20 ng·mL-1的标准溶液作为内标工作液,4℃保存备用。
1.5 数据处理
采用DAS 2.0程序分别计算各受试者的有关药动学参数。根据血药浓度—时间曲线末端血药浓度点,以lnC对t进行回归,求得消除速率常数Ke;T1/2=0.693/Ke;Cmax、Tmax为试验的实测值,以梯形面积法计算AUC0-tn,AUC0-∞=AUC0-tn+Ctn/Ke(tn为最后一次可检测血药浓度的采样时间,Ctn为末次可测定样本的药物浓度);CL/F=D/AUC0-∞(D为给药剂量,F为相对生物利用度),Vd/F=CL/(F·Ke)。对Tmax进行非参数检验,对Cmax、AUC的对数转换值进行方差分析和双单侧t检验及90%可信限判断,以AUC80%~125%和Cmax70%~143%为判定标准,考察两制剂是否具有生物等效性。P<0.05为差异有统计学意义。
2 结果
2.1 方法学评价
2.1.1 专属性:色谱图如图1所示,在本实验所采用的色谱—质谱条件下,氨氯地平和内标的保留时间
为1.24 min和0.90 min;氨氯地平和内标的峰形良好,无杂质干扰,基线平稳,可确保分析的专一性。

图1 测定血浆中氨氯地平及内标普萘洛尔的色谱图Fig.1 The chromatogram of amlodipine and internal standard propranolol in plasma
2.1.2 标准曲线及定量下限:以血浆中待测物浓度为横坐标,待测物与内标物的峰面积比为纵坐标,用加权(W=1/x2)最小二乘法进行回归运算[10],直线回归方程:Y=6.070X+0.526,r=0.9976。氨氯地平线性范围为0.15~15 ng·mL-1,定量下限为0.15 ng·mL-1。
2.1.3 精密度、回收率和基质效应:取500 L空白血浆,加入适量标准溶液,配制成氨氯地平血浆浓度为0.3、2和12 ng·mL-1的质量控制样品。每日测定6次,连续测定3 d。通过标准曲线计算浓度,回收率分别为97.6%、102.3%和98.4%,日内和日间精密度分别为9.6%、7.7%、8.1%和3.2%、5.0%、7.2%。另取空白血浆500 L,按“1.4.4血浆样品处理方法”(不加内标溶液),在获得的上清液中加入相应质量浓度的标准溶液50 μL,涡旋混匀,取5 μL进样,由随行标准曲线计算的提取回收率分别为78.3%、77.2%和77.8 %,内标普萘洛尔提取回收率为87.7%(n=6)。取氨氯地平和内标对照品适量,用流动相配制氨氯地平浓度分别为0.3、2和12 ng·mL-1,内标浓度为20 ng·mL-1的样品,进样分析。计算得基质效应分别为-1.4%、-3.6%、-7.8%,内标为-3.5%(n=6)。
2.1.4 稳定性:制备0.3、2和12 ng·mL-1的质控样品,各3份,室温放置4 h,-40℃下反复冻融3次,-40℃下冻存45 d及自动进样器中放置12 h条件下,测定样品浓度,偏差<15%,可知氨氯地平在上述条件下稳定性均良好。
2.1.5 生物利用度:20名健康受试者单次口服试验制剂T或参比制剂R后,不同时间点所测定的平均血药浓度—时间曲线见图2。Tmax、Cmax采用实测值,以消除相血药浓度对数与对应点时间的线性回归求算苯磺酸氨氯地平的体内消除半衰期,采用梯形法计算AUC0-144,AUC0-∞所得的两制剂的主要药代动力学参数见表1。试验制剂和参比制剂在处方间与周期间差异无统计学意义(P>0.05);试验制剂中氨氯地平的AUC0-144和AUC0-∞的90%可信区间分别为参比制剂的(86.1~107.4)%和(85.3~108.2)%,落在(80~125)%;Cmax的90%可信区间为参比制剂的(91.9~114.0)%,落在(70~143)%;对两制剂的Tmax采用非参数法进行评价,结果表明,经非参数法检验发现两制剂的T 差异无统计学意义(P>0.05)。

图2 受试者口服氨氯地平片受试制剂或参比制剂后的平均血药浓度—时间曲线Fig.2 Mean plasma concentration⁃time curve after oral administration of amlodipine test or reference preparation
2.2 安全性评价
在生物等效性临床试验期间,20名健康受试者均未出现不良事件。在试验后的随访体检中,其血常规、血液生化及尿常规未见异常,表明两制剂在试验剂量下表现出良好的安全性。
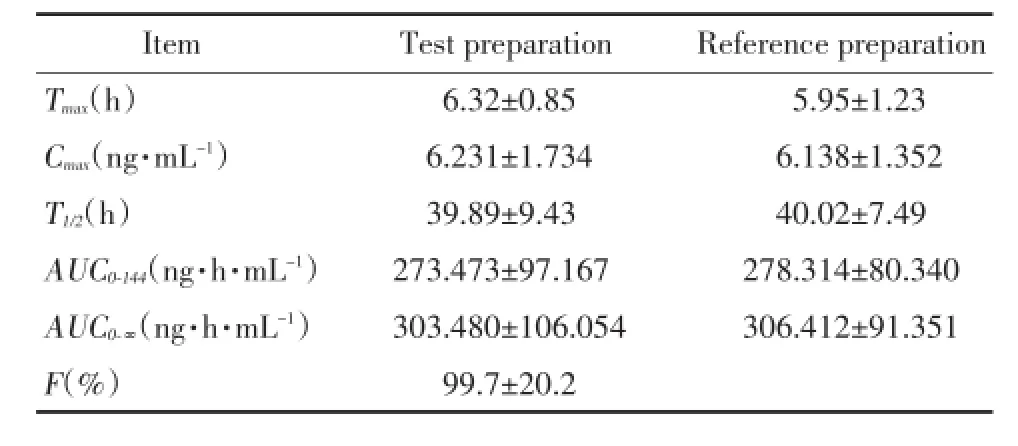
表1 健康受试者单次口服参比制剂或受试制剂氨氯地平5 mg后的主要药动学参数(n=20)Tab.1 Pharmacokinetic parameters of amlodipine after oral 5 mg test or reference preparation(n=20)
3 讨论
国内外文献报道氨氯地平含量测定方法主要包括高效液相色谱—紫外法、高效液相色谱—电化学法、液相色谱—质谱法等[11~14]。基于氨氯地平给药剂量小、血药浓度水平低,且高效液相色谱—紫外法检测灵敏度难以达到要求、高效液相色谱—电化学法干扰因素多及操作难度大、荧光检测法需要衍生化及过程复杂的特点,本研究采用UPLC-MS/MS法检测氨氯地平的线性范围达到0.15~15 ng·mL-1,具有较高的检验灵敏性,流动相的选择上,采用乙腈和0.2%甲酸溶液,其中甲酸作为有机酸能增加氨氯地平的溶解度,且操作方法简便易行,完成一个样品的分析时间仅需2.0 min,可确保测定血浆中的微量氨氯地平浓度的准确性与可靠性,因此适合于氨氯地平临床药物动力学和生物等效性研究。
本研究采用非房室模型法分析了苯磺酸氨氯地平片在20名健康男性受试者体内的药物动力学特点,研究结果表明,该药口服吸收较慢,血药浓度平均(6.32±0.85)h达峰值,半衰期约平均(39.89± 9.43)h,说明该药起效较慢、作用缓和长效,临床每日给药1次,可提高服药的顺应性。试验结果中主要药物动力学参数与文献[6,7]报道基本一致。
20名健康受试者服药后两种制剂中苯磺酸氨氯地平的血浆药物浓度的时间—浓度曲线分别呈现很好的拟合关系,表明苯磺酸氨氯地平的受试制剂和参比制剂在健康受试者体内过程基本一致。用面积法估算杭州国光药业有限公司生产的苯磺酸氨氯地平片(受试制剂)的相对生物利用度为(99.7±20.2)%。同时,又进一步通过对药动学参数AUC、Cmax经对数转换后进行三因素方差分析、单双侧t检验、90%置信区间分析,并对药物动力学参数Tmax进行非参数法检验分析,结果表明两种制剂间主要药物代谢动力学参数差异无统计学意义,即二者具有生物等效性。本研究结果可为中国人合理使用苯磺酸氨氯地平片提供药动学依据。
[1]王站明,刘慧娟.氨氯地平的药理作用及临床应用评价[J].中外健康文摘,2012,9(20):198.
[2]Kim KA,Park PW,Lee OJ,et al.Effect of CYP3A5*3 genotype on the pharmacokinetics and pharmacodynamics of amLodipine in healthy Korean subjects[J].Clin Pharmacol Ther,2006,80(6):646-656.
[3]韩启银,张根元,陶伟博,等.高效液相色谱法测定苯磺酸氨氯地平分散片的含量[J].江苏药学与临床研究,2005,13(6):19-20.
[4]杨晓燕,张力,柳强妮,等.国产苯磺酸氨氯地平片健康人生物等效性研究[J].中国新药杂志,2008,17(10):881.
[5]吕媛,崔洪,康子胜,等.苯磺酸氨氯地平片在健康人体的生物等效性[J].中国临床药理学杂志,2009,25(1):34.
[6]Zou QG,Zhan Y,Ge ZX,et al.Liquid chromatography-mass spectrometry method for the determination of amlodipine in human plasma and its application in a bioequivalence study[J].Arzneimittelforschung,2009,59(8):383-391.
[7]马涛,张志涛,王清清,等.苯磺酸氨氯地平片人体生物等效性研究[J].蚌埠医学院学报,2008,33(3):344.
[8]郝光涛,白少柏,曲恒燕,等.苯磺酸氨氯地平片人体相对生物利用度和生物等效性研究[J].中南药学,2011,9(8):600.
[9]刘婷立,冯婉玉,李发美,等.HPLC-MS/MS法研究苯磺酸氨氯地平在健康志愿者体内药代动力学及生物等效性[J].中国医科大学学报,2008,37(4):515.
[10]钟大放.以加权最小二乘法建立生物分析标准曲线的若干问题[J].药物分析杂志,1996,16(5):343-346.
[11]董煜,钱小平,孙晶晶.HPLC法测定苯磺酸氨氯地平片的有关物质[J].中国药品标准,2010,11(3):213-214.
[12]张志锋,李婧,孙文霞,等.RP-HPLC测定苯磺酸氨氯地平片中的有关物质[J].西南民族大学学报,2009,35(3):519-523.
[13]梁超,程晓华,张红,等.LC-MS法评价两种苯磺酸氨氯地平片的人体生物等效性[J].第二军医大学学报,2007,28(3):299.
[14]徐萍,朱运贵,张毕奎,等.LC-MS-MS法评价2种苯磺酸氨氯地平片的生物等效性[J].中南药学,2008,6(3):286-289.
(编辑陈姜)
Relative Bioavailability and Bioequivalence of Amlodipine Besylate Tabletsin Healthy Volunteers
ZHANGLi-na1,ZHANGMao-pan2,YAN Di1,HANCao1,TANBo1,SONGYan1,MENGSheng-nan2
(1.Department of Critical Care Medicine,Central Hospital Attached To Shenyang Medical College,Shenyang 110024,China;2.Department of Pharmaceutics,School ofPharmacy,China MedicalUniversity,Shenyang 110001,China)
ObjectiveTo evaluate the pharmacokinetics and bioavailability of two formulations of amlodipine tablets in 20 healthy male volunteers.MethodsA total of 20 healthy male volunteers were orally given a single dose of 10 mg of two different formulations of amlodipine in an open randomized cross-overtest.The amlodipine concentration in plasma was determined by ultraperformance liquid chromatography-tandem massspectrometry.ResultsThe main pharmacokinetic parameters of tested and reference tablets were as follows:Tmaxof amlodipine were 6.32±0.85 h and 5.95± 1.23 h,Cmaxwere 6.231±1.734 ng·mL-1and 6.138±1.352 ng·mL-1,T1/2were 39.89±9.43 h and 40.02±7.49 h and AUC0-144were 273.473±97.167 ng·h·mL-1and 278.314±80.340 ng·h·mL-1,AUC0-∞were 303.480±106.054 ng·h·mL-1and 306.412±91.351 ng·h·mL-1,respectively.The relative bioavailability was 99.7%±20.2%.ConclusionThe results demonstrate thatthe tested and reference tablets are bioequivalent.
amlodipine besylate tablets;relative bioavailability;bioequivalence;ultraperformance liquid chromatography-tandem mass spectrometry
R91
A
0258-4646(2014)01-0022-04
国家自然科学基金(81173123)
张丽娜(1979-),女,主治医师,硕士. E-mail:23445946@qq.com
2013-11-12
网络出版时间:
