应用激光共聚焦显微镜观察光动力技术对单增李斯特菌菌膜的灭活作用
2014-02-25李红爱胡慧丹唐书泽吴希阳陈振强
李红爱,胡慧丹,邓 曦,刘 爽,唐书泽,*,吴希阳,陈振强
(1.暨南大学食品科学与工程系,广东广州510632;2.广州皇上皇集团有限公司,广东广州510240;3.暨南大学光电工程系,广东广州510632)
应用激光共聚焦显微镜观察光动力技术对单增李斯特菌菌膜的灭活作用
李红爱1,胡慧丹2,邓 曦1,刘 爽1,唐书泽1,*,吴希阳1,陈振强3
(1.暨南大学食品科学与工程系,广东广州510632;2.广州皇上皇集团有限公司,广东广州510240;3.暨南大学光电工程系,广东广州510632)
以亚甲基蓝(methylene blue,MB)为光敏剂,采用光催化专用氙灯光源(光功率密度为200mW/cm2),通过激光共聚焦扫描显微镜(confocal laser scanning microscope,CLSM)观察法探讨了光动力杀菌技术(anti-microbial photodynamic technology,APDT)对单增李斯特菌(Listeria monocytogenes,LM)菌膜(biofiLM,BF)的灭活作用。结果表明,MB-APDT处理的LM BF经过SYTO9/PI染色后在CLSM下观察,灭活效果区分明显。这一效果由平板菌落计数法得到进一步证实。光照20min,当MB的浓度低至0.1μg/mL时,APDT对于生长8h的BF失活率达到99.7%;当MB浓度为50μg/mL时,几乎全部LM BF失活。当MB浓度为1μg/mL时,光照5min即可使约99.6%生长8h的LM BF失活,也可使约78.7%生长36h的BF失活;当光照时间为30min时,生长8h LM-BF失活率达到99.97%,而生长36h BF失活率也达到99.94%。MB-APDT对LM BF的灭活效果主要取决于MB浓度和光照时间,且杀伤作用非常显著。
激光共聚焦扫描显微镜,单增李斯特菌,生物菌膜,亚甲基蓝,光动力灭菌技术
某些病原微生物极易粘附于食品加工设施表面或死角处而形成生物菌膜[1](biofiLM,BF),不但使其发生物理或化学等性能变化,而且造成食品污染,导致食品安全问题[2-3]。单核细胞增生李斯特菌(Listeria monocytogenes,LM)是四大食源性致病菌之一[4-5],被认为是食品加工系统中形成BF的主要致病菌[6]。BF是指浮游菌(planktonic cell)为了增强自身的生存能力,通过增殖、聚集并在介质表面粘附,形成由嵌入的细菌、分泌的胞外多糖及蛋白质等基质构成的被膜[7-9]。由于BF中的菌体能够产生强烈的群体感应(quorum sensing,QS),导致其比浮游菌具有更高的灭菌耐受性[10-11]。因此,寻找一种能够有效灭活LM BF的方法具有更为重要的食品安全意义。
光动力杀菌是一种新型灭菌技术,它是指通过光敏剂选择性富集于目标细胞或组织(如病源菌),并结合适当的可见光波长照射而激发产生一系列活性氧物质(reactive oxygen species,ROS),ROS通过氧化作用攻击细胞结构从而影响其正常生理功能,实现对目标细胞有效灭活的一项新技术[12]。亚甲基蓝(methylene blue,MB)是目前唯一被批准用于临床应用的光敏剂[13],已被应用于治疗牙周炎、龋齿、亚硝酸盐中毒[14],以及处理新鲜冷冻血浆等[15]。
本实验选用单增李斯特菌标准菌株ATCC19111作为实验菌株,以亚甲基蓝作为光敏剂,采用光催化专用氙灯光源,使用激光共聚焦扫描显微镜(confocal laser scanning microscope,CLSM)和细菌平板菌落计数法观察不同MB浓度、不同光照时间对不同生长阶段LM BF的光灭活效果,CLSM观察法通过区别菌体颜色,即可清晰比较BF在不同光灭活条件下处理效果。以期光动力杀菌技术可作为一种安全有效的非热生物菌膜灭活技术应用于食品加工设备及食品加工环境的消毒灭菌中。
1 材料与方法
1.1 材料与仪器
LM标准株ATCC19111 广州市微生物研究所;亚甲基蓝(MB) 上海红绿光敏剂研究所有限公司;细菌计数培养基 青岛海博生物技术有限公司;胰蛋白胨大豆肉汤(tryptone soy broth,TSB)培养基 青岛海博生物技术有限公司;活-死细胞染色试剂盒Biovision。
LSXSS-500型500W光催化专用氙灯光源(光功率密度200mW/cm2) 北京卓立汉光仪器有限公司;LSM700型激光共聚焦扫描显微镜 德国Zeiss。
1.2 菌种培养及前处理
将活化的LM接种于5mL TSB培养基中,37℃振荡培养至对数生长期后期(约12~14h);以4500r/min离心10min,弃上清液,重新悬浮菌体于0.1mol/L的无菌磷酸缓冲溶液(phosphate buffered saline,PBS;pH= 7.4)中,调整其OD600=0.5左右。
1.3 CLSM对MB-APDT处理效果的观察
1.3.1 MB浓度实验 在6孔平底板(放置了经清洗灭菌的18mm×18mm盖玻片)中加入5mL TSB培养基(含0.45%葡萄糖[16]),再加入50μL按照1.2制备的菌悬液,在37℃静置培养24h,小心取出载玻片,用无菌水洗数次以去除浮游菌;将盖玻片移置干净6孔平底板中,加入不同浓度的MB(0、0.1、1.0、10μg/mL),37℃避光孵育30min,将96孔板放置于氙灯光源前20cm处,照射20min。同时设置对照组(不光照组:L-)。将MB-APDT处理后的盖玻片样品用PBS缓冲液漂洗一遍,以去除残留的MB;按照活-死细胞染色试剂盒(含SYTO9/PI两种荧光染液)的说明步骤操作,把SYTO9/PI染液加在盖玻片样品上,37℃孵育15min,用抗荧光淬灭封片液封片后,置激光共聚焦扫描显微镜LSM700下于63×/1.4油镜观察,并采集光学图像。
1.3.2 光照时间实验 LM BF处理同步骤1.3.1,加入浓度为1μg/mL MB,37℃避光孵育30min,将96孔板放置于氙灯光源前20cm处,分别照射0、1、10、20min。同时设置对照组(不加光敏剂组:S-)。后续使用激光共聚焦扫描显微镜LSM700采集图像实验步骤同1.3.1。
1.4 APDT对LM BF的灭活实验
1.4.1 MB浓度实验 取10μL按照步骤1.2制备的菌悬液接种到有200μL TSB培养基(含0.45%葡萄糖)的96孔板中,在37℃培养分别培养0、8、12、18、24、36h,吸出菌悬液,用无菌水洗数次以去除浮游菌;加入不同浓度的MB(0、0.01、0.1、1、10、50μg/mL),37℃避光孵育30min,将96孔板放置于氙灯光源前20cm处,照射20min。同时设置对照组(不光照组:L-)。
1.4.2 光照时间实验 LM BF前期培养与处理同步骤1.4.1,加入浓度为1μg/mL MB,37℃避光孵育30min,将96孔板放置于氙灯光源前20cm处,分别照射0、1、5、10、20、30min。同时设置对照组(不加光敏剂组:S-)。
1.4.3 细菌平板菌落计数 按照1.4.1和1.4.2不同方式处理后,将96孔杯放入超声振荡仪中,振荡(2.5× 104Hz)30s,间隔30s,重复三次,使得BF完全从96孔杯壁及底部脱落下来,分散于菌悬液中。将所得的菌悬液均以1∶10梯度稀释,各取100μL梯度稀释液涂板于细菌计数培养基平板中,于37℃生化培养箱中恒温培养,48h后取出进行菌落计数。实验重复3次,取平均值。
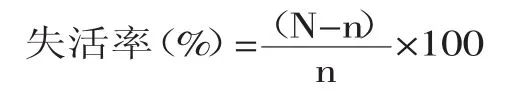
式中,N为对照组菌落数平均值;n为实验组菌落数平均值。
1.5 统计学分析
使用GraphPad Prism 5软件进行数据分析与作图。
2 结果与分析
2.1 MB-APDT对LM BF效果的可视化
MB-APDT对生长24h的LM BF的灭活效果使用激光共聚焦扫描显微镜观察,结果如图1和图2所示。图1表示不同MB的浓度在氙灯光源下光照20min,对LM BF灭活作用的可视图。图2表示当MB的浓度为1μg/mL时,通过不同光照时间的照射对LM BF的灭活作用可视图。细胞经过SYTO9/PI荧光染液处理后,经488nm激发波长激发,活菌表征绿色,死菌表征红色,处于凋亡后期的菌体表征黄色。因此,MB-APDT对LM BF的杀伤效果通过图1和图2中菌体颜色的观察,即可清晰比较BF在不同光灭活条件下处理效果。
由图1可知,当光敏剂浓度为0.1μg/mL,光照20min时,部分菌体呈现出红色,大部分为黄绿色,即生物菌膜中的部分菌体死亡,大部分菌体处于凋亡后期状态;当MB浓度为1μg/mL时,大部分菌体呈现出红色,即BF中的大部分菌体已死亡;当MB浓度为10μg/mL时,只有极少数几个菌体呈现绿色,即几乎所有的菌体都凋亡;而空白对照组(A)中菌体基本上全为绿色,表征全是活菌。

图1CLSM观察LM BFFig.1 Confocal laser scanning micrographs of L.monocytogenes biofilms
由图2可见,当亚甲基蓝的浓度为1μg/mL时,光照1min,菌体部分仍呈绿色,大部分呈红色,即BF中菌体死亡数量可观;光照10min,大部分菌体已呈红黄色或红色,菌体死亡数量明显;光照20min,大部分菌体呈现出红色,只有极少数菌体为绿色,即大部分菌体已经被灭活。

图2CLSM观察LM BFFig.2 Confocal laser scanning micrographs of L.monocytogenes biofilms
2.2 MB浓度对LM BF APDT灭活作用的量化结果
光照20min,不同浓度MB对不同生长阶段的LM BF光动力灭活作用见图3。由图3可见,在相同光照条件下,随着MB浓度的增加,APDT对LM BF的杀伤作用逐渐增强;当使用同一MB浓度时,生长时间越短的BF,APDT对其灭活率越大,数量级降低越明显。当MB的浓度低至0.1μg/mL时,光照20min,APDT对于生长8h的BF失活率达到99.7%;对于培养36h BF杀伤率达到77.6%。当MB浓度为50μg/mL时,几乎全部LM BF都被灭活。因此,MB对LM BF能达到良好的光动力杀伤效果,而光敏剂对照组和光照对照组均没有明显的灭活作用。
2.3 光照时间对LM BF APDT灭活作用的量化结果
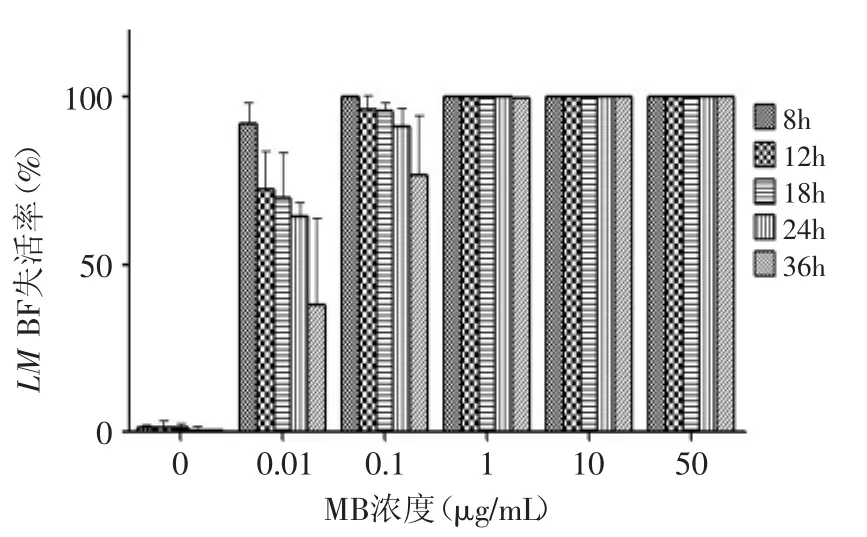
图3 不同浓度MB对LM BF失活率的影响Fig.3 The effect of MB concentration on inactivation rate of L.monocytogenes biofilms
图4表示当MB的浓度为1μg/mL时,不同光照时间对不同生长阶段的LM BF光动力灭活作用的影响。光照5min即可使约99.6%的生长8h LM BF失活也可使约78.7%的生长36h BF失活;当光照时间为30min时,生长8h LM BF失活率达到99.97%,生长36h BF失活率也达到99.94%。表明当MB浓度一定时,APDT对LM BF的杀伤作用随着光照时间的延长而增强。
本课题组前期研究已经证实APDT对浮游LM[17]具有显著的杀菌效果。本实验进一步证实APDT对于结构更复杂、对常用杀菌方法抵抗力更强的BF也有非常强的灭活作用。但相较于浮游的LM,要达到相同的灭活效果,仅需要MB的浓度为0.2μg/mL,同样光源下光照10min。即相对于浮游菌,使LM BF灭活需要更高浓度的光敏剂和更长的光照时间,这与Buchovec等[18]的研究结果基本相似。Buchovec等[18]研究结果,以5-氨基酮戊酸(ALA)为光敏剂对LM浮游菌及LM BF进行光动力灭菌,BF所需的光敏剂浓度比浮游LM使用的浓度更高,光照时间更长。本实验通过MB-APDT对不同生长阶段的LM BF杀伤效果的比较,说明LM BF生长时间更长就越难以被消灭与控制。实验结果与Lizcano等[19]关于肺炎链球菌BF形成的研究相吻合,从浮游菌到BF是一个菌体数量由少到多的聚集与增殖,菌膜结构由简单到繁杂的生长过程,也说明BF可能产生污染的机率比浮游菌更大,污染范围更广、程度更严重。
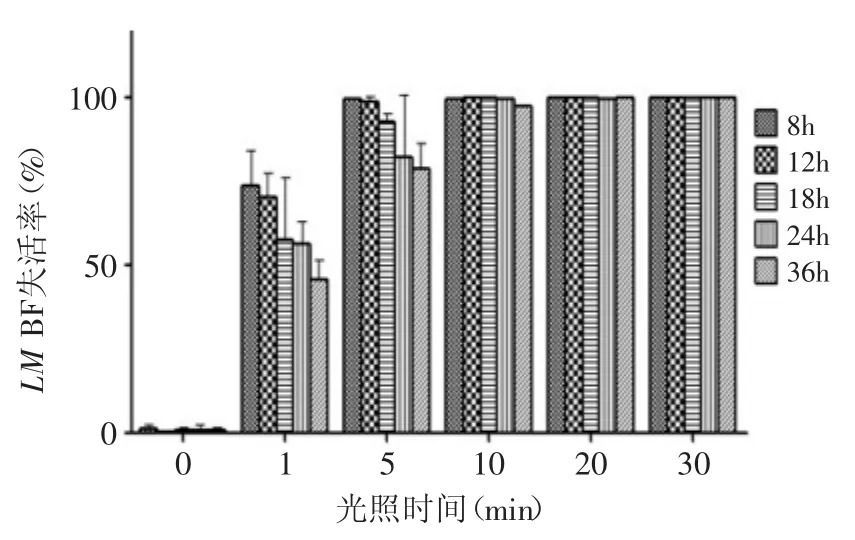
图4 不同光照时间对LM BF失活率的影响Fig.4 The effect of illumination time on inactivation rate of L.monocytogenes biofilms
3 结论
亚甲基蓝对不同生长阶段的单增李斯特菌生物菌膜有着非常显著的光动力灭活作用,其效果主要取决于光敏剂浓度和光照时间的影响。通过从激光共聚焦扫描显微镜观察法反映MB-APDT对LM BF的灭活结果中颜色分析,可以直观比较BF在不同光灭活条件下的处理效果。在同一光照时间下,MB的浓度越大,光动力灭活作用越显著;当MB浓度一定时,APDT杀伤作用随着光照时间的延长而增强;在同一MB-APDT条件下,生长时间越短的BF,APDT对其造成的失活率越大,数量级降低越明显。
[1]Poulsen L V.Microbial biofilms in food processing[J]. Lebensmittel-Wissenschaft&Technologie,1999,32(6):321-326.
[2]Siboni N,Lidor M,Kramarsky-Winter E.Conditioning film and initial biofilm formation on ceramics tiles in the marine environment[J].FEMS Microbiology Letters,2007,274(1):24-29.
[3]Costrton J W,Stewart P S,Greenberg E P.Bacterial biofilms:a common cause of persistent infections[J].Science,1999,284:1318-1322.
[4]Jones E M,MacGowan A P.Antimicrobial chemotherapy of human infection due to Listeria monocytogenes[J].European Journal of Clinical Microbiology&Infectious Diseases:Official Publication of the European Society of Clinical Microbiology, 1995,14(3):165-175.
[5]Farber J M,Peterkin P I.Listeria monocytogenes,a foodborne pathogen[J].Microbiological Reviews,1991,55(3):476-511.
[6]Reij M W,Den Aantrekker E D.Recontamination as a source of pathogens in processed foods[J].International Journal of Food Microbiology,2004,91(1):1-11.
[7]Molobela I P,Ilunga F M.Impact of bacterial biofilms:the importance of quantitative biofilm studies[J].Annals of Microbiology,2012,62(2):461-467.
[8]Jenkinson H F,Lappin-Scott H M.Biofilms adhere to stay[J]. Trends in Microbiology,2001,9(1):9-10.
[9]Daver M E,O’toole G A.Microbial biofilms:from ecology to molecular genetics[J].Microbiology and Molecular Biology Reviews,2000,64(4):847-867.
[10]Rice S A,Koh K S,Queck S Y,et al.Biofilm formation and sloughing in Serratia marcescens are controlled by quorum sensing and nutrient[J].Journal of Bacteriology,2005,187(10):3477-3485.
[11]Williams P.Quorum sensing,communication and crosskingdom signaling in the bacterial world[J].Microbiology-SGM,2007,153:3923-3938.
[12]Maisch T.Anti-microbial photodynamic therapy:useful in the future[J].Lasers in Medical Science,2007,22(2):83-91.
[13]Wainwright M.The use of dyes in modern biomedicine[J]. Biotechnic&Histochemistry,2003,78(3-4):147-155.
[14]Detty M R,Gibson S L,Wagner S J.Current clinical and preclinical photosensitizers for use in photodynamic therapy[J]. Journal of Medicinal Chemistry,2004,47(16):3897-3915.
[15]Wagner S J.Virus inactivation in blood components by photoactive phenothiazine dyes[J].Transfusion Medicine Reviews,2002,16(1):61-66.
[16]Sheikn J,Hicks S,Dall’Agnol M,et al.Roles for fis and yafk in biofilms formation by enteroaggregative Escherichia coli [J].Molecular Microbiology,2001,41(5):983-997.
[17]Lin S L,Hu J M,Tang S S,et al.Photodynamic inactivation of methylene blue and tungsten-halogen lamp light against food pathogen Listeria monocytogenes[J].Photochemistry and Photobiology,2012,88(4):985-991.
[18]Buchovec I,Paskeviciute E,Luksiene Z.Photodynamic inactivation of food pathogen Listeria monocytogenes[J].Food Technology and Biotechnology,2010,48(2):207-213.
[19]Lizcano A,Chin T,Sauer K,Tuomanen E I,et al.Early biofilm formation on microtiter plates is not correlated with the invasive disease potentialofStreptococcus pneumonia[J]. Microbial Pathogenesis,2010,48:124-130.
Using confocal laser scanning microscope visualizing the effect of anti-microbial photodynamic technology against Listeria monocytogenes biofilms
LI Hong-ai1,HU Hui-dan2,DENG Xi1,LIU Shuang1,TANG Shu-ze1,*,WU Xi-yang1,CHEN Zhen-qiang3
(1.Department of Food Science and Engineering,Jinan University,Guangzhou 510632,China;2.Guangzhou Huangshanghuang Group Co.,Ltd.,Guangzhou 510240,China;3.Department of Optoelectronic,Jinan University,Guangzhou 510632,China)
The efficacy of anti-microbial photodynamic technology(APDT)against Listeria monocytogenes(LM)biofilm(BF)by methylene blue(MB)under photocatalysis-xenon lamp light(power density 200mW/cm2)was visualized using confocal laser scanning microscope(CLSM)and investigated by counting colony-forming units(CFU).Obtained results indicated that the efficacy of MB-APDT to LM BF was clearly visual through CLSM based on SYTO9/PI staining.In addition,standard plate counts of cells recovered from biofilms were used to quantify the effects of MB-photoactivated.The inactivation rate of cultured 8h LM BF was over 99.7% by 0.1μg/mL MB and 20min of irradiation,exposure to 50μg/mL MB resulted in almost complete killing.When the concentration of MB was 1μg/mL at the illumination for 5min,cultured 8h BF produced 99.6%inactivation while cultured 36h BF was only 78.7%.The ability of inactivate biofilm bacteria was further enhanced at the illumination for 30min,99.96%inactivation rate of cultured 8h BF and 99.94%of cultured 36h BF,respectively. The efficacy of MB-APDT to LM BF mainly depends on the concentration of MB and illumination time,and LM BF were effectively inactivated.
confocal laser scanning microscope(CLSM);Listeria monocytogenes(LM);biofilm(BF);methylene blue(MB);anti-microbial photodynamic technology(APDT)
TS207.3
A
1002-0306(2014)04-0157-04
2013-06-13 *通讯联系人
李红爱(1987-),女,硕士研究生,研究方向:食品安全。
广东省自然科学基金项目(S2012010008479);广东省突发公共事件应急技术研究中心专项([2011]733)。
