活性氧与蜡样芽孢杆菌菌膜形成的相关性
2022-04-26夏俊芳奇那尔玛格撇尔古丽娜孜
夏俊芳,潘 苗,奇那尔,玛格撇尔,古丽娜孜,武 运
(新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052)
蜡样芽孢杆菌(Bacillus cereus)是一种常见的革兰氏阳性食源性病原体,广泛分布于各种环境中,并形成耐酸、耐热和耐干燥的孢子[1]。该病原菌会引起全身感染和食物中毒,如腹泻、呕吐、脑膜炎、败血症、眼内炎和牙周炎等[2]。Bacillus cereus经常在生鲜乳及加工乳中被发现且可以附着在加工机械的表面,如阀门、管道和泵等,甚至形成菌膜,菌膜中的病原体对机械作用或常用消毒剂具有较强的抵抗力,会带来严重的健康风险,人体大约80%的细菌感染与菌膜有关[3]。在乳品加工线上形成的Bacillus cereus菌膜会增加该菌反复污染的风险,降低乳制品的质量,导致食品腐败从而引起食品安全问题[4],对乳制品行业造成极大的威胁[5]。如何彻底消除乳品环境中的菌膜已成为一大挑战[6],为此,了解Bacillus cereus菌膜的形成至关重要,制定合理的方案以消除乳品加工业中Bacillus cereus菌膜的污染问题。
目前,关于Bacillus cereus菌膜形成的研究主要集中在内部因素和外部因素两个方面,内部因素如Sin R[7]、Cod Y[8]、Sigma54(RpoN)[9]基因编码的蛋白质被认为参与Bacillus cereus菌膜的形成,外部因素包括酸碱度、温度、营养成分和细菌特性等[10−11]。CORCIONIVOSCHI等[12]通过对细菌Noxs研究综合分析后(Noxs是可以专一催化产生活性氧(ROS)酶类)提出,Noxs介导产生的ROS可能是细菌的一种重要信号分子,ROS可能参与食源性致病菌菌膜的形成,细菌菌膜形成中通常会伴随ROS的产生,但其对菌膜形成的影响尚无定论,如SHIVAPRASAD等[13]研究发现维生素C通过产生ROS使大肠杆菌(Escherichia coli)EMC17菌株氧化应激抑制其菌膜形成,菌膜基因表达下调;SUO等[14]研究发现超氧化物歧化酶缺失的单核细胞增生李斯特氏菌(Listeria monocytogenes)突变体中ROS生成量升高,菌膜形成能力显著下降;WHITE等[15]研究发现过氧化氢酶(katA)基因破坏的奇异变形杆菌(Proteus mirabilis)ROS水平增加,菌膜生物量减少,但KULKARNI等[16]发现香烟烟雾(ROS存在)下增加金黄色葡萄球菌(Staphylococcus aureus)菌膜的形成;VILLA等[17]指出持续的外源ROS处理增加棕色固氮杆菌(Azotobacter vinelandii)野生型菌株(UW136)菌膜形成。WANG等[18]研究发现Bacillus cereus(ATCC14579)在黄素腺嘌呤二核苷酸刺激下增大Nox2转化率,证实Bacillus cereus中存在Noxs活性,活性部位存在于细胞膜上,因此,ROS与Bacillus cereus菌膜的形成和基因调控相关,但ROS在Bacillus cereus代谢或菌膜形成中的确切作用仍不清楚,且多数研究中的菌株并非来源于食品分离菌株,菌株差异性导致研究结果对实际指导的意义有限。
本文以新疆乌鲁木齐夏秋两季市售原料奶中Bacillus cereus分离株为研究目标,通过外源H2O2、N-乙酰半胱氨酸(NAC)ROS清除剂、二苯基氯化碘(DPI)NADPH氧化酶抑制剂处理Bacillus cereus,探讨ROS与Bacillus cereus菌膜形成之间的关系,为后期食品加工、运输过程中Bacillus cereus菌膜污染的有效控制奠定理论基础。
1 材料与方法
1.1 材料与仪器
蜡样芽孢杆菌(Bacillus cereus) 菌株N2、N6,菌株Y10、Y22、Y34,菌株L6、L8、L9、L12、L24根据国标(GB4789.14-2014食品安全国家标准食品微生物学检验蜡样芽孢杆菌检验)分别从新疆乌鲁木齐零市售新鲜牛乳、羊乳及驴乳分离筛选,菌株甘油管冻存于−80 ℃冰箱备用。Bacillus cereus(CMCC63303)(BC) 上海理工大学医疗器械与食品学院微生物实验室;营养琼脂培养基、LB肉汤培养基 北京陆桥生物技术有限公司;0.1%结晶紫 分析纯,广东光华科技股份有限公司;NAC(N-乙酰半胱氨酸) 上海源叶生物科技有限公司;碘化丙啶(PI)试剂、二苯基氯化碘盐(DPI) 西格玛奥德里奇(上海)贸易有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴化物(MTT) 贝奥替米生物技术公司(中国上海);95%乙醇 成都市科隆化学品有限公司;过氧化氢(H2O2)、2.7二氯荧光素二乙酸酯(DCFH-DA) 上海阿拉丁生化科技股份有限公司;二甲基亚砜(DMSO) 天津市恒兴化学试剂制造有限公司。
HR40-IIA2生物安全柜 青岛海尔特种电器有限公司;Tu-1810APC分光光度计 北京普析通用仪器有限责任公司;LE2002E/02电子天平 梅特勒-托利多仪器(上海)有限公司;LDZX-50KBS型高压灭菌锅 上海早安医疗器械厂产品;THZ-98AB恒温培养振荡箱、DHP-9082电热恒温培养箱 上海一恒科学仪器有限公司;MX-E涡旋振荡器 大龙兴创实验仪器北京有限公司;PHS-3C数显台式酸度计 上海浦春计量仪器有限公司;Tecan多功能酶标仪(Spark) 奥地利Tecan Austria GmbH公司;生物激光共聚焦显微镜(TCS SP8) 德国徕卡公司。
1.2 实验方法
1.2.1 奶源Bacillus cereus菌株的活化培养 将甘油管冻存的Bacillus cereus菌株进行活化,以0.1%接种量分别接入10 mL LB液体培养基,30 ℃、150 r/min条件下培养18 h后,用新鲜LB培养基将菌液稀释至OD600为0.3,于4 ℃冰箱中贮存备用。
1.2.2 细菌活力及细胞活性测定 将OD600为0.3的Bacillus cereus菌液接入96孔细胞培养板每孔100 μL,30 ℃培养24 h后测量细菌浓度(OD600)为细菌活力值,然后向每孔添加20 μL 0.5 mg/mL MTT密封后30 ℃反应4 h离心(4000 r/min,10 min)弃上层液体,再向每孔加150 μL二甲亚砜(DMSO),震荡溶解蓝色结晶,在570 nm波长下测量各孔光密度,以所有菌株细胞活性(MTT)均值绘图。
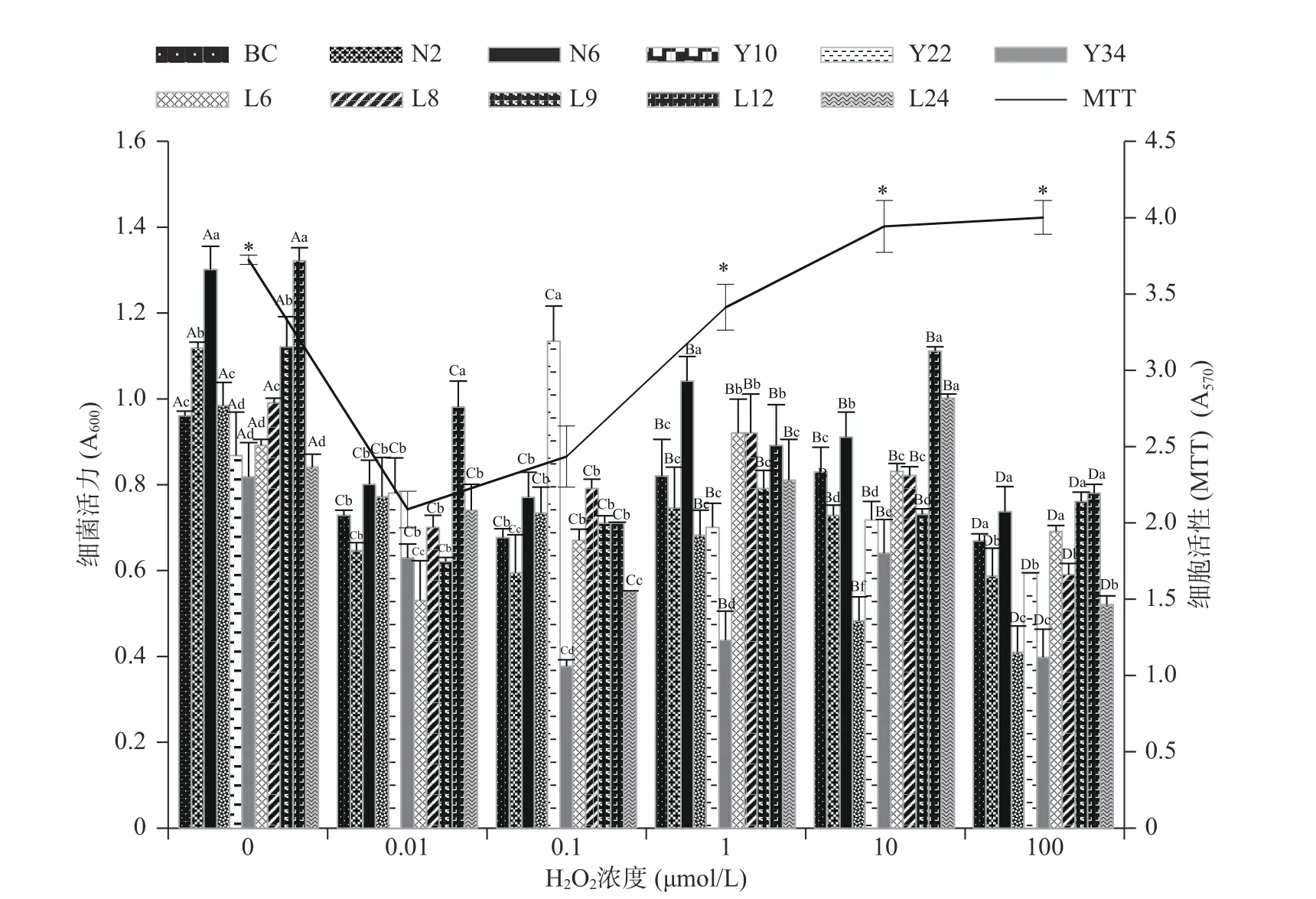
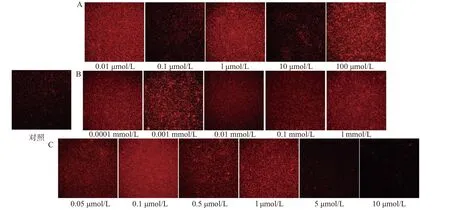
1.2.3 菌膜测定 采用96孔结晶紫染色法[19]测定菌膜含量,将OD600为0.3的Bacillus cereus菌液接入96孔细胞培养板,每孔100 μL,平行接种5个孔,以相同条件的无菌LB液体培养基作为阴性对照,30 ℃下培养24 h后移除菌液,用无菌蒸馏水洗涤3次,室温静置30 min,然后向每孔中加入100 μL 0.1%结晶紫溶液,染色30 min后弃去结晶紫溶液,用无菌蒸馏水洗涤3次并室温静置干燥,再向每孔加入110 μL 95%乙醇溶液,脱色45 min后用酶标仪测定570 nm波长下吸光值,根据OD570值的大小衡量菌膜的形成量,分别进行3次独立重复试验。按照STEPANOVIC等[20]的菌膜划分标准,以空白对照(空白孔)平均吸光值加上3倍标准差为界定值(ODc),将菌株的菌膜形成能力划分为4个等级:OD570≤ODc,菌膜阴性;ODc 1.2.4 ROS测定 采用DCFH-DA(2,7二氯荧光素二乙酸酯)法进行ROS测量[19],向形成菌膜的96孔板中加入10 μmol/L的DCFH-DA,30 ℃避光培养30 min后用酶标仪检测每孔的荧光值(激发光波长488 nm,发射光波长530 nm),以所有菌株ROS的均值绘图。 1.2.5 H2O2对Bacillus cereus菌膜形成的影响 将H2O2加入OD600为0.3的Bacillus cereus菌液中,使H2O2终浓度为0、0.01、0.1、1、10、100 μmol/L,混匀后,分别取100 μL加入96孔细胞培养板中,设5个平行,密封后静置于30 ℃培养箱,24 h培养后按照1.2.2、1.2.3、1.2.4进行细菌活力及细胞活性测定、菌膜测定、ROS测定。 1.2.6 N-乙酰半胱氨酸(NAC)对Bacillus cereus菌膜形成的影响 将NAC加入OD600为0.3的Bacillus cereus菌液中,使NAC终浓度为0、0.0001、0.001、0.01、0.1、1 mmol/L,混匀后,分别取100 μL加入96孔细胞培养板中,设5个平行,密封后静置于30 ℃培养箱,24 h培养后按照1.2.2、1.2.3、1.2.4进行细菌活力及细胞活性测定、菌膜测定、ROS测定。 1.2.7 二苯基氯化碘盐(DPI)对Bacillus cereus菌膜形成的影响 将DPI加入OD600为0.3的Bacillus cereus菌液中,使DPI终浓度为0、0.05、0.1、0.5、1、5、10 μmol/L,混匀后,分别取100 μL加入96孔细胞培养板中,设5个平行,密封后静置于30 ℃培养箱,24 h后培养后按照1.2.2、1.2.3、1.2.4进行细菌活力及细胞活性测定、菌膜测定、ROS测定。 1.2.8 激光共聚焦显微镜测定菌膜形成 将1 mL OD600为0.3的Bacillus cereus(CMCC63303)菌液接入12孔细胞培养板中作为对照组,分别添加终浓度为0.01、0.1、1、10、100 μmol/L H2O2,终浓度为0.0001、0.001、0.01、0.1、1 mmol/L NAC,终浓度为0.05、0.1、0.5、1、5、10 μmol/L DPI为处理组,置于30 ℃培养箱,24 h培养后用无菌蒸馏水洗涤3次,室温静置45 min后用碘化丙啶(PI)荧光染液封片,然后用激光共聚焦显微镜观察菌膜形成。 实验重复三次,采用Statistix 8.1(分析软件,St Paul,MN)软件包中Linear Models程序对数据进行统计分析,采用Dun检验进行多重比较确定差异显著性,应用Excel 2016和Adobe illustrator 2020制作图表。 由图1可知,随着H2O2浓度的升高,细菌活力逐渐下降,所有H2O2处理组(0.01、0.1、1、10、100 μmol/L)Bacillus cereus活力显著低于对照组细菌活力(P<0.05)。由图1细胞活性变化趋势可知,当H2O2浓度≥1 μmol/L时,Bacillus cereus细胞活性显著高于H2O2低浓度处理组(0.01、0.1 μmol/L)细胞活性(P<0.05),表明较高浓度的H2O2对细胞活性有一定的促进作用。 图1 不同H2O2浓度对蜡样芽孢杆菌活力和细胞活性的影响Fig.1 Effect of different H2O2 concentration on vigor and viability of Bacillus cereus 由图2可知,0.01、1、100 μmol/L H2O2处理组平均菌膜形成量均高于对照组平均水平(P<0.05)。0.01 μmol/L H2O2处理时,Y10、Y22、Y34菌株形成较强菌膜,BC、N6、L9、L12、L24菌株形成中等菌膜,N2、L6、L8菌株形成较弱菌膜;1 μmol/L H2O2处理时,BC、N2、N6、Y10、L24菌株形成较强菌膜,Y22、Y34、L6、L9、L12菌株形成中等菌膜,L8菌株形成较弱菌膜;100 μmol/L H2O2处理时,BC、N2、N6、Y10、Y22、Y34、L8、L12、L24菌株形成较强菌膜,L6、L9形成中等菌膜。 由图2可知,0.1、10 μmol/L H2O2处理组平均菌膜形成量与对照组平均菌膜水平无显著性差异(P>0.05)。0.1 μmol/L H2O2处理时,BC、N6、Y10、Y22、Y34、L12、L24菌株形成中等菌膜,N2、L6、L8、L9形成较弱菌膜;10 μmol/L H2O2处理时,BC、Y10、Y22、Y34、L24菌株形成中等菌膜,N2、N6、L6、L8、L9、L12菌株形成较弱菌膜;对照组N2、N6、Y10、L9、L12菌株形成中等菌膜,BC、Y22、Y34、L6、L8、L24菌株均形成较弱菌膜。可见部分浓度H2O2处理促进Bacillus cereus菌膜形成。 图2 不同H2O2浓度对蜡样芽孢杆菌ROS产生及菌膜形成的影响Fig.2 Effect of different H2O2 concentration on ROS production and biofilms formation of Bacillus cereus 由图2 ROS变化趋势可知,随着H2O2浓度的升高,ROS逐渐下降。尽管外源补充H2O2但ROS水平并未提高,这可能是因为Bacillus cereus对这种外源氧化压力作出应答且菌体本身也在不断产生和消耗ROS,因此,即使外源补充100 μmol/L H2O2,ROS含量仍呈下降趋势。这与REDER等[21]的研究发现一致,枯草芽孢杆菌(Bacillus subtilis)菌膜相关基因突变株经百草枯和H2O2等超氧化物生成剂处理后ROS含量显著减少(P<0.05)。结果表明:伴随着ROS含量的降低,Bacillus cereus菌膜形成量增强,因此,Bacillus cereus菌膜形成与ROS的减少相关。 由图3可知,与对照组相比,NAC各处理组Bacillus cereus活力显著低于对照组细菌活力(P<0.05),各处理组间细菌活力无显著差异(P>0.05)。NAC 各处理组细胞活性与对照组相比无显著性差异(P>0.05),表明NAC处理浓度对Bacillus cereus的生长和细胞活性的影响不大。这与GUO等[22]研究发现NAC处理组浓度对单核细胞增生李斯特氏菌(Listeria monocytogenes)的生长和生存能力没有影响的结果一致。 图3 不同NAC浓度对蜡样芽孢杆菌活力和细胞活力的影响Fig.3 Effect of different NAC concentration on vigor and viability of Bacillus cereus 由图4可知,NAC各处理组平均菌膜形成量均显著高于对照组平均菌膜形成量(P<0.05)。各处理组间相比,0.0001 mmol/L NAC处理组及 0.001 mmol/L NAC处理组平均菌膜形成量最高,0.01 mmol/L NAC处理组平均菌膜形成量最低。 当0.0001 mmol/L NAC处理时,Y22、Y34菌株形成较强菌膜;0.001 mmol/L NAC处理时,N6、Y22、L12菌株形成较强菌膜;0.1 mmol/L NAC处理时,Y22菌株形成较强菌膜;1 mmol/L NAC处理时,Y10菌株形成较强菌膜;0.01 mmol/L NAC处理时,L9、L24菌株形成较弱菌膜,其他9株菌均形成中等菌膜;对照组N2、N6、Y10、L9、L12菌株形成中等菌膜,BC、Y22、Y34、L6、L8、L24菌株均形成较弱菌膜。 由图4 可知,随NAC浓度的升高,ROS逐渐下降。这是因为NAC是ROS的清除剂,随着NAC浓度的增大,ROS含量逐渐减小,但Bacillus cereus菌膜形成量增大。这与GUERINI等[23]研究发现铜绿假单胞菌(Pseudomonas aeruginosa)菌膜随NAC浓度(0.5~4.0 mg/mL)增加而增加的结果一致。结果表明,Bacillus cereus菌膜形成与ROS的减少相关。 图4 不同NAC浓度对蜡样芽孢杆菌ROS产生及菌膜形成的影响Fig.4 Effect of different NAC concentration on ROS production and biofilms formation of Bacillus cereus 由图5可知,随着DPI浓度的升高,细菌活力逐渐下降,所有DPI处理组(0.05、0.1、0.5、1、5、10 μmol/L)Bacillus cereus活力显著低于对照组细菌活力(P<0.05)。由图5细胞活性变化趋势知,随着DPI浓度的升高,细胞活性也逐渐减弱,当DPI浓度大于1 μmol/L时,Bacillus cereus细胞活性显著低于对照组(P<0.05)但仍有细胞活性。 图5 不同DPI浓度对蜡样芽孢杆菌活力和细胞活力的影响Fig.5 Effect of different DPI concentration on vigor and viability of Bacillus cereus 由图6可知,当DPI浓度≤1 μmol/L时,随着DPI浓度的升高,平均菌膜形成量均高于对照组平均菌膜水平(P<0.05)。其中,0.1 μmol/L DPI处理组及1 μmol/L DPI处理组平均菌膜形成量最高,显著高于0.05 μmol/L DPI处理组及0.5 μmol/L DPI平均菌膜形成量(P<0.05)。0.1 μmol/L DPI处理时,N6、L9、L12菌株形成较强菌膜;1 μmol/L DPI处理时,N6菌株形成较强菌膜,其他菌株均形成中等菌膜;0.05 μmol/L DPI处理时,Y34菌株形成较弱菌膜,其他菌株均形成中等菌膜;0.5 μmol/L DPI处理时,BC、Y34、L24菌株形成较弱菌膜,其他菌株均形成中等菌膜。 当DPI浓度>5 μmol/L 时,随着DPI浓度的升高,平均菌膜形成量低于对照组平均菌膜水平(P<0.05)。5 μmol/L DPI处理组平均菌膜形成量显著高于10 μmol/L DPI处理组平均菌膜形成量(P<0.05)。5 μmol/L DPI处理时, N6、Y10、L9、L12菌株形成中等菌膜,其他菌株均形成较弱菌膜;10 μmol/L DPI处理时,N6、L9、L12菌株形成中等菌膜,其他菌株均形成较弱菌膜;对照组N2、N6、Y10、L9、L12菌株形成中等菌膜,其他菌株BC、Y22、Y34、L6、L8、L24形成较弱菌膜。 由图6 ROS变化趋势可知,随着DPI浓度的升高,ROS的产生水平呈U型趋势。这是因为DPI是一种NADPH氧化酶抑制剂,抑制ROS产生,当DPI浓度≤1 μmol/L时,随着DPI浓度的升高,ROS逐渐下降;当DPI浓度>5 μmol/L时,随着DPI浓度的升高,ROS含量升高。结果表明:ROS产生和菌膜形成的趋势相反,即低浓度DPI处理伴随ROS的降低,Bacillus cereus菌膜形成量的增加,高浓度DPI处理伴随ROS含量的升高,Bacillus cereus菌膜形成量的减少,因此,Bacillus cereus菌膜形成与ROS的减少相关。 图6 不同DPI浓度对蜡样芽孢杆菌ROS产生及菌膜形成的影响Fig.6 Effect of different DPI concentration on ROS production and biofilms formation of Bacillus cereus 由图7A可知,0.01 μmol/L H2O2、1 μmol/L H2O2、100 μmol/L H2O2处理组与对照组相比具有更强的染色效果,菌膜呈现红色的网络结构,而未经处理组(对照组)呈现松散的结构和更少的菌膜生物量,与图2定量菌膜形成结果一致。由图7B可知,NAC各处理组与对照组相比具有更强的染色,各处理组菌膜呈现红色的网络结构,而对照组显示松散的结构和较少的菌膜生物量,与图4定量菌膜形成结果一致。由图7C可知,低浓度各处理组(DPI≤1 μmol/L)与对照相比具有更亮的染色,呈现红色的网络结构,高浓度处理组(DPI>5 μmol/L)随着DPI浓度的升高,红色信号越来越弱,当10 μmol/L DPI浓度处理时,视野中红色信号极少,表明低浓度的DPI处理对Bacillus cereus菌膜形成起促进作用,高浓度DPI处理对Bacillus cereus菌膜形成起抑制作用,与图6定量菌膜形成结果一致。因此,综合以上结果,本研究得到Bacillus cereus菌膜形成与ROS减少相关的结论,这与HAJ等[24]发现金黄色葡萄球菌(Staphylococcus aureus)菌膜的形成依赖于ROS诱导量减少有关的研究结果一致。 图7 共聚焦显微镜下观察不同浓度(H2O2、NAC、DPI)对蜡样芽孢杆菌菌膜形成的影响Fig.7 Effect of different concentrations (H2O2, NAC, DPI) on the formation of Bacillus cereus biofilms observedunder confocal microscope ROS包括羟基自由基(OH)、原子氧(O)、过氧化氢(H2O2)、单线态氧(1O2)和臭氧(O3)等,ROS的累积超过允许水平会对各种大分子(DNA、蛋白质和脂质)造成损害,最终导致细胞死亡[25],ROS在生物体中的作用不是单一的、绝对的,细菌往往会通过某些途径主动生成较低水平的ROS,这些ROS在细菌中起到信号或是调节的作用,激发细菌某些特殊机制,如进入防御状态、辅助细菌入侵宿主细胞、抑制环境中其他竞争者等[26]。CAP等[27]研究发现一定水平的ROS诱导会保护机体免受压力机制,引起菌体对压力适应性反应,ROS可能是作为诱导细菌群落分化和信号传递的信号分子,ROS诱导遗传变异促进特定菌膜区域的细胞死亡,以部分细胞的死亡增加同一群体中其他细胞的存活。 因此,ROS作为一种信号分子,探究其在细菌及其菌膜形成中的具体作用,有利于研发新型高效的抑菌剂和杀菌剂。本研究从不同奶源Bacillus cereus分离株的菌膜形成分析入手,以一定浓度的H2O2、NAC、DPI处理待测菌株,采用96孔结晶紫定量测定及激光共聚焦显微镜观察菌膜形成情况,实验中测试了细菌细胞活力,以排除试剂对细菌活性的影响,发现ROS是Bacillus cereus菌膜形成的潜在信号分子,随着ROS的减少,Bacillus cereus菌膜形成量增加。在未来的研究中,还需进一步剖析外源ROS和内源ROS在调节菌膜形成中是否发挥不同的作用,并检测可疑NADPH氧化酶的敲除和过表达是否改变Bacillus cereus的ROS产生和菌膜形成,这将有助于理解Bacillus cereus与ROS相关的菌膜形成机制。1.3 数据处理
2 结果与分析
2.1 H2O2对Bacillus cereus生长及菌膜形成的影响

2.2 NAC对Bacillus cereus生长及菌膜形成的影响


2.3 DPI对Bacillus cereus生长及菌膜形成的影响


2.4 激光共聚焦显微镜测定菌膜形成
3 结论与讨论
