产柠檬酸黑曲霉菌种诱变选育及发酵条件优化
2014-02-23李忠英
李忠英
(湖南化工职业技术学院,湖南株洲412004)
产柠檬酸黑曲霉菌种诱变选育及发酵条件优化
李忠英
(湖南化工职业技术学院,湖南株洲412004)
为了选育高产柠檬酸菌种,以前期分离到的一株黑曲霉(Aspergillus niger)YZ-35为出发菌株,经紫外线(UV)与硫酸二乙酯(DES)复合诱变后,进行了产柠檬酸发酵条件优化试验。结果表明,选育出黑曲霉UV-DE-3是一株优良高产菌株,该菌株的产酸率达到11.54%,比初始菌株(YZ-35)产酸率提高了69.70%;以红薯为发酵原料,在初始糖含量12%、温度35℃、起始pH值为6.5,转速160 r/min、发酵时间72 h的优化条件下,摇瓶发酵平均产酸率达到14.24%。
黑曲霉;复合诱变;柠檬酸;条件优化
柠檬酸也称枸椽酸,是一种极为重要的有机酸,广泛应用于食品、饮料、医药、化工、冶金等领域[1-2]。柠檬酸的工业生产目前以淀粉质原料,发酵菌株以黑曲霉为主。对于柠檬酸发酵行业,所用菌株的产酸能力是影响现代柠檬发酵生产的关键因素。因此,利用各种诱变手段选育高产柠檬酸生产菌一直是国内外研究的重点。近年来,国内外有些对柠檬酸发酵菌种的选育研究报道[3-5],周定等[6]采用采硫酸二乙酯和亚硝基胍诱变选育一株变异株,其产酸率7.60%。目前野生型菌种的柠檬酸产量相对较低,本研究通过利用紫外线(ultraviolet ray,UV)、化学诱变剂硫酸二乙酯(diethyl sulfate,DES)对初筛菌株黑曲霉(Aspergillus niger)YZ-35进复合诱变来提高其产柠檬酸能力,以期提供具有应用价值的菌株。与此同时寻找来源广泛、价格低廉的生产原料一直是生产企业和研究人员的一个重要研究方向。近年来以红薯粉作为柠檬酸发酵生产的替代原料日益受到关注[7-9]。
本研究以性价比较高的产柠檬酸菌株为出发菌,采用经UV和DES复合诱变处理方法,改进和提升其产酸率及耐酸度。同时对改良后的优势菌的发酵条件进行优化实验,旨在建立适用于现代柠檬酸发酵的新工艺。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
黑曲霉(Aspergillus niger)YZ-35:湖南化工职业技术学院国家生物制药基地保藏。
1.1.2 化学试剂
葡萄糖、吡啶(分析纯)、NH4NO3(分析纯)、K2HPO4(分析纯)、溴甲酚绿(分析纯)、MgSO4·7H2O(分析纯)、硫酸二乙酯(分析纯)、醋酐(分析纯),酒石酸钾钠(分析纯):天津科密欧试剂厂生产。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)斜面培养基:马铃薯200 g,葡萄糖15 g,琼脂20 g,加水1 000 mL,pH值自然。
固体平板培养基:葡萄糖5 g/L、NH4NO33 g/L、K2HPO41.0 g/L、溴甲酚绿0.05 g/L、琼脂20 g/L。
发酵培养基:甘薯(粉)50 g/L、葡萄糖50 g/L、NH4Cl 3.0 g/L、KH2PO41.0 g/L、MgSO4·7H2O 0.20 g/L。
1.2 仪器与设备
UV-2550紫外分光光度计:日本岛津公司;80-2型离心机:江苏省金坛市宏华仪器厂;EL303电子天平:梅特勒-托利多仪器上海有限公司;DL-1电炉:天津泰斯特仪器有限公司;XFH-75CA蒸汽灭菌锅:上海申安医疗器械厂;LDZX-50FAS恒温水浴箱:上海瑞仰净化装备有限公司;SW-CJ-1FD超净工作台:江苏绿叶净化科技有限公司;QYC-21全温空气摇床:上海福玛实验设备有限公司;HPS-250生化培养箱:河南东明医疗器械有限责任公司;血球计数板:上海求精生化试剂有限公司。
1.3 试验方法
1.3.1 悬浮液制备
用生理盐水制备菌悬液,加入玻璃珠振荡分散,分散程度达90%以上。同时用血球计数板计数,控制孢子含量为106~108CFU/mL。
1.3.2 柠檬酸总酸度测定
总酸度测定采用NaOH滴定法[10]:将发酵液经脱脂棉过滤后,用定性滤纸过滤,吸取上清液25 mL于250 mL锥形瓶中,加蒸馏水100 mL,并滴加0.5%酚酞试剂2~3滴,用0.055 46 mol/L的NaOH溶液滴定,记录所消耗的NaOH溶液体积。产酸率计算公式如下:

式中:X为产酸率,%;CNaOH为NaOH的物质的量,mol/L;V为所消耗的NaOH体积,mL;M柠为柠檬酸摩尔质量,g/mol。
1.3.3 紫外及硫酸二乙酯复合诱变
参照李忠英等[11]的实验方法进行,菌悬液先用30 W紫外线照射处理60 s,然后再用物质的量为0.2 mol/L的硫酸二乙酯处理20 min[12],诱变菌株经培养后,挑取菌落较大且厚的菌株,编号并接入试管斜面保藏,同时取对应的菌株活化后接种到250 mL摇瓶中,35℃、180 r/min摇床发酵培养5 d,对发酵液进行分析并选取优势菌株。
1.3.4 发酵条件优化方法
采用单因素试验,分别研究发酵温度、起始pH值、初始糖度、接种量及发酵时间对优势菌株发酵产柠檬酸的影响。在此基础上,运用正交辅助设计进行优化,确定最佳发酵条件。
2 结果与分析
2.1 紫外线诱变筛选结果
菌悬液采用30 W紫外线照射处理60 s,从固体鉴别培养基上选取透明圈直径(D)/菌落直径(d)比值较大的菌株,接种于发酵培养基中,置于37℃、180r/min摇床培养5 d,测定产酸率,以出发菌株黑曲霉(Aspergillus niger)YZ-35为对照,具体结果见表1。
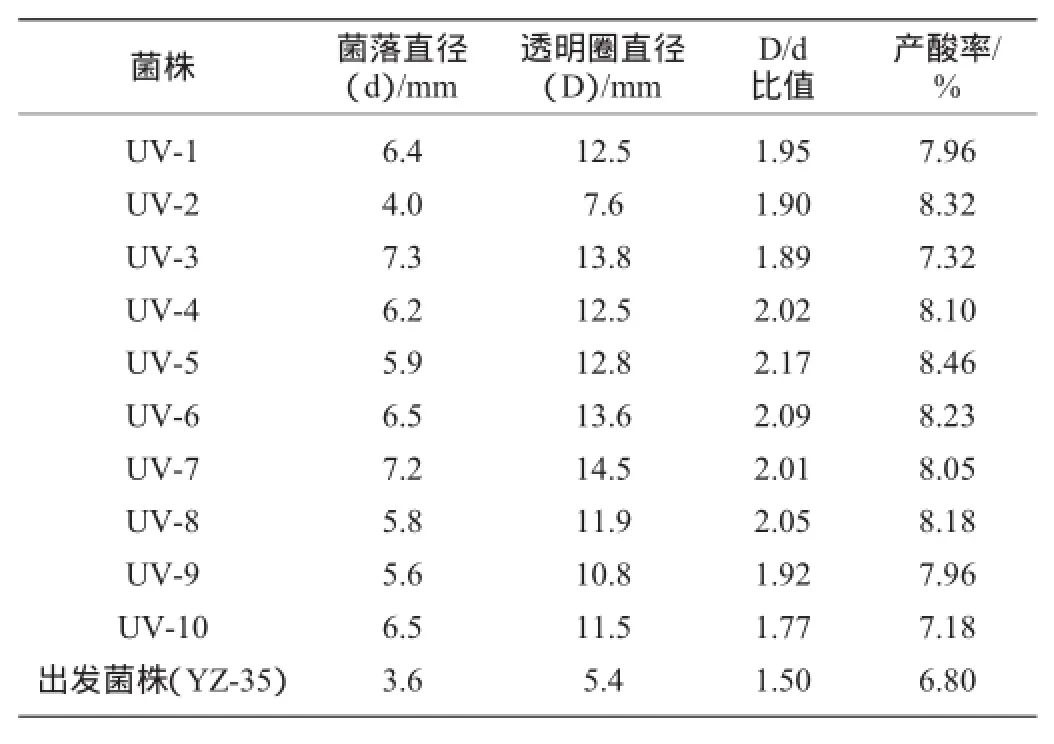
表1 UV诱变后部分菌株的D/d值与产酸率Table 1 D/d value and acid production rate of some strains after UV mutagenesis
紫外线诱变属于非电离辐射,作用机理是将被处理的物质分子或原子中的内层电子提高能级,致使DNA链和氢键断裂等生物学效应,从而提高柠檬酸产量[13]。由表1可知,D/d值与产酸量呈正相关,D/d值越大,所对应的产酸率也越高。结果表明,UV-5产酸率最高,达到8.46%,比原始菌株(Aspergillus niger)YZ-35提高了24.41%。故选择UV-5作为下一步DES化学诱变的出发菌株。
2.2 硫酸二乙酯诱变筛选结果
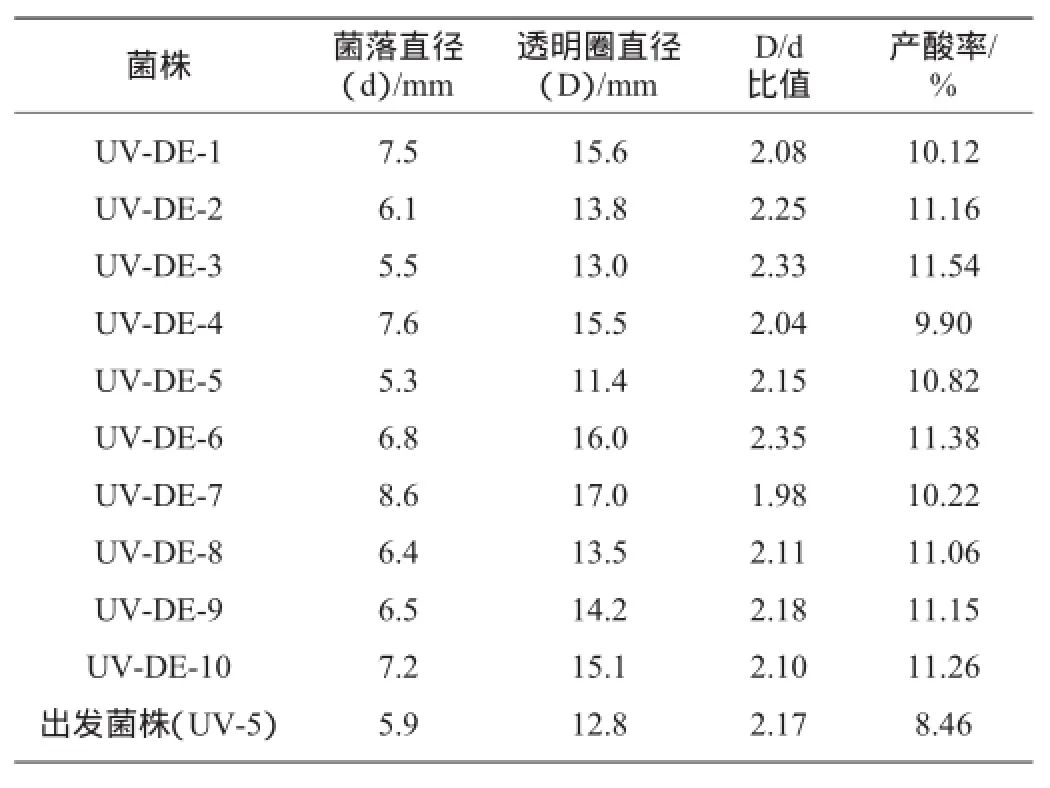
表2 DES诱变后部分菌株的D/d值与产酸率Table 2 D/d value and acid production rate of some strains after DES mutagenesis
UV和DES诱变虽然作用机理不同,但都能使微生物细胞中的DNA突变,其中DES是一种烷化剂,能与DNA中碱基发生化学变化,从而引起突变[14]。本研究对UV-5进行DES化学诱变,选取稀释度为10-4的菌悬液进行诱变处理,诱变时间为40 min,取0.1 mL涂布培养3 d。从培养基中挑选出D/d值相对较大的10株,分别标记为UV-DE-1~UV-DE-10。斜面培养的同时,接入摇瓶中在35℃发酵5 d,检测其产酸率,结果(表2)可知,经硫酸二乙酯(DES)诱变后的菌株产酸量进一步提高。其中以UV-DE-3产酸率最高,达到11.54%,比出发菌株(UV-5)产酸率提高了36.40%。比原始出发菌株黑曲霉(Aspergillus niger)YZ-35的产酸率提高69.70%。
2.3 单因素试验结果
2.3.1 发酵温度对菌株UV-DE-3产酸的影响
发酵温度对菌株UV-DE-3发酵的影响如图1所示。由图1可知,温度对该菌发酵影响显著。当温度<25℃时,产酸率是随着温度的升高而逐渐增加。发酵温度在32~38℃之间产酸率相对稳定,当温度达到35℃时,产酸率达到最佳,达到13.08%,之后随着温度的升高而降低。但发酵温度>40℃时,该菌的发酵力显著下降,可能是因为大量的糖用于合成菌体和氧化成CO2和H2O,产酸率也会相对会降低[15]。因此,发酵温度35℃为宜。

图1 发酵温度对菌株UV-DE-3产酸率的影响Fig.1 Effects of fermentation temperature on the strain UV-DE-3 acid production rate
2.3.2 初始pH对菌株UV-DE-3产酸的影响
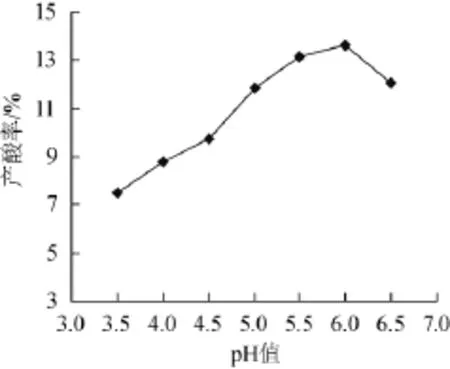
图2 初始pH对菌株UV-DE-3产酸率的影响Fig.2 Effects of initial pH on strain UV-DE-3 acid production rate
柠檬酸主要发酵菌黑曲霉是嗜酸性微生物,黑曲霉在生长和发酵柠檬酸不同阶段需要不同的pH值,黑曲霉生长的最适pH值为3.0~7.0。初始pH对菌株发酵的影响结果如图2所示,由图2可知,UV-DE-3菌能在pH值为3.5~6.5的范围内都能产酸,在pH值为6.0时达到最高。而当pH>6.5时,产酸率会迅速下降。所以该菌的最适初始pH值为5.5~6.5而这也正是实际生产中的正常pH值范围,说明了UV-DE-3菌可用于实际生产应用。因此,初始pH值6.0为宜。
2.3.3 初始糖含量对菌株UV-DE-3产酸的影响
菌株UV-DE-3在不同初始糖含量中发酵情况如图3所示。由图3可知,该菌在低浓度的葡萄糖中都能较好生长,在初始糖含量10%~20%,产酸率相对稳定,再继续提高糖含量也不能提高产量,这也表明以红薯为淀粉基质培养基已能满足生产菌对碳源的需求,不需要额外提供。因此,最适初始糖含量为12%。

图3 初始糖含量对菌种UV-DE-3产酸率的影响Fig.3 Effects of initial glucose concentration on strain UV-DE-3 acid production rate
2.3.4 转速对菌株UV-DE-3产酸的影响
柠檬酸发酵时,需要在发酵液中维持一定的溶解氧量。通风和搅拌是增加培养基内溶解氧的主要方法。随着菌体生成,发酵液中的溶解氧会逐渐降低,从而抑制了柠檬酸的合成。不同转速对产酸率的影响结果如图4所示。

图4 转速对菌种UV-DE-3产酸率影响Fig.4 Effects of rotate speed on strain UV-DE-3 acid production rate
由图4可知,转速对产酸率影响较为显著。当转速160 r/min时,产酸率最高,为13.50%。随着菌体生成,发酵液中的溶解氧会逐渐降低,从而抑制了柠檬酸的合成。增加培养液中溶解氧对产酸有利。但转速过快,会产生过大的剪切力,损伤细胞而导致产量下降。因此,最佳转速为160 r/min。
2.3.5 发酵时间对菌株UV-DE-3产酸的影响
发酵时间对菌株UV-DE-3产酸率的影响结果如图5所示。由图5可知,发酵时间在36~72 h,产酸率随着发酵时间的增加而增高,并在72 h内达到最大。在72~96 h内,柠檬酸产酸率维持较高水平,>96 h后,发酵能力下降。考虑到生产成本等因素,选择发酵时间以72 h为宜。

图5 发酵时间对菌种UV-DE-3产酸率影响Fig.5 Effects of Fermentation time on strain UV-DE-3 acid production rate
2.4 正交试验结果与分析
根据以上单因素试验结果,在初始糖含量为12%,选择以发酵温度、转速、起始pH及发酵时间作为试验因素,以产酸率为考察指标,采用L9(34)正交试验表进行设计并试验,结果与分析见表3。

表3 发酵条件优化正交试验结果与分析Table 3 Results and analysis of orthogonal tests for fermentation conditions optimization
由表3可知,影响发酵产柠檬酸大小依次为A>D>C>B,各因素的最佳组合为A2B3C2D2,即菌株UV-DE-3产柠檬酸最优发酵条件为初始糖含量12%、温度35℃、起始pH值为6.5,转速160 r/min、发酵72 h,在该条件下进行验证试验,结果表明,菌株UV-DE-3发酵产酸率可达到14.24%。
3 结论
本研究结果表明试验经过紫外线诱变筛选出多株优势菌,以菌株UV-5产酸率最高,达到8.46%,比原始菌株(Aspergillus niger)YZ-35提高了24.41%,再以菌株UV-5菌株为出发菌株,经硫酸二乙酯诱变后其产酸量进一步提高,其中以菌株UV-DE-3产酸率最高,达到11.54%,比出发菌株(UV-5)产酸率提高了36.40%。说明紫外线和硫酸二乙酯复合诱变对黑曲霉菌种选育较为敏感且效果好。
该工艺以红薯为发酵原料,在初始糖含量12%、温度35℃、起始pH值为6.5,转速160 r/min、发酵72 h的优化条件下,菌株UV-DE-3摇瓶发酵平均产酸率可达到14.24%。
[1]陈效兰,雷钢铁.柠檬酸在食品工业中的应用[J].食品研究与开发,2000,21(3):6-7.
[2]赵琴,李红,魏婷婷,等.柠檬酸高产黑曲霉菌株选育与发酵新底物研究[J].重庆师范大学学报:自然科学版,2008,25(1):79-80.
[3]任晓莉,赵林,赵润柱.柠檬酸发酵生产菌种黑曲霉的选育[J].食品工业科技,2010,31(8):151-153.
[4]SANJAY G,CHANDRA B S.Biochemical studies of citric acid production and byAspergillus niermutants[J].Biotechnol Lett,2002,18(5): 378-380.
[5]HAQ I U,KHURSHID S,ALI S,et al.Mutation ofAspergillus nigerfor hyperproduction of citric acid from black strap molasses[J].World J Microbiol Biotechnol,2001,17(6):35-37.
[6]周定,王建龙.柠檬酸产生菌黑曲霉诱变选育的研究[J].微生物学杂志,1993,13(2):4-5.
[7]刘璇,钱莹,段钢.农产品加工副产物在柠檬的不同发酵类型中的应用[J].中国酿造,2012,31(7):15-17.
[8]杜连启.薯渣生产柠檬酸和柠檬酸钙的技术[J].农产品加工,2010(2):30-31.
[9]高年发,杨枫.我国柠檬酸发酵工业的创新与发展[J].中国酿造,2010,29(7):1-6.
[10]金其荣,张继民,徐勤.有机酸发酵工艺学[M].北京:中国轻工业出版社,1994.
[11]李忠英,肖杨娟,罗跃中,等.UV与DES复合诱变选育高产脂肪酶菌株[J].氨基酸和生物资源,2011,33(3):6-9.
[12]王然,李秀婷,陈存社,等.硫酸二乙酯、紫外及γCO60辐射诱变筛选高产丁二酮菌株[J].中国食品学报,2010,10(3):88-91.
[13]潘涛,周剑,虞龙.紫外诱变柠檬酸生产菌黑曲霉的选育[J].化学与生物工程,2007,24(1):50-52.
[14]张克旭,陈宁,张蓓,等.代谢控制发酵[M].北京:中国轻工业出版社,2004.
[15]SODECK G,KOMINEK,SALZBRUM W.Citric acid production using Aspergillus niger[J].Process Biochem,1981,16(9):931-934.
Mutation breeding of citric acid producingAspergillus nigerand optimization of fermentation conditions
LI Zhongying
(Hunan Chemical Industry Vocation Technology College,Zhuzhou 412004,China)
In order to breed high yield strains of citric acid,using the pre-isolated strain ofAspergillus nigerYZ-35 as starting strain after ultraviolet radiation and diethyl sulfate compound mutation,the experiments of fermentation conditions optimization for citric acid production were carried out. The results showed thatA.nigerUV-DE-3 was strain with high citric acid production,the acid production rate reached 11.54%,which was 69.70% higher than the initial strain YZ-35.Using sweet potato as raw material,under the optimal condition of initial sugar concentration 12%,temperature 35℃,initial pH 6.5,rotated speed 160 r/min,time 72 h,the average acid production rate by shake flask fermentation was 14.24%.
Aspergillus niger;compound mutation;citric acid;conditions optimization
TQ921.1
A
0254-5071(2014)11-0094-04
10.11882/j.issn.0254-5071.2014.11.021
2014-08-17
湖南省教育厅科研一般项目(12C1048)
李忠英(1980-),女,讲师,硕士,研究方向为化学应用。
