发酵辣椒中产亚硝酸盐还原酶短乳杆菌L5的选育及特性研究
2014-02-23王兰赵玲艳陈思思王雪艳游静邓放明
王兰,赵玲艳,陈思思,王雪艳,游静,邓放明*
(1.湖南农业大学食品科技学院,湖南长沙410128;2.常德市鼎城区质量技术监督局,湖南常德415100)
发酵辣椒中产亚硝酸盐还原酶短乳杆菌L5的选育及特性研究
王兰1,赵玲艳1,陈思思1,王雪艳1,游静2,邓放明1*
(1.湖南农业大学食品科技学院,湖南长沙410128;2.常德市鼎城区质量技术监督局,湖南常德415100)
以传统发酵辣椒为分离源,从中分离出10株可降解亚硝酸盐的乳酸菌,经过复筛得到一株产亚硝酸盐还原酶能力最强的短乳杆菌(Lactobacillus brevis)L5,并通过单因素及正交试验对其降解特性进行了研究。结果表明:L5对亚硝酸盐有明显的降解作用,在正常培养条件下,发酵36 h,L5对亚硝酸盐的降解率为56.25%;在维持pH 6.0以上,消除酸对亚硝酸盐降解作用的条件下,发酵36 h,L5对亚硝酸盐的降解率为66.42%,主要为产酶降解。L5降解亚硝酸盐的最佳条件为温度34℃,时间30 h,底物质量浓度120 mg/L,食盐含量6%,此时,L5对亚硝酸盐的降解率可达82.84%。
发酵辣椒;亚硝酸盐;亚硝酸盐还原酶;短乳杆菌L5;特性
传统发酵辣椒主要是依靠天然附着在其表面的乳酸菌进行乳酸发酵完成的,但发酵过程中不可避免的会产生亚硝酸盐,亚硝酸盐是潜在的致癌物质,可与食品中蛋白质分解中间产物仲胺在酸性条件下转化成亚硝胺,此物质具有强烈的致癌性,可诱发肝癌、胃癌、食道癌和咽癌等多种癌症[1-2]。传统腌泡菜、各种肉灌肠中也都存在亚硝酸盐超标的问题[3]。因此,如何降低亚硝酸盐的含量成为了食品研究人员关注的热点问题。目前,降解亚硝酸盐的方法主要有化学法和生物法[4],其中生物法是研究的重点,主要是利用可降解亚硝酸盐的微生物[5]或其产生的亚硝酸盐还原酶[6],来降低亚硝酸盐的含量。闫金星等[7]从东北朝鲜族咸菜中分离出6株降解亚硝酸盐能力较强的乳酸菌株,其中4株为植物乳杆菌,2株为明珠片球菌。张庆芳等[8]分析了乳酸菌降解肉制品中亚硝酸盐的机理,发现乳酸菌降解亚硝酸盐分为两部分,在pH>4.5的发酵前期主要以酶降解为主;在pH<4.0的发酵后期,主要以酸降解为主。龚钢明团队成功地从发酵食品中分离出了产亚硝酸盐还原酶的乳酸菌,并对其编码亚硝酸盐还原酶的基因进行了克隆[9-10]。本试验就高效产亚硝酸还原酶乳酸菌菌株的选育及特性进行探讨,为深入研究生物酶法消除食品中亚硝酸盐提供一定的基础,也为实现发酵辣椒的纯种发酵并使之标准化、规模化、安全化生产提供理论依据。
1 材料与方法
1.1 材料与试剂
乳酸菌:从传统发酵辣椒中利用MRS培养基筛选得到。
MRS液体培养基:蛋白胨10.0 g,牛肉膏5.0 g,酵母粉4.0 g,葡萄糖20.0 g,吐温80 1.0 mL,磷酸氢二钾2.0 g,乙酸钠5.0 g,柠檬酸三铵2.0 g,硫酸镁0.2 g,硫酸锰0.05 g,蒸馏水1 L;MRS琼脂培养基:MRS液体培养基+琼脂15.0 g;亚硝酸钠盐培养基:MRS液体培养基+亚硝酸钠2g。
上述培养基均调节pH 6.2~6.4,121℃灭菌15 min。
pH 6.8磷酸盐缓冲液亚硝酸钠盐培养基:亚硝酸钠盐培养基+磷酸盐缓冲液,调节pH 6.8,121℃灭菌15 min。
1.2 仪器与设备
DL-1 220V电炉:北京中兴伟业仪器有限公司;BCD-318WSL冰箱:青岛海尔股份有限公司;CP214电子天平:长沙鼎程科学仪器有限公司;SW-CJ-2D超净工作台:苏州市汉达工业自动化有限公司;PX-25085-II恒温培养箱:上海新苗医疗器械制造有限公司;LMQ.J3870C立式灭菌锅:山东新华医疗器械股份有限公司;pHS-3C型精密pH计:上海精密科学仪器有限公司;78-2磁力搅拌器:常州华普达教学仪器有限公司;CX21BIM-SET5奥林巴斯显微镜:上海豫光仪器有限公司;722分光光度计:上海宜友电子科技有限公司;JSM-6380LV扫描电镜:日本电子株式会社。
1.3 方法
1.3.1 乳酸菌菌落与形态特征观察
将实验室保存的乳酸菌在MRS液体培养基中活化后,取种龄为24 h的菌种,划线于MRS琼脂平板,37℃恒温培养24~48 h,记录菌落特征,同时挑取单一菌落进行革兰氏染色镜检和扫描电子显微镜观察[11-12],记录形态特征。
1.3.2 优良降亚硝酸盐短乳杆菌L5的初筛
将1.3.1鉴定的G+短乳杆菌菌株在MRS液体培养基中活化后,取种龄为24 h的菌种,按1 g/L接种量接种于亚硝酸钠盐培养基中,37℃恒温培养,分别检测第12 h和36h发酵液中NaNO2含量与pH值,同时做不接种对照试验[13]。
1.3.3 产亚硝酸盐还原酶短乳杆菌L5的复筛
pH 6.8磷酸盐缓冲液亚硝酸钠盐培养基筛选L5:将初筛得到的优良降亚硝酸盐的短乳杆菌菌株在MRS液体培养基中活化,取种龄为24 h的菌种,按1 g/L接种量接种于pH 6.8磷酸盐缓冲液亚硝酸钠盐培养基中,37℃恒温培养,分别检测12 h和36 h发酵液中NaNO2含量与pH值,同时做不接种对照试验。
调节酸度筛选产亚硝酸盐还原酶的L5:将初筛得到的优良降亚硝酸盐的短乳杆菌菌株在MRS液体培养基中活化,取种龄为24 h的菌种,按1 g/L接种量接种于亚硝酸钠盐培养基中,于发酵罐中37℃恒温培养,通过自动滴加NaOH维持pH值6.8,分别检测12 h、24 h、36 h发酵液中NaNO2含量与pH值,同时做不接种对照试验,不接种对照组滴加蒸馏水,保持接种组和对照组最终体积一致[14]。
1.3.4 L5降解亚硝酸盐的最佳条件研究
L5降解亚硝酸盐的最佳底物浓度研究:将在MRS液体培养基中培养24 h的L5菌液以1 mL的接种量分别接入100 mL含30 mg/L、50 mg/L、80 mg/L、100 mg/L、120 mg/L、150 mg/L亚硝酸钠的MRS液体培养基中,37℃恒温培养,分别检测12 h、36 h发酵液中NaNO2含量,以相同条件下的空白培养基作对照。
L5降解亚硝酸盐的最佳温度研究:将在MRS液体培养基中培养24 h的L5菌液以1 mL的接种量接入100 mL含100 mg/L亚硝酸钠的MRS液体培养基中,分别在25℃、30℃、34℃、37℃、42℃条件下培养,分别检测12 h、36 h发酵液中NaNO2含量,以相同条件下的空白培养基作对照。
L5降解亚硝酸盐的最佳氯化钠含量研究:用氯化钠将100 mL含100 mg/L亚硝酸钠的MRS液体培养基调至0、4%、6%、8%、10%、12%的不同盐含量梯度系列,将在MRS液体培养基中培养24 h的L5菌液以1 mL的接种量接入其中,37℃恒温培养,分别检测12h、36h发酵液中NaNO2含量,以相同条件下的空白培养基作对照。
L5降解亚硝酸盐的最佳培养时间及降解速率研究:将在MRS液体培养基中培养24 h的L5菌液以1 mL的接种量接入100 mL不加食盐或添加4%食盐的含100 mg/L亚硝酸钠的MRS液体培养基中,37℃恒温培养,分别检测12 h、24h、36h、48h、60h、72h发酵液中NaNO2含量,以相同条件下的空白培养基作对照。
L5降解亚硝酸盐最佳条件的正交试验设计:为确定L5降解亚硝酸盐的最佳条件,设计以温度、时间、底物浓度和食盐浓度的4因素3水平L9(34)正交试验。
1.3.5 亚硝酸盐测定
亚硝酸盐含量跟据GB/T 5009.33—2010《食品中亚硝酸盐与硝酸盐的测定》测定[15]。
2 结果与分析
2.1 L5的菌落与形态特征
2.1.1 L5的菌落特征
L5经48 h培养,平板表面长出大小几乎一致,直径约1 mm的圆形菌落,随培养时间的延长而变大,菌落表面光滑、黏稠,呈灰白色、凸起[17]。
2.1.2 L5的形态特征
自然状态下的乳酸菌大多数为杆菌,其中还有少量球菌,其宽0.35~0.50μm,长0.8~2.0μm,两端平,无芽孢[18-19]。本试验所选育出的L5菌株形态特征经革染镜检和扫描电镜观察如图1、图2所示,结果鉴定为G+短乳杆菌。
2.2 优良降亚硝酸盐短乳杆菌L5的初筛结果分析
亚硝酸钠盐培养基中亚硝酸盐降解率见表1。由表1可知,随着发酵时间的延长,发酵液中亚硝酸盐含量都有所降低,且在同一时间,短乳杆菌菌株不同,发酵液中亚硝酸盐降解量也不同。另外由乳酸菌在代谢过程中不断产生乳酸致发酵液中pH值不断下降,可知,乳酸菌对亚硝酸盐具有一定的降解作用。

图2 L5菌株电镜图Fig.2 Electron microscopy figure of strain L5
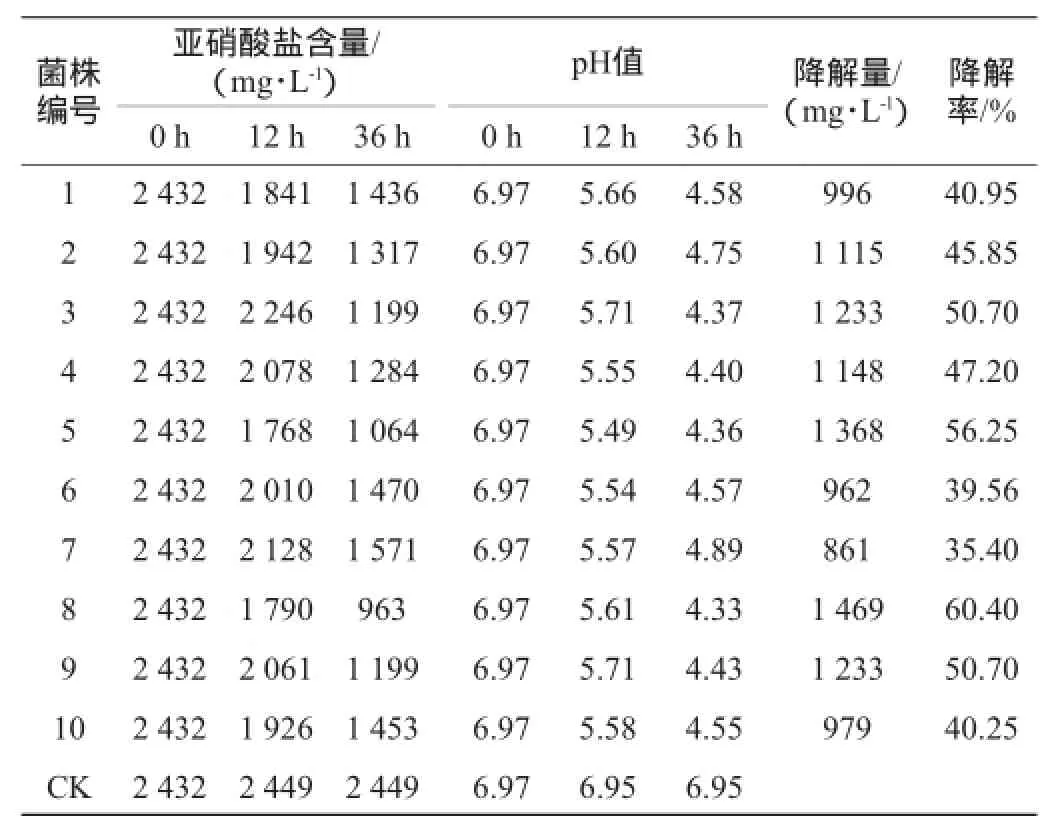
表1 亚硝酸钠盐培养基中亚硝酸盐降解率Table 1 Degradation rate of nitrite in sodium nitrite culture medium
2.3 产亚硝酸盐还原酶短乳杆菌L5的复筛
2.3.1 pH 6.8磷酸盐缓冲液亚硝酸钠盐培养基筛选L5
pH 6.8磷酸盐缓冲液筛选的结果见表2。由表2可知,发酵至12 h时,发酵液中pH值始终维持在>6.00,而发酵液中亚硝酸盐含量都有所降低,由此可初步推测亚硝酸盐的降解与乳酸菌体内酶的作用也有关。当发酵至36 h时,培养基中的pH值都降至了5.00左右,因为乳酸的作用,尚不能确定哪株菌株产亚硝酸盐还原酶能力强。因此,将这10株菌株在培养过程中不断的调节酸度,以维持其pH值>6.00。

表2 pH6.8磷酸盐缓冲液亚硝酸钠盐培养基中亚硝酸盐的降解率Table 2 Degradation rate of nitrite in phosphate buffer sodium nitrite culture medium(pH 6.8)
2.3.2 调节酸度筛选产亚硝酸盐还原酶的L5
调节酸度筛选的结果见表3。由表3可知,通过控制发酵液中的pH值,使其始终维持在>6.00,消除酸对亚硝酸盐的降解作用后,上述乳酸菌仍具有较强的降解亚硝酸盐作用。由此可推测上述乳酸菌对亚硝酸盐的降解作用包括酸降解和酶降解,但不同菌株之间降解能力有所差异,其中5号菌株降解能力最强,其降解率为66.42%。

表3 控制发酵液的pH值的亚硝酸盐的降解率Table 3 Degradation rate of nitrite in pH controlled medium
2.4 L5降解亚硝酸盐的最佳条件研究结果分析
2.4.1 L5降解亚硝酸盐的最佳底物浓度结果分析
由图3可知,L5降解亚硝酸盐的量在L5培养12 h之前是随着亚硝酸盐浓度的增加而增加的,但随着时间的延长,培养至36 h、底物浓度为120 mg/L时亚硝酸盐降解率出现了最大值,因此可以初步判断其最适合的底物浓度为120 mg/L左右。

图3 底物浓度对亚硝酸盐降解量的影响Fig.3 Effect of substrate concentration on nitrite degradation
2.4.2 L5降解亚硝酸盐的最适温度结果分析

图4 温度对亚硝酸盐降解率的影响Fig.4 Effect of temperature on nitrite degradation rate
由图4可知,不同温度条件下L5都有降解亚硝酸盐的作用,随着时间的延长,不同温度对亚硝酸盐的去除作用有很大的差异,温度在34℃和37℃时,发酵液中亚硝酸盐的降解率明显高于25℃和30℃时亚硝酸盐的降解率,由此可以找出其最佳降解亚硝酸盐的温度为34℃左右。
2.4.3 L5降解亚硝酸盐的最佳食盐浓度结果分析

图5 食盐浓度对亚硝酸盐降解率的影响Fig.5 Effect of salt concentration on nitrite degradation rate
由图5可知,食盐对L5降解亚硝酸盐的影响是非常大的,L5发酵液在加2%或4%食盐时亚硝酸盐几乎全部降解,但随着食盐浓度的增加,其降解率不断减少,由此可以看出,食盐对L5降解亚硝酸盐有明显的抑制作用,且乳酸菌降解亚硝酸盐量与培养液中氯化钠含量有极显著的负相关。
2.4.4 L5降解亚硝酸盐的最佳培养时间及降解速率结果分析

图6 时间对亚硝酸盐降解率的影响Fig.6 Effect of time on nitrite degradation
由图6可知,L5培养36 h之前发酵液中的亚硝酸盐降解速率比较快,而在36 h之后降解速率比较慢,到最后几乎不降解。同时其pH值变化和亚硝酸盐降解量几乎是同步的。因此在接种发酵时,应接种培养为36 h左右的乳酸菌。
2.4.5 L5降解亚硝酸盐最佳条件研究正交试验结果分析
根据单因素试验结果,设计L9(34)正交试验结果优化L5降解亚硝酸盐的最佳条件。试验设计及结果见表4,方差分析结果见表5。
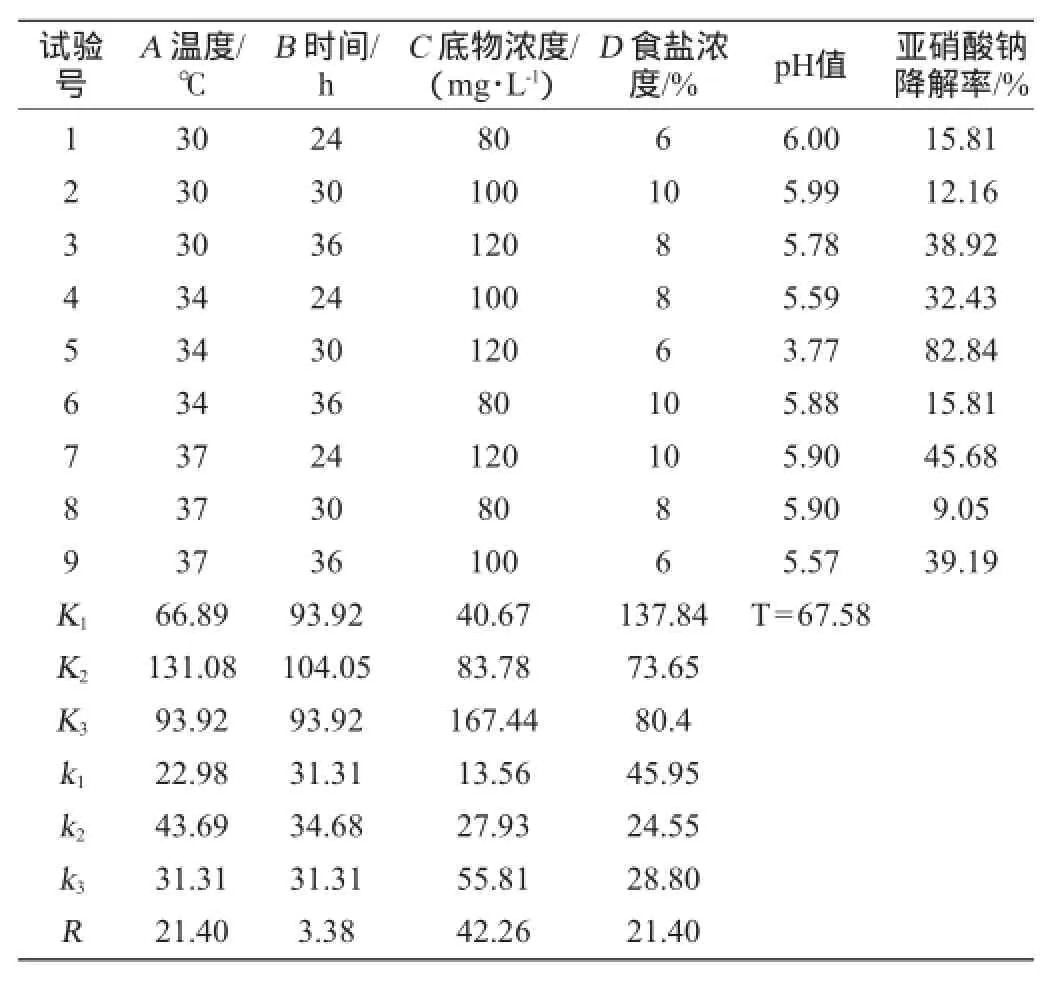
表4 亚硝酸盐降解条件优化正交试验结果与分析Table 4 Results and analysis of orthogonal test for nitrite degradation rate conditions optimization

表5 正交试验结果方差分析Table 5 Variance analysis of orthogonal test results
根据表4极差值分析结果可以得出,各因素由主到次的顺序对短乳杆菌L5降解亚硝酸盐的影响是:底物浓度>温度、食盐浓度>培养时间。最优组合为A2B2C3D1,即温度34℃,时间30 h,底物浓度120 mg/L,食盐浓度6%,在最优水平条件下L5对亚硝酸盐降解率为82.84%。
方差分析结果表明因素底物浓度对试验结果的影响极显著(P<0.01),而因素温度和食盐浓度则达到了显著的水平(P<0.05)。
3 结论
从传统发酵辣椒中分离出10株可降解亚硝酸盐的乳酸菌,经过复筛得到一株产亚硝酸盐还原酶能力最强的短乳杆菌(Lactobacillus brevis)L5。
L5对亚硝酸盐有明显的降解作用,在正常培养条件下,发酵36 h,L5对亚硝酸盐的降解率为56.25%;在维持pH 6.0以上,消除酸对亚硝酸盐降解作用的条件下,发酵36 h,L5对亚硝酸盐的降解率为66.42%,主要为产酶降解。
通过单因素试验和正交试验,得出L5降解亚硝酸盐的最佳条件为温度34℃,时间30 h,底物浓度120 mg/L,食盐浓度6%。此条件下,L5对亚硝酸盐的降解率可达82.84%。
[1]GANGOLLI S D,BRANDT P A,FERON V J,et al.Nitrates,nitritesandntitroso compounds[J].Environ Toxicol Pharm,1994,29(2):l-38.
[2]刘近周,彭恕生,林希蕴.大蒜阻断亚硝胺的化学合成[J].营养学报,1986,8(1):9-13.
[3]钟艳清,夏延斌.自然发酵辣椒中一株乳酸菌的分离筛选及鉴定[J].农产品加工学刊,2011(11):52-54.
[4]唐发书,贾仁勇,彭顺清,等.葡萄糖和维生素C(VitC)对香肠中亚硝酸盐残留量的影响[J].四川畜牧兽医学院学报,2000,14(3):36-38.
[5]YOON J H,KANG S S,MHEEN T I,et al.Lactobacillus kimchiisp. nov,a new species from kimchi[J].Int J Syst Evol Micr,2000,50(5): 1789-1795.
[6]唐爱明.乳酸菌降解肉制品中亚硝酸盐机理及菌株筛选研究[D].长沙:湖南农业大学硕士论文,2004:59-62.
[7]闫金星,许润博,陈萍,等.产亚硝酸盐还原酶的乳酸菌的筛选及诱变[J].吉林农业大学学报,2013,35(1):94-97.
[8]张庆芳,迟乃玉,郑燕,等.乳酸菌降解亚硝酸盐机理的研究[J].食品与发酵工业,2002,28(8):27-31.
[9]何婷婷.植物乳杆菌亚硝酸盐还原酶编码基因的研究[D].上海:上海师范大学硕士论文,2012.
[10]吕玉涛.产亚硝酸盐还原酶短乳杆菌发酵条件优化及酶的分离纯化研究[D].上海:上海师范大学硕士论文,2010.
[11]苏世彦.食品微生物检验手册[M].北京:中国轻工业出版社,1998.
[12]马蓓,刘伟,谢蓉蓉,等.乳酸菌扫描电镜制样方法及观察条件探究[J].内蒙古科技与经济,2012(2):116-119.
[13]马延岩.泡菜发酵过程中亚硝酸盐生成及降解机理研究[J].食品科技,2013,38(10):277-280.
[14]黄丽慧,张雁,陈于陇,等.发酵蔬菜中亚硝酸盐消长规律及调控技术的研究进展[J].食品科学,2013,34(5):303-307.
[15]中华人民共和国卫生部.GB/T 5009.33—2010食品中亚硝酸盐与硝酸盐的测定[S].北京:中国标准出版社,2010.
[16]刘绍.食品分析与检测[M].武汉:华中科技大学出版社,2011:127.
[17]赵国屏.生物信息学[M].北京:科学出版社,2003:101-111.
[18]王昌禄,隋志文,武晋海,等.亚硝酸盐降解菌的分离及其特性研究[J].中国酿造,2008,27(9):33-36.
[19]李春,韩建春,郑凯.乳酸菌混合生长降解亚硝酸盐能力的研究[J].工业微生物,2008,38(6):23-26.
Screening of nitrite reductase producingLactobacillus brevisL5 from fermented chili and its characteristic study
WANG Lan1,ZHAO Lingyan1,CHEN Sisi1,WANG Xueyan1,YOU Jing2,DENG Fangming1*
(1.College of Food Science and Technology,Hunan Agricultural University,Changsha 410128,China; 2.Dingcheng District Bureau of Quality and Technical Supervision,Changde 415100,China)
Ten lactic acid bacteria strains that can degrade nitrite were isolated from traditional fermented chili.One strain which had better ability of producing nitrite reductase were rescreened,namelyLactobacillus brevisL5,then single factor and orthogonal tests were adopted to study on its degradation characteristics.Results showed that the L5 had significant ability for degrading nitrite,and under normal culture condition,the nitrite degradation rate was 56.25%after 36 h fermentation.In controlling pH above 6.0,eliminating the acid degradation,the nitrite degradation rate was 66.42%,mainly as enzymatic degradation.The optimum conditions for nitrite degradation of the L5 was temperature 34℃,time 30 h,substrate concentration 120 mg/L and salt concentration 6%.In this condition,the nitrite degradation rate of the L5 was 82.84%.
fermented chili;nitrite;nitrite reductase;Lactobacillus brevisL5;characteristics
TS201.3
A
0254-5071(2014)11-0025-05
10.11882/j.issn.0254-5071.2014.11.006
2014-09-04
国家自然科学基金(31401675);教育部基金(SCX1211,14C0571)
王兰(1990-),女,硕士研究生,研究方向为食品科学。
*通讯作者:邓放明(1962-),男,教授,博士,研究方向为食品加工技术。
