Cu2+对酿酒酵母酒精发酵影响的研究进展
2014-02-23贾博战吉宬黄卫东
贾博,战吉宬,黄卫东
(中国农业大学食品科学与营养工程学院,北京100083)
Cu2+对酿酒酵母酒精发酵影响的研究进展
贾博,战吉宬,黄卫东*
(中国农业大学食品科学与营养工程学院,北京100083)
铜制剂农药应用历史悠久,可有效的防治葡萄霜霉、白粉等病害,在全球葡萄园中使用频繁和广泛。不合理使用铜制剂农药会引起葡萄果实的铜污染,升高葡萄汁的铜含量,进而影响酿酒酵母正常的酒精发酵,最终影响葡萄酒的品质。综述了Cu2+对酿酒酵母生长活性和酒精发酵影响的研究进展,并针对已取得的研究成果进行展望,旨在为Cu2+对酿酒酵母影响的深入研究提供参考。
Cu2+;酿酒酵母;生长活性;酒精发酵
铜制剂农药在全球应用广泛(如波尔多液[CuSO4· xCu(OH)2·yCa(OH)2·zH2O]),自问世以来,一直被广泛用于防治葡萄的霜霉、白粉等病害[1-2]。根据世界铜发展大会的统计结果,硫酸铜作为铜制剂农药的重要组成成分,全球每年的使用量可达到150 000 t。铜制剂农药被大剂量和无限制地使用,致使早在19世纪末期,某些地区葡萄园中的土壤富集了大量的铜,主要以二价阳离子形式存在[2]。由于铜既不会降解,又很少移动,进入环境后主要集中在土壤的耕作层,长期积累在土壤中的铜离子被植物的根吸收进入植物体内,使植物器官的含铜量增加,过量的铜会影响植物的正常生长[3]。铜污染跟铜制剂施用的方式方法有着直接的关系[4]。LA PERA L等[5]发现,在葡萄园中施用铜制剂(CuCl2·xCuO·4H2O)升高了葡萄果实的含铜量,从而直接导致发酵液中的铜含量增加。发酵过程中,长时间接触铜器具,也会增加发酵液中的含铜量[6]。当发酵液中Cu2+超过一定含量时,会影响酿酒酵母的正常生长和酒精发酵[7]。
酿酒酵母是葡萄酒酿造中的关键因子,抗铜性是筛选优良酿酒酵母的重要指标之一。因此,研究Cu2+对酿酒酵母生长、发酵性能的影响对解决葡萄酒生产中的铜问题有着十分重要的意义。本文就酵母对铜的吸收、转运以及铜对酵母生长和酒精发酵的影响进行了综述,并就Cu2+对酵母影响的研究提出了展望。
1 铜对酿酒酵母活性的影响
铜普遍存在于动物、植物和微生物体内,是维持生命体正常生长与代谢的重要微量元素,参与多种生命活动,其主要的生理功能表现在:它是许多酶和蛋白所必需的组分,其中包括有Cu/Zn超氧化物歧化酶、细胞色素氧化酶、酪氨酸酶、赖氨酰氧化酶和血浆铜蓝蛋白等[8-9]。许多参与氧化还原反应的蛋白质活性位点上的铜是有效的电子供体与受体,同时,许多具有氧化功能的酶,需要有铜存在时才有活性。但是铜过量时,就成了氧化还原反应的活泼因子,参与Fenton反应,产生有害的氢氧根离子,氢氧根离子会引起细胞膜脂质的过氧化、蛋白质的氧化以及DNA和RNA分子的解链,最终导致细胞的死亡[10]。
1.1 酿酒酵母对铜的吸收、转运、代谢及吸附
酵母细胞内的铜离子主要分布在细胞质、高尔基体、线粒体和液泡中。铜在自然界中多以二价形式存在。二价铜在被酵母吸收之前,首先由细胞质膜上FRE1和FRE2基因编码的铁还原酶(FRE1、FRE2)还原为一价铜离子。一价铜离子再通过高亲和(CTR1、CTR3)和低亲和(CTR2、FET4)转运系统进入细胞内部[11-12]。培养基中的铜可以调控CTR1、CTR2、CTR3的表达,低铜条件下,CTR1、CTR3表达加强。铜过量时,CTR1、CTR3表达受抑制,CTR1会出现降解[13],而CTR3不会[12]。FET4对包括铜、锌在内的其他金属离子,也具有吸收功能[14]。CTR2对胞内储备铜起一定的作用[15],CTR2不是铜转运所必需的,甚至在CTR1、CTR3双缺失的菌株中也不是必需的。MAC1起上调和下调以上基因的作用[16]。
铜离子在细胞内与特异的铜伴侣蛋白(copper chaperone protein)结合,再输送至各目标亚细胞器,铜伴侣蛋白可以降低铜在细胞内的毒性,现阶段,ATX1、COX17、LYS7三个铜伴侣蛋白的功能研究的较为清楚,ATX1将铜离子从细胞膜上的CTR1转运至分泌途径中位于后高尔基体囊泡的CCC2,最终运送至细胞表面的高亲和铁吸收蛋白FET3[17];通过COX17,铜离子最终到达线粒体细胞色素C氧化酶,其中,线粒体膜蛋白SCO1和COX11是COX17的靶蛋白,SCO1把COX17转运的Cu+插入到细胞色素C氧化酶的CuA位点,同时,COX11把COX17转运的Cu+插入细胞色素C氧化酶的CuB位点[18]。最新研究证明,除COX17之外,COX19和COX23也参与向线粒体转运铜[19];LYS7运送铜离子至铜锌超氧化物歧化酶(Cu/Zn-SOD),Cu/Zn-SOD穿过线粒体外膜,把Cu+运到线粒体膜间隙[20],整个吸收和转运铜的过程见图1。CUP1和CRS5是位于细胞质的金属硫蛋白,它们能与Cu+相互作用,把多余的Cu+运到液泡中,以消除铜对细胞的毒害,对于液泡膜铜转运蛋白的作用机理,现在尚不清楚[21]。
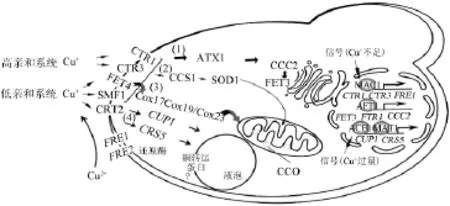
图1 酵母铜转运系统与转录调控示意图[21]Fig.1 Copper transporter system and transcriptional regulation in Saccharomyces cerevisiae
近几年来,关于酿酒酵母吸附去除重金属的研究越来越多[22]。MRVCIC J等[7]研究发现,在静置发酵条件下,经过8 h发酵,葡萄糖、蔗糖、糖浆培养基中的酿酒酵母Cu2+最大吸附量分别为1.16 mg/g、1.2 mg/g和0.81 mg/g,而固定摇床发酵条件,经过6 h发酵,葡萄糖、蔗糖、糖浆培养基中的Cu2+最大吸附量分别为0.98 mg/g、1.02 mg/g和0.7 mg/g,可见生长条件不同,酿酒酵母对Cu2+的吸附量也不同。酿酒酵母对Cu2+吸附的效果与pH有关,pH值为5.0~9.0时,可有效的去除重金属Cu2+浓度0.5 mmol/L;pH为6.5发酵时,酿酒酵母对Cu2+的吸附量为0.7 μmol/mg[18]。可见酵母可以大量吸附Cu2+,而吸附量受发酵环境的影响。
1.2 铜对酿酒酵母生长活性的影响
铜是维持微生物正常生命活动所必需的微量元素,GIORGIO A J等[24]研究证明,在铜缺乏的培养基中,酵母的生长受到了严重的阻碍。Cu2+还会影响酵母对其他金属的吸收,尤其是对铁的吸收,进而影响酵母的生长,酵母对Fe2+的吸收,需要FET3的参与,而FET3的活性需要Cu2+作为其编码的酶辅基[17]。低浓度的铜对酵母的生长有益,而高浓度的铜降低酵母的存活率,影响酵母的生长、数量、种类,碳、氮矿化以及群落的金属抗性[25]。杜君等[26]研究证明了铜对酵母生活力的影响与铜浓度有关,他们发现,0.05 mmol/L Cu2+对酿酒酵母BH8、AWRI、Freddo的生长基本没有影响,当Cu2+浓度达到1.0 mmol/L时,3株酿酒酵母的生长均受到了严重的抑制,并且,高铜逆境增加了酵母细胞呼吸缺陷型形成的频率。AVERY S V等[27]证明,当Cu2+浓度在5 μmol/L时,酿酒酵母NCYC-1383的生长活力就降低了,而EKUNDAYO E O等[28]从来自尼日利亚贝宁城啤酒厂的啤酒渣中,筛选出的啤酒酵母BY2与BY4分别能耐受3.5 mmol/L和4.2 mmol/L的Cu2+浓度。可见,Cu2+对酵母的影响在酵母菌株之间存在很大的差异性。
2 铜对酿酒酵母发酵影响的研究

图2 酒精生物合成途径Fig.2 Ethanol biosynthesis pathway
由图2可知,酒精发酵主要由酵母菌在厌氧条件下通过糖酵解(embden-meyerhof-parnas pathway)途径,将葡萄糖降解为丙酮酸,然后在丙酮酸脱羧酶(pyruvate carboxylase)的作用下,将丙酮酸脱羧形成乙醛,乙醛在乙醇脱氢酶(alcohol dehydrogenase)的作用下生成乙醇[29]。
过量的铜以离子形式进入发酵液时,可能会造成发酵的停滞或延迟[30-31]。有研究比较了Cu2+逆境对模拟葡萄汁培养基和真实酿酒葡萄汁培养基中酵母发酵行为的影响,结果发现,0.05 mmol/L Cu2+严重抑制了模拟葡萄汁的发酵过程,其产生CO2和酒精的量较对照组显著降低,而残糖量显著增多;0.05 mmol/L Cu2+对赤霞珠葡萄汁发酵过程基本没有影响。0.50 mmol/L Cu2+几乎完全抑制了模拟葡萄汁的发酵过程,只是在一定程度上影响了赤霞珠葡萄汁发酵过程中CO2、酒精的产量以及对还原糖的利用率,但与对照组没有显著差异[32]。铜离子不仅影响发酵产物,还影响发酵副产物,FERREIRA J等[33]研究了Cu2+对VIN13、NT112、RJ11、D80、CC和NT50六株菌发酵力的影响和Cu2+对这六株菌发酵过程中的挥发酸生成量的影响。结果表明,在0.25 mmol/L Cu2+浓度条件下,菌株NT50、CC、D80的发酵力基本不受影响,而株菌VIN13、NT112和RJ11发酵完成后,发酵液中残留了更多的葡萄糖和果糖,同时,六株菌发酵的挥发酸生成量均增加,其中,菌株RJ11和NT50的增加量最为显著。Cu2+对酒精发酵的影响因菌株不同而异,有的菌株在Cu2+存在时发酵产生的酒精较对照减少[34],而有的菌株酒精生成量却较对照增加[35]。BRANDOLINI V等[36]研究了铜敏感型酿酒酵母SN9和抗铜型SN41,分别在添加32 mg/L和320 mg/L硫酸铜条件下的发酵过程。结果发现,铜敏感型菌株发酵活性在低Cu2+浓度条件下即受影响,高Cu2+浓度时,发酵完全被抑制,而抗铜菌株的发酵活力几乎不受Cu2+影响,原因是抗铜酵母的细胞可以吸附大量的Cu2+,抗铜酵母细胞吸附Cu2+后是否影响发酵过程及产物还有待于进一步研究。
可见,Cu2+通过影响酵母活力,干扰其正常的生理代谢,进而影响整个发酵过程。同时,过量的Cu2+加速了葡萄酒中多酚类物质的氧化速率[37],最终导致葡萄酒的品质下降。Cu2+对酵母发酵的影响在不同菌株之间以及不同发酵介质之间都存在显著的差异性。对于铜离子如何影响酵母代谢的分子机制尚不清楚,有待于进一步的深入研究。
3 总结与展望
不合理使用铜制剂农药会引起葡萄果实的铜污染,升高葡萄汁的铜含量,进而影响酿酒酵母正常的酒精发酵。Cu2+对酵母生长的影响在不同菌种之间存在差异性。Cu2+影响酵母酒精发酵在不同发酵介质之间也存在一定的差异性。当发酵液中的铜离子浓度过高时,会严重抑制酵母的生长和酒精发酵。而所查阅到的文献研究都主要集中在Cu2+对酵母细胞活性以及发酵基本特性的影响,未见从分子层面揭示Cu2+影响酵母细胞代谢的机制;真实葡萄汁中的成分复杂,如一些具有生物活性的大分子物质(花色苷、类黄酮类),可能会对酵母细胞抗铜具有一定的作用,同时,筛选抗铜菌株或者通过分子技术改造酵母获取抗铜酵母,这些方面都是值得进一步研究和探讨的领域。
[1]BOUBALS D.Copper in the control of grapes in France[J].Vignevini, 2001,28(5):45-47.
[2]CALISIR F,AKMAN S.Survey of lead and copper in Turkish raisins[J]. Food Addit Contam,2007,9(24):960-968.
[3]蔡道基,单正军,朱忠林,等.铜制剂农药对生态环境影响研究[J].农药学学报,2001(1):61-68.
[4]GARCÌA-ESPARZA M A,CAPRI E,PIRZADEH P,et al.Copper content of grape and wine from Italian farms[J].Food Addit Contam,2006, 23(3):274-280.
[5]LA PERA L,DUGO G,RANDO R,et al.Statistical study of the influence of fungicide treatments(mancozeb,zoxamide and copper oxychloride)on heavy metal concentrations in Sicilian red wine[J].Food Addit Contam,2008,3(25):302-313.
[7]MRVCIC J,STANZER D,STEHLIK-TOMAS,SKEVIN D,et al.Optimization of bioprocess for production of copper-enriched biomass of industriallyimportantmicroorganismSaccharomycescerevisiae[J].J Biosci Bioeng,2007,103(4):331-337.
[8]ARREDONDO M,NUNEZ M T.Iron and copper metabolism[J].Mol Aspects Med,2005 26:313-327.
[9]TAPIERO H,TOWNSEND DM,TEW K D.Trace elements in human physiology and pathology.Copper[J].Biomed Pharmacother,2003,57 (9):386-398.
[10]GAETKE L M,CHOW C K.Copper toxicity,oxidative stress,and antioxidant nutrients[J].Toxicology,2003,189(1-2):147-163.
[11]EIDE D J.The molecular biology of metal ion transport inSaccharomyces cerevisiae[J].Ann Rev Nutri,1998,18:441-469.
[12]PENA M M,PUIG S,Thiele D J.Characterization of theSaccharomyces cerevisiaehigh affinity copper transporter Ctr3[J].J Biol Chem,2000, 275(43):33244-33251.
[13]OOI C E,RABINOVICH E,DANCIS A,et al.Copper-dependent degradation of theSaccharomyces cerevisiaeplasma membrane copper transporter Ctr1p in the apparent absence of endocytosis[J].Embo J,1996, 15(14),3515-3523.
[14]HASSETT R,DIX D R,EIDE D J.The Fe(II)permease Fet4p functions as a low affinity copper transporter and supports normal copper trafficking inSaccharomyces cerevisiae[J].Biochem J,2000,351(2):477-484.
[15]REES E M,THIELE D J.Identification of a vacuole-associated metalloreductase and its role in Ctr2-mediated intracellular copper mobiliza-tion[J].J Biol Chem,2007,282(30):21629-21638.
[16]LABBE S,ZHU Z W,THIELE D J.Copper-specific transcriptional repression of yeast genes encoding critical components in the copper transport pathway[J].J Biol Chem,1997,272(25):15951-15958.
[17]LIN S J,PUFAHL R A,DANCIS A,et al.A role for theSaccharomyces cerevisiaeATX1 gene in copper trafficking and iron transport[J].J Biol Chem,1997,272(14):9215-9220.
[18]GLERUM D M,SHTANKO A.Characterization ofCox17,a yeast gene involved in copper metabolism and assembly of cytochrome oxidase[J]. J Biol Chem,1996,271(24):14504-14509.
[19]COBINE P A,PIERREL F,WINGE D R.Copper trafficking to the mitochondrion and assembly of copper metalloenzymes[J].Biochim Biophys Acta,2006,1763(7):759-772.
[20]WONG P C,WAQQONER D,SUBRAMANIAM J R.,et al.Copper chaperone for superoxide dismutase is essential to activate mammalian Cu/Zn superoxide dismutase[J].P Natl Acad Sci,2000,97(6):2886-2891.
[21]房茜,李鹏,靳思,等.酵母和植物中铜的转运系统及其调控[J].植物学通报,2007,24(6):807-815.
[22]NAJA G M,MURPHY V,VOLESKY B.Encyclopedia of industrial biotechnology:bioprocess,bioseparation,and cell technology[M].New York:John Wiley&Sons Inc,2010.
[23]BRADY D,DUNCAN J R.Bioaccumulation of metal cations bySaccharomyces cerevisiae[J].Appl Microbiol Biotechnol,1994,41(1): 149-154.
[24]GIORGIO A J,CARTWRIGHT G E,WINTROBE M M.Preparation of a copper-deficient medium for yeast growth[J].J Bacteriol,1963,86: 1037-1040.
[25]易秀.铜对生物有机体的毒性及抗性机理[J].农业环境保护,1997,16(4):187-189.
[26]杜君,李海兰,李慧,等.铜对葡萄酒酿酒酵母生长活性的影响[J].酿酒科技,2010(6):28-31.
[27]AVERY S V,HOWLETT N G,RADICE S.Copper toxicity towards Saccharomyces cerevisiae:dependence on plasma membrane fatty acid composition[J].Appl Environ Microbiol,1996,62(11):3960-3966.
[28]EKUNDAYO E O,OBUEKWE C O.The relationship between soil copper content and copper resistance in yeast of an ultisol in midwestern Nigeria[J].Plant Foods Hum Nutr,1998,53(2):175-181.
[29]吴素萍.酶解玉米淀粉发酵酒精工艺条件的研究明[J].酿酒科技,2007(11):45-47.
[30]CASSIGNARD R.Influence des produits de traitement de la vigne sur la flore microbienne des fermentations et les caractères organoleptiques des vins[J].Vignes et Vins,1975,245:9-15.
[31]SALA C,FORT F,BUSTO O,et al.Fate of some common pesticides during vinification process[J].J Agr Food Chem,1996,44(11):3668-3671.
[32]杜君,李海兰,李慧,等.铜离子逆境对葡萄汁中酿酒酵母的影响[J].中国农业科学,2010,43(15):3259-3265.
[33]FERREIRA J,DUTOITM G,DUTOIT W J.The effects of copper and highsugarconcentrationsongrowth,fermentation efficiencyand volatile acidity production of different commercial wine yeast strains[J].Aust J Grape Wine Res,2006,12(1):50-56.
[34]RUZIC N E.Effect of copper and zinc content in grape must on higher alcohols in wine[J].Acta Periodica Technologica,2000,31:239-246.
[35]STEHLIK-TOMAS V,ZETIC V G,STANZER D,et al.Zinc,copper and manganese enrichment in yeastSaccharomyces cerevisiae[J].Food Technol Biotechnol,2004,42(2):115-120.
[36]BRANDOLINI V,TEDESCHI P,CAPECE A,et al.Saccharomyces cerevisiaewine strains differing in copper resistance exhibit different capability to reduce copper content in wine[J].World J Microbiol Biotechnol,2002,18(6):499-503.
[37]DANILEWICZ J C.Interaction of sulfur dioxide,polyphenols,and oxygen in a wine-model system:central role of iron and copper[J].Am J Enol Viticult,2007,58(1):53-60.
Research advances in effect of Cu2+onSaccharomyces cerevisiaealcoholic fermentation
JIA Bo,ZHAN Jicheng,HUANG Weidong*
(College of Food Science&Nutritional Engineering,China Agricultural University,Beijing 100083,China)
Copper-based fungicides application has a long history,which can effectively control grape downy mildew,powdery mildew and other diseases,and it were used frequently and extensively in the vineyards around the world.Irrational use of copper-based fungicides can cause copper contamination on grapes.The increasing copper content in grape juice can affect the normal alcoholic fermentation ofSaccharomyces cerevisiae,and ultimately affect the quality of wine.The purpose of this paper is to provide a comprehensive overview on the effect of Cu2+on the viability and alcoholic fermentation ofS.cerevisiae,and to describe its future prospects of the former studies,aiming to provide a reference for deeper study of the effect of Cu2+onS.cerevisiae.
Cu2+;Saccharomyces cerevisiae;growth viability;alcoholic fermentation
Q939.97
A
0254-5071(2014)11-0006-04
10.11882/j.issn.0254-5071.2014.11.002
2014-09-09
国家十二五科技支撑计划(2012BAD31B07);国家自然科学基金(31471835);北京市科技计划(D131100000513003)
贾博(1981-),男,博士,研究方向为葡萄酒微生物。
*通讯作者:黄卫东(1961-),男,硕士,教授,研究方向为酵母次生代谢生理和葡萄次生代谢与调控。
