酸浆宿萼中酸浆苦素抑菌稳定性的研究
2014-02-13王英臣
王英臣
(吉林农业科技学院,酿造技术吉林省高等学校工程研究中心,吉林 吉林 132101)
酸浆(Physalis alkekengiL.var.franchetii)别名红姑娘、灯笼草、挂金灯、锦灯笼等,为茄科酸浆属多年生草本,广泛分布于内蒙和东北等地区[1]。我国最早的医药著作《神农本草经》就已经将酸浆收录在内,《中华人民共和国药典》也有收录。 其药用部位为干燥宿萼或带果实的宿萼,性味苦、寒,归肺经。具清热解毒、利咽、化痰、利尿之功效[2]。果实和果萼二者都具有药食两用价值。果实还可以制造罐头、果酒、果汁等,在加工果实过程中,通常剔除果籽,因此产生大量副产物果籽而没有被有效利用。果籽淡黄色呈肾脏形,扁平,长约1.5~2.0 mm,每个果实中含果籽210~320粒,不规则的散布在果实。有关果实和宿萼方面的研究有一些报道[3-6]。
研究表明酸浆的煎剂对宋氏杆菌有抑制作用[7],对淋球菌中度敏感[8];酸浆中提取的油状液在试管内对绿脓杆菌、金黄色葡萄球菌有抑制作用[7];从酸浆中提取的针状晶母液对金黄色葡萄球菌有抑制作用[8];酸浆的氯仿提取物具有抗分枝杆菌的作用,实验表明,它们对结核分枝杆菌、堪萨斯分枝杆菌、细胞内分枝杆菌等5种分枝杆菌均有抑制作用[9]。
酸浆主要的生理功能物质是酸浆苦素,酸浆苦素类化合物是酸浆属植物的甾体类成分,也是酸浆属植物的主要药用成分。它们的基本结构是被修饰过的麦角甾烷星骨架,该类物质被鉴定为16,24-环-13,14-断甾体化合物[10-13]。其结构分为酸浆苦素Ⅰ和酸浆苦素Ⅱ,已经明确其分子结构和生理功能[14-19]。因为其多氧结构的存在,在睡茄交脂甾体化合物中,酸浆苦素类化合物属于在生源氧化水平上最高级的一组。药理实验表明,酸浆苦素类化合物具有体外抗肿瘤细胞的活性和体内抗肿瘤的活性,以及抗菌、强心等生物活性[20-22]。
根据酸浆苦素如此显著的消炎抗菌作用,本实验研究其在抑菌方面的作用及其在使用过程中的稳定性问题,以期为酸浆苦素在食品防腐中应用研究增加新内容。
1 材料与方法
1.1 材料与试剂
酸浆采购于吉林市左家镇山区。
金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bascillus subtilis)、大肠杆菌(Escherichia coli)、蜡样芽孢杆菌(Bacillus cereus)、青霉(Penicilliumsp.)、黑曲霉(Aspergillus niger)、纯黄丝衣霉(Byssochlamys fulva)、灰绿曲霉(Aspergullus glaucus)、匍匐曲霉(Fungi imper ficti)、白地霉(Geotrichum candidumLink)、酿酒酵母(Saccharomyces cerevisiae)、罗氏酵母(Saccharomyces rosei)和汉氏德巴利氏酵母(Debaryomyces),以上菌种均由吉林农业科技学院微生物实验室提供。
细菌琼脂培养基:牛肉膏3 g、蛋白胨10 g、NaCl 5 g、琼脂15~20 g、水1 000 mL,pH 7.0~7.2;霉菌琼脂培养基:马铃薯(切碎成块)200 g、葡萄糖20 g、琼脂15~20 g、水1 000 mL;酵母菌琼脂培养基:葡萄糖20 g、蛋白胨10 g、酵母膏10 g、琼脂5~20 g、水1 000 mL[18]。
1.2 方法
1.2.1 酸浆苦素提取[19]
酸浆植株地上部分经干燥得83.56 g,加3倍氯仿在室温下浸提。氯仿粗提物用硅胶柱进行分离。采用乙烷-乙酸乙酯从体积比85∶15至3∶7比例洗脱,得到Al-29(428 mg)进一步用氯仿-甲醇以体积比98∶2至8∶2梯度洗脱,最后用甲醇全部洗脱下来,得到Al-29-12(173 mg)部分。
1.2.2 抗菌效力的测定[23-25]
将提取的酸浆苦素溶于二甲基亚砜,制成50 mg/mL酸浆苦素溶液。将6 mm的圆形滤纸片灭菌后放入配制好的酸浆苦素溶液中浸泡10 min、晾干。配制细菌(金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、蜡样芽孢杆菌)、霉菌(青霉、黑曲霉、纯黄丝衣霉、灰绿曲霉、匍匐曲霉、灰绿曲霉、白地霉)、酵母菌(酿酒酵母、罗氏酵母、汉氏德巴利氏酵母)固体培养基。在无菌条件下,用移液枪准确取0.5 mL、1×106CFU/mL菌悬液均匀涂布于平板上,将3片浸泡过的圆形滤纸片,间隔贴在含菌平板上,然后将各平皿分别置于恒温培养箱中进行培养,测定抑菌圈直径,取平均值。以二甲基亚砜作为阴性对照,以6%苯甲酸钠作为阳性对照,以无菌水为空白对照检测酸浆苦素的抑菌性。
1.2.3 最小抑菌浓度(minimum inhibitory concentration,MIC)的测定
将活化后的菌种用无菌生理盐水稀释,配制成106CFU/mL的菌液。用无菌水把酸浆苦素提取物连续稀释,使其质量浓度为4 000、2 000、1 000、500、250、125、62.5、31.3、15.6 μg/mL,再将配制好的营养琼脂培养基经高压蒸汽灭菌冷却至40~50 ℃后,与稀释液按体积比10∶1的比例混合,待其凝固,吸取40 μL菌悬液涂布于培养基表面,生化培养箱中,37 ℃条件下培养16 h。观察没有菌落生长的培养皿为酸浆苦素提取物的MIC,每个样品设3个重复,并以无菌水、二甲基亚砜、6%苯甲酸钠为对照。
1.2.4 酸浆苦素抑菌稳定特性研究
将纯化的供试菌在营养琼脂斜面培养基上划线,再挑取菌落接种到相应的液体培养基内,适宜温度下培养,使菌数达105~107CFU/mL,作为供试菌液[21]。
在试管中加入相同体积液体营养培养基,灭菌,冷却后在超净工作台上无菌操作接入0.1 mL供试菌液,再加入处理后的酸浆苦素液1 mL,摇匀后37 ℃培养12 h。利用紫外-可见分光光度计,在600 nm波长处测定其吸光度A1,分别测定3次,并取其平均值。对照组加未经处理的酸浆苦素液,同样条件下培养测定吸光度A0,并取其平均值[22]。

式中:A1为在600 nm波长处测定的各个吸光度;A0为对照组吸光度。
菌悬液吸光度与抗菌率成反比,即菌悬液吸光度越小,对应酶解液抗菌率越大,抗菌效果越好。
1.2.4.1 pH值对酸浆苦味素抑菌稳定性的影响
取酸浆苦味素0.5 mg,置于10 mL具塞试管中,分别加入pH 2、3、4、5、6、7、8、9、10、12的水溶液(0.1 mol/L HCl或NaOH调节pH值)5 mL,溶解,摇匀。置室温放置12 h,每隔2 h取样,用适当溶液补足取样量,分别取样按1.2.4节方法测定吸光度。
1.2.4.2 温度对酸桨苦味素抑菌稳定性的影响
取酸浆苦味素3份,各0.5 mg,置10 mL具塞试管中,分别加入pH 7.0的水溶液各5 mL,溶解,摇匀。分别置不同温度水浴中(25~95 ℃)加热12 h,每隔2 h取样,置冰浴中,用pH 7.0的水溶液补足取样量,分别取样按1.2.4节方法测定吸光度。
1.2.4.3 光照对酸桨苦味素抑菌稳定性的影响
取酸浆苦味素2份,各0.5 mg,置10 mL量瓶中,用pH 7.0的30%甲醇-水溶液适量溶解,并稀释至刻度,摇匀,称质量。置紫外光下照射12 h,每隔2 h取样,称质量,分别用适当水溶液补足减失重量;另一份密封置自然光下照射10 d(每天照射10 h),每天取样,用适当溶液补足取样量,分别取样,按1.2.4节方法测定吸光度。
2 结果与分析
2.1 酸浆苦素的抑菌稳定性
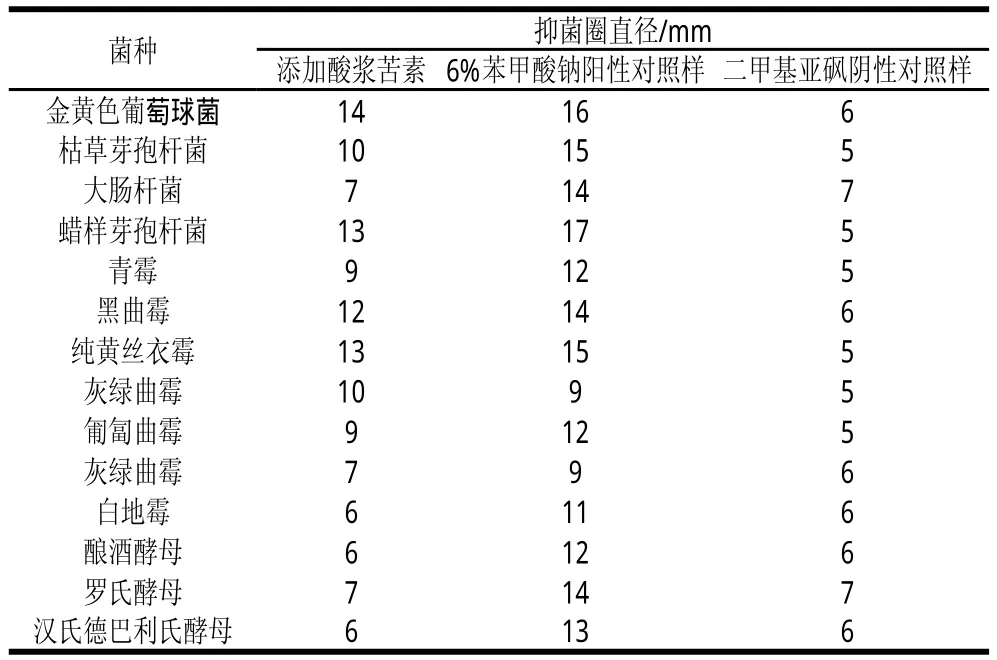
表1 酸浆苦素对常见菌的抑制作用(n=3)Table 1 Inhibitory effects of physalins from Calyx seu Fructus Physaliiss against common spoilage and pathogenic microbes (n=3)
当添加酸浆苦素抑菌圈直径与二甲基亚砜阴性对照样抑菌圈直径差值大于3 mm时,认定具有抑菌效果。由表1可知,对比阳性和阴性对照样,可以判断出酸浆苦素对金黄色葡萄球菌、枯草芽孢杆菌、蜡样芽孢杆菌、青霉、黑曲霉、纯黄丝衣霉、灰绿曲霉、匍匐曲霉均有一定的抑制作用,其中对于革兰氏阳性菌的抑菌效果较明显,对部分霉菌有抑制效果,对酵母菌无抑菌效果。
2.2 酸浆苦素MIC的确定

表2 酸浆苦素的MICTable 2 MIC values of physalins from Calyx seu Fructus Physaliss
由表2 可知,酸浆苦素对细菌中革兰氏阳性菌的抑制效果较好,其次是霉菌。对于金黄色葡萄球菌的MIC为31.3 μg/mL,对于霉菌中纯黄丝衣霉的MIC为62.5 μg/mL;对于酵母菌无抑制效果。
2.3 酸 浆苦素的抑菌稳定性
2.3.1 温度对酸浆苦素抑菌效力稳定性的影响

图1 温度对酸浆苦素抑菌效力稳定性的影响Fig.1 Influence of temperature of the antimicrobial activity of physalins from Calyx seu Fructus Physalis
由图1可知,酸浆苦素在20~35 ℃时抑菌活性最强,当逐渐升高温度至95 ℃时,酸浆苦素的抑菌活力有一定程度的下降,但是下降幅度不大,因此判断,酸浆苦素最适抑菌温度为20~35 ℃;40~95 ℃期间,酸浆苦素稳定性较好,对微生物抑制效果显著。
2.3.2 pH值对酸浆苦素抑菌 效力稳定性的影响

图2 pH值对酸浆苦素抑菌效力稳定性的影响Fig.2 Influence of pH on the antimicrobial activity of physalins from Calyx seu Fructus Physalis
由图2可知,锦灯笼药材中的酸浆苦素在酸性、中性、弱碱性溶液中均具有较好的抑菌性。而在pH 12的溶液中,酸浆苦素抑菌性大幅度降低,说明强碱性环境会迅速破坏酸浆苦素。应该保存在酸性或中性环境中。
2.3.3 紫外线对酸浆苦素稳定性影响

表3 紫外线照射对酸浆苦素抑菌效力的影响Table 3 Influence of visible and UV illumination on the antimicrobial activity of physalins from Calyx seu Fructus Physalis
由表3可知,可见光和紫外线对酸浆苦素抑菌效果影响不明显。
3 结 论
酸浆苦素对8种菌均有一定的抑制作用,其中对于细菌中的革兰氏阳性菌的抑菌效果较明显,对部分霉菌有抑制效果,对酵母菌无抑菌效果;同时,MIC值实验表明,对于金黄色葡萄球菌的MIC为31.3 μg/mL,对于霉菌中纯黄丝衣霉的MIC为62.5 μg/mL;对于酵母菌无抑制效果。稳定性实验表明pH值对酸浆苦素抑菌效力有一定影响,其在20~35 ℃时抑菌活性最强,逐渐升高温度至95 ℃,酸浆苦素的抑菌活力有一定程度的下降,但是下降幅度不大,因此判断,酸浆苦素最适抑菌温度为20~35 ℃;40~95 ℃期间,酸浆苦素稳定性较好,对微生物抑制效果显著。酸浆苦素在酸性、中性、弱碱性溶液中均较为稳定。而在pH 12的溶液中,酸浆苦素抑菌性大幅度降低,说明强碱性环境会迅速破坏酸浆苦素。应该保存在酸性或中性环境中。可见光和紫外线对其抑菌效果影响不明显。
[1]唐庭棣.大兴安岭药用资源[M].哈尔滨: 哈尔滨出版社, 2001: 121.
[2]国家药典委员会.中华人民共和国药典(一部)[M].北京: 化学工业出版社, 2000: 296.
[3]周小平, 杨晓虹, 李立贤.酸浆果实与宿萼无机元素的比较分析[J].白求恩医科大学学报, 2001, 27(4): 363-364.
[4]李静, 李娟, 李德坤.锦灯笼化学成分的研究(Ⅰ) [J].中草药, 2002,33(8): 692-694.
[5]王和平, 徐美术, 孙亮, 等.锦灯笼降血糖作用的实验研究[J].中医药信息, 2004, 21(1): 53-54.
[6]韩阳花.酸浆有效成分的初步研究[D].乌鲁木齐: 新疆大学, 2005
[7]李德坤.锦灯笼化学成分的研究[D].吉林: 吉林大学, 2001.
[8]袁昌衡, 周启贵, 杨飞中.80种中药水煎液对淋球菌的抑制试验[J].国医院药学杂志, 1997, 17(11): 508-509.
[9]PIETRO R C, KASHIMA S, SATO D N, et al.in vitroantimycobacterial activities ofPhysalisangulataL.[J].Phytomedicine,2000, 7(4): 335-338.
[10]QIU Li, ZHAO Feng, JIANG Zhihu, et al.Steroids and flavonoids fromPhysalis alkekengivar.franchetiiand their inhibitory effects on nitric oxide production[J].Journal of Natural Products, 2008, 71(4):642-646.
[11]CHOI J Y, LEE S J, PARK S, et al.Analysis and tentative structure elucidation of new anthocyanins in fruit peel ofVitis coignetiae pulliat(meoru) using LC-MS/MS: contribution to the overall antioxidant activity[J].Journal of Separation Science, 2010, 33(9): 1192-1197.
[12]国家药典委员会编.中华人民共和国药典(一部)[M].北京: 中国医药科技出版社, 2010: 337-338.
[13]DONG Xue, LIU Yuqiang, CAI Qian.RP-HPLC determination of physalin P inPhysalis alkekengiL.var.franchetii(Msst.) Makino[J].Chinese Traditional Patent Medicine, 2009, 31 (1): 1304-1306.
[14]LONG Qifu, LI Xiangyang, BAI Yun.Fingerprinting analysis of extracts ofPhysalis alkekengiL.var.franchetii(Msst.) Makino[J].Chinese Traditional Patent Medicine, 2010, 32 (1): 179-181.
[15]KANG H, KWON S R, CHOI H Y.Inhibitory effect ofPhysalis alkekengiL.var.franchetiiextract and its chloroform fraction on LPS or LPS/IFN-γ-stimulated inflammatory response in peritoneal macrophages[J].Journal of Ethnopharmacology, 2011, 135(1): 95-101.
[16]ZHENG Yunliang, CHEN Yong, REN Yiping, et al.Quantitative and transformation products analysis of major active physalins fromPhysalis alkekengivar.franchetii(Chinese lantern) using ultraperformance liquid chromatography with electrospray ionization tandem mass spectrometry and time-of-flight mass spectrometry[J].Phytochemical Analysis, 2012, 23(10): 337-344.
[17]ZHENG Yunliang, CHEN Yong, REN Yiping, et al.An ultra-pressure liquid chromatography with tandem mass spectrometry method for the simultaneous determination of three physalins in rat plasma and its application to pharmacokinetic study ofPhysalis alkekengivar.franchetii(Chinese lantern) in rats[J].Journal of Pharmaceutical and Biomedical Analysis, 2012, 9 (12): 94-101.
[18]SOARES M B, BELLINTANI M C, RIBEIRO I M, et al.Inhibition of macrophage activation and lipopolysaccaride-induced death by secosteroids purified fromPhysalis angulataL.[J].European Journal of Pharmacology, 2003, 459: 107-112.
[19]GARY A S.Rainforest endophytes and bioactive products[J].Critical Reviews in Biotechnology, 2002, 22(4): 315-333.
[20]CHOI J Y, LEE S J, LEE S J, et al.Analysis and tentative structure elucidation of new anthocyanins in fruit peel ofVitis coignetiae pulliat(meoru) using LC-MS/MS: contribution to the overall antioxidant activity[J].Journal of Separation Science, 2010, 33(9): 1192-1197.
[21]SHI Peiying, HE Qing, SONG Yue, et al.Characterization and identification of isomeric flavonoidO-diglycosides from genus citrus in negative electrospray ionization by ion trap mass spectrometry and time-of-flight mass spectrometry[J].Analytica Chimica Acta, 2007,598(1): 110-118.
[22]JIN Yu, LIANG Tu, FU Qing, et al.Fingerprint analysis ofLigusticumchuanxiong using hydrophilic interaction chromatography and reversed-phase liquid chromatography[J].Journal of Chromatography A, 2009, 1216 (11): 2136-2141.
[23]文才艺, 吴元华, 田秀玲.植物内生菌研究进展及其存在的问题[J].生态学志, 2004, 23(2): 86-91.
[24]邹文欣, 谭仁祥.植物内生菌研究新进展[J].植物学报, 2001, 43(9):881-892.
[25]王钦德, 杨坚.食品试验设计与统计分析基础[M].北京: 中国农业大学出版社, 2009: 428-435.
