虾夷扇贝(Patinopecten yessoensis)外套膜蛋白的分离提取及功能特性
2014-02-13梁姗姗刘俊荣马永生闫瑞霞
梁姗姗,刘俊荣,马永生,吴 忠,闫瑞霞,李 芳
(大连海洋大学食品科学与工程学院,辽宁 大连 116023)
贝类在中国渔业经济活动中占有非常重要的地位,2007年底我国启动了一项“农业产业技术体系建设”的科技支撑项目,贝类被纳入其中[1]。2010年,全国海水贝类总产量达1 224.2万 t,占水产品总产量的22.8%[2],其中虾夷扇贝(Patinopecten yessoensis)是我国北方的主要养殖经济贝类之一。扇贝外套膜占扇贝总质量的8%左右[3],是扇贝加工过程中产生的副产物。扇贝外套膜中含有大量的泥沙,极难去除,因为个体较小,加工比较困难,费时费力,因此直接加工制成的食用产品价格偏高,外观和口感都较差,一直不被消费者所接受。只有少部分作为动物饲料低价出售,造成资源的浪费。
扇贝外套膜中含有丰富的营养物质,其中蛋白质的含量很高,是一种很有价值的蛋白质源[4]。近年来,国内外学者对扇贝外套膜生理活性物质的提取研究较多,研究发现扇贝外套膜的提取物具有降血脂、抗病毒、抗衰老等多种生理功能[5-6],但从食用角度出发,对其蛋白质进行分离提取的研究较少。本研究以扇贝外套膜为原料,通过等电点絮凝法提取外套膜分离蛋白,以便进一步开发功能性食品蛋白质配料,进而为扇贝外套膜高附加值的开发应用探索新途径。
1 材料与方法
1.1 材料与试剂
鲜活的虾夷扇贝购自大连长兴水产品市场,将新鲜原料去壳,取出扇贝柱,然后将扇贝全边中的消化腺、生殖腺除去,用清水冲洗干净,沥干即得虾夷扇贝外套膜。封装标记后置于冰箱中-20 ℃冻存备用。
氢氧化钠 天津市科密欧化学试剂有限公司;盐酸北京北化精细化学品有限责任公司;硫酸铜 沈阳联邦试剂厂;硫酸钾 天津博迪化工股份有限公司;乙醚天津市津东天正精细化学试剂厂;十二烷基磺酸钠、考马斯亮蓝R-250、甘氨酸、三羟甲基氨基甲烷(Tris)北京索莱宝科技有限公司。
1.2 仪器与设备
GL-21M高速冷冻离心机 湖南湘仪实验仪器开发有限公司;721型分光光度计 上海光谱仪器有限公司;MV-Ⅲ垂直平板电泳槽 大连竞迈生物科技有限公司;CR-410色彩色差仪 柯尼卡美能达投资有限公司;FJ-200高速分散均质机 上海标本模型厂。
1.3 方法
1.3.1 蛋白质的溶解与回收
冷冻虾夷扇贝外套膜置于室温下解冻,在半解冻状态下切碎后称取200 g,按1∶9(m/V)的比例加入去离子水,搅拌均匀后倒入匀浆机中匀浆2 min。浆液温度保持在10 ℃以下。匀浆液分装22份,每份50 mL,以0.5个pH值为梯度,一部分用2 mol/L HCl依次调节pH 1.5(酸处理),另一部分用2 mol/L NaOH依次调节pH值到12.0(碱处理)。用高速冷冻离心机4 ℃、9 000 r/min离心20 min,取中层清液,用2 mol/L HCl或2 mol/L NaOH调节虾夷扇贝外套膜溶出物至等电点沉淀蛋白质,4 ℃、9 000 r/min离心20 min,得到分离蛋白和未回收溶出物。
1.3.2 理化指标测定
水分测定采用GB/T5009.3—2003《食品中水分的测定》直接干燥法;粗脂肪测定采用GB/T5009.6—2003《食品中脂肪的测定》索氏抽提法;粗蛋白的测定采用GB/T5009.5—2003《食品中蛋白质的测定》微量凯氏定氮法;灰分的测定采用GB/T5009.4—2003《食品中灰分的测定》灼烧称质量法。
1.3.3 蛋白质溶解度和回收率的测定
采用双缩脲法测定总蛋白及上层清液中蛋白质的含量[7],用721型分光光度计在波长540 nm测定其吸光度。蛋白质溶解度与回收率的计算公式参见傅润泽等[8]的方法。
以0.5个pH值为梯度测定扇贝蛋白在pH值1.5~12.0范围的蛋白质溶解度和回收率,计算公式如式(1)、(2)所示。

式中:m1为第1次离心中层清液蛋白质质量/g;m2为第2次离心上清液蛋白质质量/g;m3为总蛋白质质量/g。
1.3.4 蛋白质分子质量分析
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)对酸碱提取过程中各部分的蛋白质组成进行分析。选取pH 1.5、12.0两个pH值点。分析的样品包括匀浆液、分离蛋白、未溶解沉淀物及未回收溶出物。样品与4×SDS样品缓冲液以3∶1的体积比混合,加入5%的β-巯基乙醇,在95 ℃条件下水浴10 min,在5%浓缩胶、12%分离胶下进行电泳。电泳胶用考马斯亮蓝R250染色,脱色液脱色。
1.3.5 蛋白质功能特性
蛋白质的持水性测定方法为[9],称取0.5 g样品(m)置于已知质量的离心管(m1)中,加入20 mL蒸馏水。在室温下搅拌,使蛋白质溶液成浆状;静置30 min后,在3 000 r/min离心20 min;弃去上清液,再次称量离心管(m2),按照公式(3)计算持水性。

蛋白质持油性的测定方法为[10]:称取0.5 g样品(m)置于已知质量(m1)的离心管中,加入10 mL大豆油,搅拌混合物使其均匀,静置30 min后,在3 000 r/min下离心20 min,弃去上清液,再次称离心管质量(m2),按照公式(4)计算持油性。

蛋白质的起泡性和泡沫稳定性的测定方法为[11]:将测试蛋白配制成5 g/100 mL的水悬液,取30 mL放入100 mL离心管中,用高速均质机均质2 min,立即记录此时溶液上部泡沫体积,静置30 min后,再次记录其泡沫体积。按照公式(5)、(6)计算起泡性和泡沫稳定性。

乳化性和乳化稳定性的测定采用浊度法[12]。配制1 g/100 mL的蛋白液,取5 mL大豆油与15 mL待测溶液于均质机中均质2 min,分别于0、10 min时从底部取50 μL,用0.1%SDS稀释100 倍后测OD500nm。按照公式(7)、(8)计算乳化性和乳化稳定性。

式中:n为稀释倍数;A为500 nm波长处的吸光度;φ为油相所占的分数,本实验中油相占1/4;ρ为0.01,即蛋白质的质量浓度/(g/mL)。

式中:A0为0 min时的乳化液500 nm波长处的吸光度;t为静置时间(10 min);A10为乳化液静置10 min后的吸光度。
1.3.6 色度分析
使用CR-410色彩色差仪来确定分离蛋白及原料的颜色特性,每个样品测量3次,得到L*、a*和b*值,其中L*值表示产品的亮度即从黑(0)到白(100)的颜色,a*值表示红度(+)或绿度(-)值,正值越大偏向红色的程度越大,负值越大偏向绿色的程度越大;b*值表示黄度(+)或蓝度(-)值,正值越大偏向黄色的程度越大,负值越大偏向蓝色的程度越大;白度则根据式(9)计算[13]。

1.4 统计分析
2 结果与分析
2.1 虾夷扇贝外套膜蛋白溶解度的变化规律
蛋白质的溶出不仅是等电点絮凝回收的前提,而且,在溶出过程中还可以使色素、脂肪、灰分以及结缔组织等成分与蛋白质分离[14-15]。在pH 1.5~12.0范围内,虾夷扇贝外套膜蛋白质的溶解规律如图1所示。

图1 扇贝外套膜蛋白质在不同pH值的溶解度变化曲线Fig.1 Solubility of Patinopecten yessoensis mantle proteins as a function of pH
由图1可知,在酸性及碱性环境下,蛋白质最大溶解度均出现在极端pH值条件下,分别为pH 1.5和pH 12.0,在酸性的pH 4.0以下和碱性的pH 9.0以上时,蛋白质的溶解度均急剧增加,这要归因于肌肉蛋白质分子所带的净正电荷或净负电荷增加。带同种电荷的蛋白质分子之间相互排斥,从而保证蛋白质分子处于分离状态;同 时带电的蛋白质分子与水分子之间形成离子-偶极作用而被溶剂化[16]。在pH 4.0~9.0内,蛋白质分子所带净电荷不足,与水分子间的作用较弱,蛋白质分子之间趋于相互作用,所表现出的溶解度也不高,这与Undeland[17]、Gehring[18]等的研究结果相似。在pH 4.5~5.0时溶解度最低,此为扇贝外套膜蛋白质的等电点。与之相比,通常鱼肉蛋白质的等电点为pH 5.5,这可能是由于扇贝外套膜与鱼肉蛋白质在蛋白质的组成与结构方面存在一定的差异性。
2.2 虾夷扇贝外套膜蛋白质回收率的变化规律

图2 虾夷扇贝外套膜蛋白质在不同pH值的回收率变化曲线Fig.2 Recovery rate of Patinopect en yessoensis mantle proteins as a function of pH

图3 虾夷扇贝外套膜蛋白质溶解度与回收率的相关性分析Fig.3 Correlation analysis between Patinopecten yessoensis mantle protein solubility and recovery rate
由图2可知,回收率变化规律与溶解度变化规律基本一致。由图3可知,二者具有十分显著的相关性,相关系数R2=0.998 7。无论是酸处理还是碱处理,蛋白质的最大回收率均发生在其溶解度最高的pH值点,分别为83.31%及90.75%。与鱼类分离蛋白回收率(60%~80%)相比[8],虾夷扇贝外套膜蛋白质回收率相对较高。
2.3 虾夷扇贝外套膜分离蛋白分子质量分析
利用SDS-PAGE法对虾夷扇贝外套膜分离蛋白及其制备过程中未回收部分 中各组分蛋白质的分子质量进行分析,结果见图4、5。

图4 虾夷扇贝外套膜分离蛋白的SDS-PAGE电泳图谱Fig.4 SDS-PAGE of the protein isolates extracted from Patinopecten yessoensis mantle
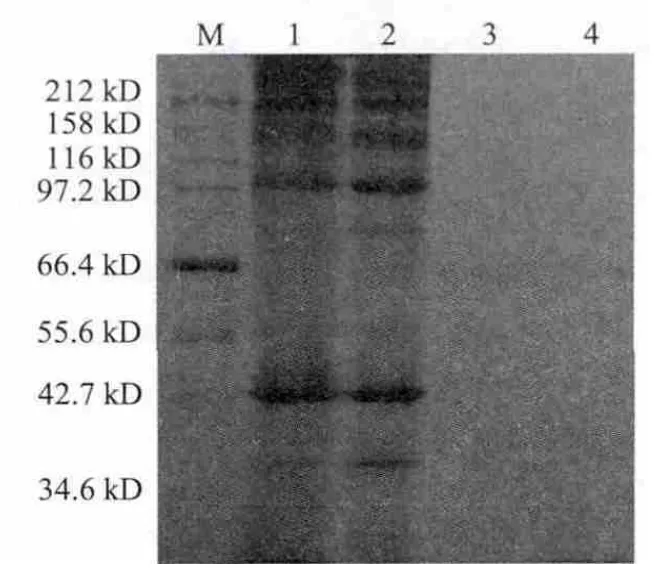
图5 虾夷扇贝外套膜分离蛋白制备过程中未回收部分的SDS-PAGE电泳图谱Fig.5 SDS-PAGE of unrecovered protein fractions during Patinopecten yes soensis mantle protein isolation
由图4可知,虾夷扇贝外套膜主要蛋白质组分有肌球蛋白、副肌球蛋白、肌动蛋白以及原肌球蛋白等,而酸分离蛋白和 碱分离蛋白的条带与原料很相似。扇贝是无脊椎动物,其蛋白质的组成及结构与脊椎动物存在一定的 差异性,分布在100 kD附近的蛋白质条带是副肌球蛋白,它是无脊椎动物特有的肌原纤维蛋白质[19]。由图5可知,酸溶和碱溶过程有少量蛋白质未被溶出,碱处理未溶出沉淀中的蛋白条带较酸处理的多,泳道3和4中酸处理和碱处理未回收溶出物的蛋白质分子质量都在40 kD左右。对比图4、5可知,等电点絮凝法能够有效回收大部分的蛋白质溶出物组分,使得未回收溶出物的蛋白含量很低,造成条带的不清晰或无条带。
2.4 虾夷扇贝外套膜分离蛋白基本成分分析
表1 虾夷扇贝外套膜分离蛋白的基本成分( ±s,n=3)Table 1 Proximate composition ofPatinopecten yessoensis mantle protein isolateess ( ±s, n=3)

表1 虾夷扇贝外套膜分离蛋白的基本成分( ±s,n=3)Table 1 Proximate composition ofPatinopecten yessoensis mantle protein isolateess ( ±s, n=3)
注:同列字母不同,表示差异显著(P<0.05)。下同。
产物 蛋白质含量/% 脂肪含量/% 灰分含量/%扇贝外套膜 77.78±0.79a 3.55±0.24a 3.17±0.06a酸分离蛋白 80.21±0.33b 1.02±0.06b 2.67±0.05b碱分离蛋白 84.28±0.95c 0.80±0.02b 1.81±0.18c
由表1可知,与原料扇贝外套膜相比,酸、碱分离蛋白均有较高的蛋白质纯度,分别为酸分离蛋白的80.21%及碱分离蛋白的84.28%。酸法回收蛋白与碱法回收蛋白脂肪含量得到明显降低,从原料的3.55%分别下降到1.02%及0.80%,脂肪含量较低,更利于贮存,这说明分离处理能够有效去除原料中的脂肪。
2.5 虾夷扇贝外套膜及其分离蛋白的色度分析
产品的色泽外观是影响产品感官特性的第一因素,表2比较了酸法分离蛋白、碱法分离蛋白与原料扇贝外套膜的颜色差别。与原料相比,酸分离蛋白和碱分离蛋白均表现出较高的白度,其中酸分离蛋白的白度更高,对于鱼类肌肉,通常其碱分离蛋白的白度要高于酸分离蛋白[20],这可能是由于碱法能够去除更多的血红蛋白。碱法处理后,在等电点范围内有大量的血红蛋白处于溶解状态,未被沉淀出来,从而与其他蛋白分离,而酸法处理则恰恰相反[13],但也有相反的研究报道[21]。酸分离蛋白和碱分离蛋白的亮度L*均有显著提升,a*和b*都为正值,且都有下降,a*值反映的是红值,b*值反映的是黄值,红值和黄值均减小说明两种方法都能有效地去除部分的天然色素类物质,两种蛋白的白度均大于原料,说明两种蛋白的感官接受度较原料均有提高。
表2 虾夷扇贝外套膜及其分离蛋白的色度值( ±s,n=3)Table 2 Color values of Patinopecten yessoensis mantle and proteiinn isolates (±s, n =3)

表2 虾夷扇贝外套膜及其分离蛋白的色度值( ±s,n=3)Table 2 Color values of Patinopecten yessoensis mantle and proteiinn isolates (±s, n =3)
指标 扇贝外套膜 酸分离蛋白 碱分离蛋白L* 60.65±0.09a 68.55±0.16c 67.20±0.31b a* 4.97±0.20a 3.48±0.07c 2.78±0.06b b* 12.55±0.14a 11.02±0.28b 12.17±0.22a白度 58.40±0.04a 66.49±0.22b 6 4.91±0.26c
2.6 虾夷扇贝外套膜分离蛋白功能特性

表3 虾夷扇贝外套膜分离蛋白的功能性质Table 3 Functional properties of Patinopecten yessoensis mantle protein isolates
由表3可知,与大豆蛋白相比,酸法与碱法分离蛋白除了持油性稍高,其他包括持水性、发泡性和乳化性都较差,因此需要进一步研究来提高虾夷扇贝外套膜分离蛋白的功能性,从而增强其在食品中的应用性。
3 结 论
等电点絮凝法能有效地对虾夷扇贝外套膜蛋白质进行分离回收。研究发现虾夷扇贝外套膜蛋白质的等电点在pH 4.5~5.0范围内;分离产物不仅蛋白质纯度高,且有明显的脱脂及脱色效果。总之,等电点絮凝法对于开发利用虾夷扇贝外套膜蛋白质极具潜力。今后,就分离蛋白的功能性开发方面,有待进一步研究。
[1]刘俊荣, 章超桦, 蒋海山, 等.欧盟食品安全管理体系给中国贝类产业健康发展的启示[J].大连海洋大学学报, 2010(5): 442-449.
[2]农业部渔业局.2011中国渔业统计年鉴[M].北京: 中国农业出版社, 2011.
[3]辛草, 刘俊荣, 蔡秋凤, 等.三种经济扇贝的基本工艺性质及蛋白质分析[J].水产科学, 2012, 31(9): 535-539.
[4]苏秀榕, 李太武, 丁明进.扇贝营养成分的研究[J].海洋科学,199 7(2): 10-11.
[5]黄翠丽, 刘赛.扇贝的生理活性物质和药用价值[J].中国海洋药物,2001, 20(2): 45-47.
[6]于囡, 刘赛, 王海桃, 等.扇贝裙边糖胺聚糖体外抗I型单纯疱疹病毒实验研究[J].中国药理学通报, 2008(2): 210-213.
[7]PALAFOX H, C RDOVA-MURUETA J H, NAVARRET E del TORO M A, et al.Protein isolates from jumbo squid (Dosidicus gigas) by pH-shift processing[J].Pro cess Biochemistry,2009, 44(5): 584-587.
[8]傅润泽, 刘俊荣, 王帅, 等.采用酸碱提取法对鲢肌肉蛋白分离 特性的影响[J].大连海洋大学学报,2011(6): 539-543.
[9]盛彩虹, 刘晔, 刘大川, 等.紫苏分离蛋白功能性研究[J].食品科学,2011, 32(17): 137-140.
[10]FREITAS I R, GAUTERIO G V, RIOS D G, et al.Functionality of protein isolates fromArgen tine anchovy(Engraulis anchoita) residue obtained using pH shift processing[J].Journal of Food Science and Engineering,2011, 5(1): 374-378.
[11]VIOQUE J, S NCHEZ-VIOQUE R, CLEMENTE A, et al.Partially hydrolyzed rapeseed protein isolates with improved functional properties[J].Journal of the Ameri can Oil Chemists’ Society,2000,77(4): 447-450.
[12]PEARCE K N, KINSELLA J E.Emulsifyin g properties of proteins:evaluation of a turbidimetric technique[J].Journal of Agricultural and Food Chemistry,1978, 26(3): 716-723.
[13]KRISTINSSON H G, THEODORE A E, DEMIR N, et al.A comparative study between acid- and alkali-aid ed processing and surimi processing for the recovery of proteins from channel catfish muscle[J].Journal of Food Science,2005, 70(4): 298-306.
[14]NOLSOE H, UNDELAND I.The acid and alkaline solubilization pr ocess for the isolation of muscle proteins: state of the art[J].Food and Bioprocess Technology,2009, 2(1): 1-27.
[15]KRISTINSSON H G, LIANG Y.Effect of pH-shift processing a nd surimi processing on Atlantic croaker (Micropogonias undulates)muscle proteins[J].Journal of Food Science,2006, 71(5): 304-312.
[16]FENNEMA O R.Food Chemistry[M].3th ed.New York: Marcel Dekker, Inc, 1996.
[17]UNDELAND I, KELLEHER S D, HULTIN H O, et al.Consistency and solubility changes in herring (Clupea harengus) light muscle homogenates as a function of pH[J].Journal of Agricultural and Food Chemistry,200 3, 51(14): 3992-3998.
[18]GEHRING C K, DAVENPORT M P, JACZYNSKI J.Functional and nutritional quality of protein and lipid recovered from fish processing by-products and underutilized aquatic spe cies using isoelectric solubilization/precipitation[J].Current Nutrition & Food Science,2009, 5(1): 17-39.
[19]鸿巢章二.水产利用化学[M].北京: 中国农业出版社, 1994.
[20]UNDELAND I, KELLEHER S D, HULTIN H O.Recovery of functional proteins from herring (Clupea harengus) light muscle by an acid or alkaline solubilization proces s[J].Journal of Agricultural and Food Chemistry,2002, 50(25): 7371-7379.
[21]MARMON S K, UNDELAND I.Protein Isolation from gutted herring(Clupea harengus) using pH-shift processes[J].Journal of Agricultural and Food Chemistry,2010, 58(19):10480-10486.
