柠檬苦素对DDP耐药胃癌细胞化疗敏感性的影响
2021-11-18张志勇任牡丹李雅睿卢桂芳和水祥西安交通大学第一附属医院消化内科西安7006空军军医大学第一附属医院消化病医院共同第一作者通讯作者maildyyyjxkmailxjtueducn
张志勇,潘 妍,赵 艳,任牡丹,李雅睿,卢桂芳,和水祥(西安交通大学第一附属医院消化内科,西安 7006;空军军医大学第一附属医院消化病医院;共同第一作者;通讯作者,E-mail:dyyyjxk@mail.xjtu.edu.cn)
胃癌是全球第五大最常见的癌症,也是导致癌症死亡的第三大原因。近年来,胃癌发病率显著上升[1,2]。尽管胃癌的综合治疗取得了进展,但胃癌患者的5年生存率仍然不高[3]。胃癌患者治疗失败的主要原因是化疗耐药。顺铂(cisplatin,DDP)是治疗胃癌的一线药物。然而,DDP耐药现象普遍存在,正成为影响胃癌预后的关键因素。因此,研究DDP耐药的分子机制对胃癌的治疗具有重要意义。DNA修复是一系列因染色体完整性受损而发生的分子变化。在染色体DNA中诱导DNA损伤是放疗和化疗等癌症治疗的主要机制之一[4]。DNA修复通路的激活和表达水平在很大程度上决定了化疗的疗效[5]。柠檬苦素(limonin)是一种来源于柑橘属植物果实中的三萜类化合物,分子式:C26H30O8,分子量:470.512。多项研究报道,柠檬苦素具有抗癌、抗炎、镇痛、抗菌、抗病毒、抗虫、抗氧化、保肝、神经保护、抗骨质疏松、抗肥胖、抗过敏等药理活性[6]。柠檬苦素的抗癌活性日益收到广大学者的关注。最近的研究显示,柠檬苦素通过抑制STAT3的活化预防并抑制胃癌细胞的转移[7]。然而,目前尚不清楚柠檬苦素是否可增强胃癌细胞对DDP的敏感性。因此,本研究探讨了柠檬苦素对胃癌细胞化疗敏感性及DNA损伤修复的影响。
1 材料与方法
1.1 材料

1.2 方法
1.2.1 细胞培养 SGC-7901细胞在RPMI-1640培养基中于37 ℃、5% CO2环境中培养,培养基中添加10%的胎牛血清(FBS)、100 U/ml青霉素和100 mg/ml链霉素。
1.2.2 DDP耐药的SGC-7901细胞株构建 参考文献[8]所述方法,用0.5 μmol/L的DDP处理SGC-7901细胞48 h,然后更换为正常培养基,当细胞达到90%汇合时,重复上述操作直至细胞能在含0.5 μmol/L的DDP的培养基中稳定生长。然后逐渐提高DDP浓度(0.5,1,1.5,2,2.5,3 μmol/L)并用相同的培养方法培养,直至细胞能在含3 μmol/L的DDP的培养基中稳定生长,即得SGC-7901/DDP耐药株。然后将SGC-7901/DDP细胞在含3 μmol/L的DDP的培养基中培养并进行后续实验。
1.2.3 细胞存活率测定 用MTT法测定细胞存活率。将SGC-7901/DDP细胞(1×104个/孔)在96孔板中培养24 h,然后更换为含1% FBS的RPMI-1640培养基继续培养24 h。分别将细胞用不同浓度(0,5,10,20,40,80,160 μmol/L)的柠檬苦素处理48 h,或不同浓度(0,4,8,16,32,64 μmol/L)的DDP处理48 h。处理后将细胞与MTT试剂(0.5 mg/ml)孵育4 h,然后加入150 ml二甲基亚砜(DMSO)溶解甲臜。在490 nm波长处测定吸光度。细胞存活率计算如下:细胞存活率(%)=样本A490/对照A490×100%。实验至少重复3次。用Graph Pad Prism 5计算IC50值。
1.2.4 细胞分组及处理 将细胞分为4组:对照组、柠檬苦素组、DDP组和柠檬苦素+DDP组。柠檬苦素的浓度为40 μmol/L,DDP的浓度为16 μmol/L。对照组细胞正常培养,柠檬苦素组细胞用含40 μmol/L柠檬苦素的培养基培养,DDP组细胞用含16 μmol/L DDP的培养基培养,柠檬苦素+DDP组细胞用含40 μmol/L柠檬苦素和16 μmol/L DDP的培养基培养。根据上述MTT法测定各组的存活率。
1.2.5 集落形成实验检测细胞增殖 SGC-7901/DDP细胞以1 000个/孔的密度接种于6孔板。接种24 h后,用柠檬苦素或DDP处理48 h,更换为不含药物的RPMI-1640完全培养基继续培养14 d,每隔2 d更换培养基。然后将细胞用甲醇固定并用结晶紫染色。在显微镜下计数含有50个细胞以上的集落。实验至少重复3次。
1.2.6 流式细胞仪检测细胞凋亡 取2 ml SGC-7901/DDP细胞(1×106/ml)接种于6孔板,培养24 h后更换为含1% FBS的RPMI-1640培养液过夜培养。然后将细胞用柠檬苦素或DDP处理48 h后,用PBS洗涤。然后用5 μl Annexin Ⅴ-FITC孵育15 min,1 000 r/min离心5 min后,重悬细胞并与10 μl PI室温避光孵育30 min。用BD FACSCalibur流式细胞仪检测细胞。实验至少重复3次。

1.2.8 Western blot检测Bax、Bcl-2、cleaved Caspase-3、cleaved PARP1、γ-H2AX和53BP1的蛋白表达水平 SGC-7901/DDP细胞用柠檬苦素或DDP处理48 h后,收集细胞,用RIPA裂解缓冲液裂解,细胞裂解液在4 ℃ 12 000g离心10 min,收集上清液。用BCA试剂盒测定蛋白质浓度。将蛋白质经10%SDS-PAGE电泳并转移到PVDF膜上。用5%脱脂牛奶溶液封闭膜1 h,在4 ℃下分别与Bax(1 ∶2 000稀释)、Bcl-2(1 ∶2 000稀释)、cleaved Caspase-3(1 ∶3 000稀释)、cleaved PARP1(1 ∶3 000稀释)、γ-H2AX(1 ∶1 000稀释)、53BP1(1 ∶2 000稀释)和GAPDH(1 ∶1 000稀释)一抗孵育过夜,然后用HRP标记的二抗(1 ∶2 000稀释)在室温下孵育1 h。用增强化学发光(ECL)系统检测蛋白表达水平。实验至少重复3次。
1.2.9 胃癌移植瘤裸鼠模型的构建及处理 40只4周龄雄性BALB/c-nu小鼠购自北京维通利华实验动物技术有限公司。小鼠饲养在无特定病原体的环境中,环境温度(22±1)℃、相对湿度(60±5)%、光照/黑暗周期12/12 h(08:00-20:00光照)。每只小鼠左腋皮下注射200 μl SGC-7901/DDP细胞(2×106)。当肿瘤长径达到8 mm时(大约1周后),取肿瘤大小相当的24只小鼠随机分为4组(n=6):模型组、柠檬苦素组、DDP组和柠檬苦素+DDP组。模型组小鼠不进行治疗。柠檬苦素给药剂量为10 mg/(kg·d),DDP给药剂量为5 mg/(kg·d),给药体积均为0.1 ml。连续治疗7 d。每隔1周测量肿瘤大小,计算公式为:体积=(长径×短径2)/2。治疗4周后处死小鼠,分离肿瘤并拍摄图像,统计4周内的肿瘤体积变化。此外,另取24只小鼠按照同样的方法进行分组及治疗,观察记录每组小鼠的生存情况,然后进行Kaplan Meier生存分析。
1.3 统计分析
所有数据均以至少3个重复的平均值±标准差表示。使用SPSS21.0软件进行统计分析,组间比较采用单因素方差分析及LSD检验。Kaplan Meier生存分析比较各组小鼠的生存率。P<0.05表示差异具有统计学意义。
2 结果
2.1 柠檬苦素和DDP对SGC-7901/DDP细胞增殖的影响
柠檬苦素处理48 h后,与0 μmol/L组相比,40,80和160 μmol/L处理组SGC-7901/DDP细胞存活率均显著降低,表现为剂量依赖性(P<0.05,见图1)。DDP处理48 h后,与0 μmol/L组相比,16,32和64 μmol/L处理组SGC-7901/DDP细胞存活率均显著降低,表现为剂量依赖性(P<0.05,见图1)。柠檬苦素和DDP处理SGC-7901/DDP细胞48 h的IC50分别为78.54 μmol/L和44.73 μmol/L。柠檬苦素或DDP处理48 h后,与对照组相比,柠檬苦素组和DDP组细胞存活率均降低(P<0.05);与柠檬苦素组和DDP组相比,柠檬苦素+DDP组细胞存活率降低(P<0.05,见图1)。与对照组相比,柠檬苦素组和DDP组的集落数量均降低(P<0.05);与柠檬苦素组和DDP组相比,柠檬苦素+DDP组的集落数量降低(P<0.05,见图2)。

与0 μmol/L比较,*P<0.05,**P<0.01,***P<0.001;与对照组比较,aP<0.05;与柠檬苦素组比较,bP<0.05;与DDP组比较,cP<0.05图1 不同浓度柠檬苦素和DDP处理48 h对SGC-7901/DDP细胞存活率的影响Figure 1 The effect of different concentrations of limonin and DDP on the survival rate of SGC-7901/DDP cells after treatment for 48 h
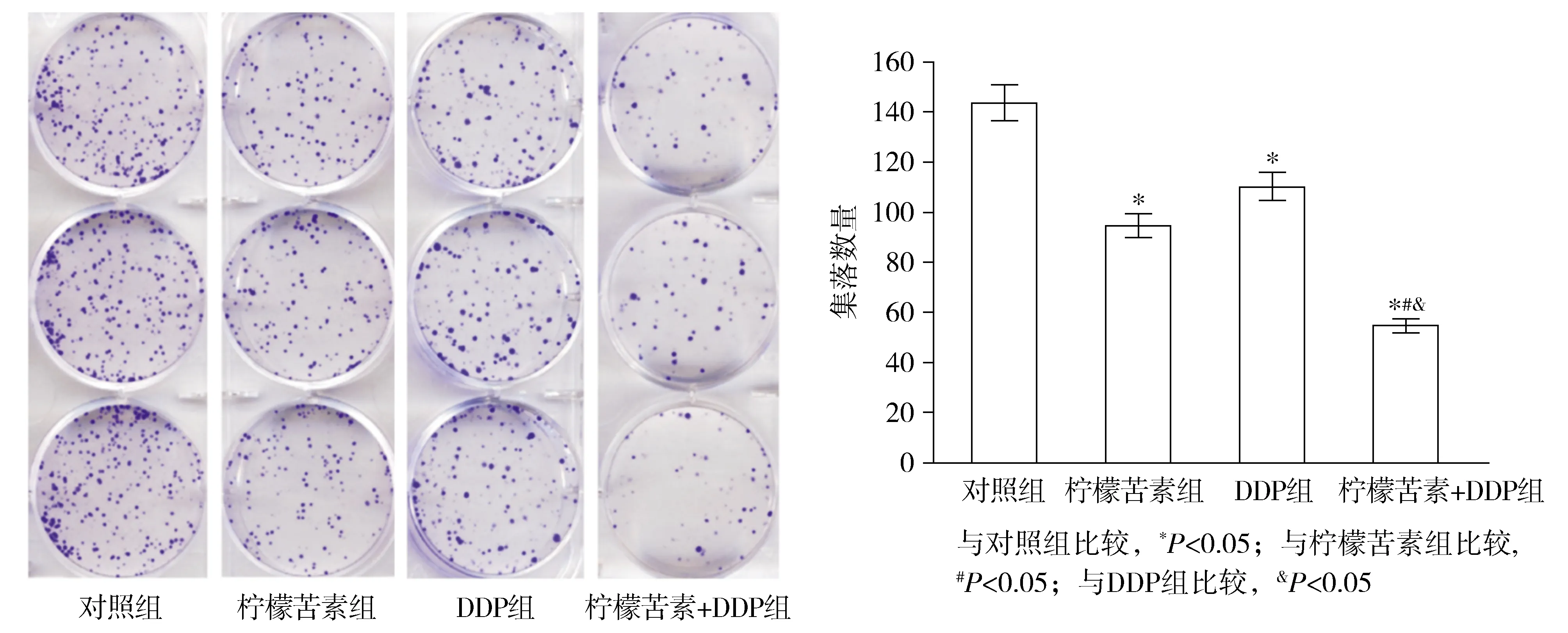
图2 柠檬苦素和DDP对SGC-7901/DDP细胞集落形成的影响Figure 2 The effect of limonin and DDP on the colony formation of SGC-7901/DDP cells
2.2 柠檬苦素和DDP对SGC-7901/DDP细胞凋亡的影响
与对照组相比,柠檬苦素组和DDP组细胞凋亡率均升高(P<0.05)。与柠檬苦素组和DDP组相比,柠檬苦素+DDP组细胞凋亡率升高(P<0.05,见图3)。与对照组相比,柠檬苦素组和DDP组Bax和cleaved Caspase-3蛋白表达水平均升高,Bcl-2蛋白表达水平降低(P<0.05)。与柠檬苦素组和DDP组相比,柠檬苦素+DDP组Bax和cleaved Caspase-3蛋白表达水平均升高,Bcl-2蛋白表达水平降低(P<0.05,见图4)。

图3 柠檬苦素和DDP对SGC-7901/DDP细胞凋亡的影响Figure 3 The effect of limonin and DDP on the apoptosis of SGC-7901/DDP cells

与对照组比较,*P<0.05;与柠檬苦素组比较,#P<0.05;与DDP组比较,&P<0.05图4 Western blot检测柠檬苦素和DDP对SGC-7901/DDP细胞中Bax、Bcl-2和cleaved Caspase-3蛋白表达的影响Figure 4 The effect of limonin and DDP on the protein expression of Bax, Bcl-2 and cleaved Caspase-3 in SGC-7901/DDP cells by Western blot
2.3 柠檬苦素和DDP对SGC-7901/DDP细胞DNA损伤修复的影响
与对照组相比,柠檬苦素组和DDP组γ-H2AX阳性率均升高(P<0.05)。与柠檬苦素组和DDP组相比,柠檬苦素+DDP组γ-H2AX阳性率升高(P<0.05,见图5)。与对照组相比,柠檬苦素组和DDP组cleaved PARP1、γ-H2AX和53BP1蛋白表达水平均升高(P<0.05)。与柠檬苦素组和DDP组相比,柠檬苦素+DDP组的cleaved PARP1、γ-H2AX和53BP1蛋白表达水平均升高(P<0.05,见图6)。

与对照组比较,*P<0.05;与柠檬苦素组比较,#P<0.05;与DDP组比较,&P<0.05图5 免疫荧光染色检测柠檬苦素和DDP对SGC-7901/DDP细胞中γ-H2AX表达的影响Figure 5 The effect of limonin and DDP on the expression of γ-H2AX in SGC-7901/DDP cells by immunofluoresence staining

与对照组比较,*P<0.05;与柠檬苦素组比较,#P<0.05;与DDP组比较,&P<0.05图6 Western blot检测柠檬苦素和DDP对SGC-7901/DDP细胞中cleaved PARP1、γ-H2AX和53BP1蛋白表达的影响Figure 6 The effect of limonin and DDP on the expression of cleaved PARP1, γ-H2AX and 53BP1 in SGC-7901/DDP cells by Western blot
2.4 柠檬苦素和DDP对胃癌移植瘤裸鼠肿瘤生长的影响
各组小鼠经1周的药物治疗后,在第2,3,4周时,与模型组相比,柠檬苦素组和DDP组肿瘤体积均降低(P<0.05);与柠檬苦素组和DDP组相比,柠檬苦素+DDP组肿瘤体积降低(P<0.05,见图7)。Kaplan Meier生存分析显示,随访18个月内,各组小鼠的生存率存在显著差异(P<0.05,见图8)。模型组1只(16.67%)小鼠存活,柠檬苦素组2只(33.33%)小鼠存活,DDP组3只(50.00%)小鼠存活,柠檬苦素+DDP组4只(66.67%)小鼠存活。

图7 柠檬苦素和DDP对SGC-7901/DDP细胞移植瘤裸鼠肿瘤体积的影响Figure 7 The effect of limonin and DDP on the tumor volume of nude mice with SGC-7901/DDP cell transplantation

图8 柠檬苦素和DDP对SGC-7901/DDP细胞移植瘤裸鼠存活率的影响Figure 8 The effect of limonin and DDP on the survival rate of SGC-7901/DDP cell transplanted tumor in nude mice
3 讨论
DDP耐药性是限制DDP抗癌效果的主要障碍,目前,许多学者报道了天然药物的联合施用可提高癌细胞对化疗药物的敏感性。例如,南蛇藤提取物通过Caspase依赖性凋亡增强DDP对胃癌的敏感性[9]。小檗碱通过促进细胞凋亡和抑制PI3K/AKT/mTOR信号通路改善胃癌对DDP的化疗敏感性[10]。目前,大量研究报道了柠檬苦素的抗癌活性。此外,柠檬苦素还可以增强抗癌药物对癌细胞的毒性。柠檬苦素可显著增强阿霉素对耐药人白血病细胞系CEM/ADR5000细胞的细胞毒作用[11]。柠檬苦素可以通过抑制Wnt/β-catenin途径和抑制MIR216A甲基化来抑制乳腺癌细胞的干性,减轻对阿霉素耐药乳腺癌细胞的耐药性[12]。柠檬苦素可以通过促进转录共激活因子YAP(YAP)的核浆转位来减弱宫颈癌细胞的干性,从而增强细胞对阿霉素的敏感性[13]。然而,柠檬苦素在胃癌中的应用较少,且尚不清楚是否对化疗药物抗癌效果具有增敏作用。因此,本研究建立了DDP耐药的SGC-7901/DDP细胞株。研究显示,不同浓度的柠檬苦素和DDP处理SGC-7901/DDP细胞48 h后,均以剂量依赖性方式降低了细胞存活率。柠檬苦素和DDP处理SGC-7901/DDP细胞48 h的IC50分别为78.54 μmol/L和44.73 μmol/L。为了考察柠檬苦素对DDP的增敏作用,本研究设置柠檬苦素的浓度为40 μmol/L,DDP的浓度为16 μmol/L。进一步的研究证实,两种药物联用进一步降低了细胞存活率。刘伯霞等[7]研究显示,柠檬苦素对胃癌细胞系增殖的抑制作用较小,而在本研究中柠檬苦素则表现出良好的抗胃癌细胞增殖效果,其原因可能与细胞增殖检测方法的不同有关。本研究MTT法和集落形成实验均取得了一致的结果。
DDP耐药机制与细胞凋亡蛋白的异常表达有直接的关系[14,15]。本研究结果表明,柠檬苦素增强了DDP对细胞凋亡的促进作用,并升高了SGC-7901/DDP细胞中促凋亡蛋白Bax和cleaved Caspase-3的蛋白表达,降低了抗凋亡蛋白Bcl-2的蛋白表达。其他研究报道,柠檬苦素通过激活内源性凋亡途径、降低Bcl2/Bax转录速率、诱导细胞色素C释放诱导人结肠癌(SW480)细胞线粒体介导的内源性凋亡[16]。在HCT-15(肝癌)和SNU449(结肠癌)细胞中,柠檬苦素通过增加Bax的表达和降低Bcl-2的表达而诱导细胞凋亡[16]。因此,在胃癌中,柠檬苦素可能通过影响凋亡相关蛋白的表达来促进细胞凋亡,并且进一步增加DDP对细胞凋亡的诱导作用。
近年来,DNA损伤修复被发现是肿瘤耐药的一种新的重要机制。临床上大多数化疗药物都是通过DNA损伤诱导细胞凋亡来清除肿瘤细胞[17],相反,持续的DNA损伤可能会激活肿瘤细胞DNA的损伤修复机制,导致化疗药物的继发性耐药出现,导致临床疗效大大降低。DNA碱基切除修复(BER)是DNA损伤修复的重要途径之一[18]。大多数化疗药物,特别是DNA合成抑制剂,如烷化剂(如DDP)、碱基类似物,通过BER导致DNA损伤修复。因此,本研究探讨了柠檬苦素和DDP对SGC-7901/DDP细胞DNA损伤修复相关蛋白γ-H2AX、53BP1和PARP1的影响。研究显示,柠檬苦素和DDP均促进了SGC-7901/DDP细胞中cleaved PARP1、γ-H2AX和53BP1的蛋白表达,并且两种药物具有协同作用。γ-H2AX是DNA双链断裂的标志,在高等真核细胞中,染色质中的DNA双链断裂迅速启动组蛋白H2A变异体H2AX在丝氨酸139处的磷酸化,从而产生γ-H2AX[19]。53BP1是细胞对DNA双链断裂反应的重要调节因子,53BP1是将DNA损伤信号传到p53及其他肿瘤抑制蛋白途径中的一个重要传感器,与基因组稳定性密切相关[20]。PARP1参与DNA损伤修复,活化的PARP-1可吸引多种DNA损伤修复因子促进DNA修复[21]。裂解的(cleaved)PARP1也是一种细胞凋亡标记物[22]。另外,PARP1抑制剂的研发已经在抗肿瘤领域取得良好效果[23]。综合上述报道可知,柠檬苦素具有抑制胃癌DDP耐药细胞中DNA损伤修复的作用,并且通过这种作用提高了DDP对胃癌耐药细胞的敏感性。本研究体内胃癌移植瘤小鼠模型也证实了柠檬苦素联合DDP对SGC-7901/DDP细胞移植瘤具有协同抑制作用,可明显延长小鼠的生存期。
综上所述,本研究表明柠檬苦素通过抑制DNA损伤修复来增强胃癌细胞的化疗耐药性。因此,柠檬苦素有望成为一种候选的化疗辅助药物。
