低温冷冻条件对大豆分离蛋白分散液表面疏水性及二硫键的影响
2014-02-13朱秀清李佳栋郑环宇吴海波
王 玲,朱秀清,李佳栋,许 慧,郑环宇,吴海波
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.国家大豆工程技术研究中心,黑龙江 哈尔滨 150030)
大豆分离蛋白(soybean protein isolate,SPI)是以低温脱脂豆粕为原料,经碱提酸沉工艺制取的一种蛋白质含量在90%以上的大豆蛋白产品[1],是一种全价蛋白类食品添加剂。SPI凭其资源丰富,原料成本低等优势,已广泛应用于食品行业中。随着生活节奏的加快和生活水平的不断提高,一些方便快捷的冷冻食品,如冷冻肉丸、冷冻肉馅等深受人们的喜爱,使得大豆分离蛋白在冷冻食品应用中的市场前景更加广阔。将SPI添加到冷冻肉制品中,利用SPI自身的功能性质,有利于在加工过程中发挥各种冷冻肉制品的理化性质。但是SPI在冷冻条件下,由于蛋白质分子多肽链特有的有规则排列发生变化成为较混乱的排列[2],会发生不可逆的冻结变性[3]。石彦国等[4]研究发现将粉末状大豆蛋白配制成溶液后进行冻结,并在-1~-3 ℃条件下冷藏,解冻后部分大豆蛋白出现絮状不融现象;Pikal-Cleland[5]得出在冻藏过程中,蛋白质分子间由于氢键、疏水键、二硫键、盐键等的形成而聚集变性,从而导致盐溶性蛋白的溶解度下降。大豆蛋白的冷冻变性,直接影响了SPI在冷冻食品中功能性的发挥。因此,研究冷冻过程中蛋白质结构变化,有助于深入了解大豆蛋白的冷冻变性机理,进而可以明确SPI的结构变化对其功能性的影响,无论从理论还是实际来说,都有一定的指导意义。巯基与二硫键是维持蛋白质空间结构重要的组成部分[6],通过其含量的变化情况来检测蛋白质结构变化,是最有效便捷的方法。本实验结合已有的方法和结果,探讨低温冷冻条件对SPI结构的影响。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白 哈高科大豆食品有限责任公司;β-巯基乙醇(分析纯) 美国Amresco公司;三羟甲基氨基甲烷(分析纯)、Ellman试剂(优级纯)、5,5’-二硫代二硝基苯甲酸盐(分析纯)、1-苯胺基-8-萘磺酸(分析纯) 美国Sigma公司。
1.2 仪器与设备
TU-1901双光束紫外-可见分光光度计 北京普析通用仪器有限公司; BC-169海尔双王子电冰箱 青岛海尔电冰箱股份有限公司;4500型荧光分光光度计 日本日立公司。
1.3 方法
1.3.1 大豆分离蛋白基本成分的测定
蛋白质含量测定:凯氏定氮法(GB/T 5009.5—2010《食品中蛋白质的测定》);粗脂肪含量测定:索氏提取法(GB/T 5512—2008《粮油检验 粮食中粗脂肪含量测定》);灰分测定:GB/T 22510—2008《谷物、豆类及副产品灰分含量的测定》;水分测定:GB 5009.3—2010《食品中水分的测定》;粗纤维含量的测定:GB 5009.10—2003《植物类食品中粗纤维的测定》。
1.3.2 大豆分离蛋白冷冻样品的制备
将干燥的SPI样品与水以不同比例混合,搅拌均匀后,于室温下静置20 min后送入冰箱内冷冻。将冷冻后的SPI,在水中解冻,解冻后的样品放入鼓风干燥箱中低温烘干,将烘干后的固体粉碎,制成粉末状样品,备用。
1.3.3 巯基和二硫键含量的测定
蛋白质的巯基含量的测定,是根据Ellman[7]提出的理论,参照Tang[9]采用的5,5’-二硫代二硝基苯甲酸盐滴定方法,在412nm波长测定吸光度。按照式(1)计算巯基含量。
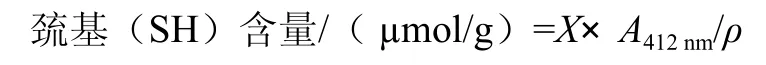
式中:X为摩尔消光系数(73.53);A412nm为溶液在412 nm的波长下测定的吸光度;ρ为样品的蛋白质质量浓度/(mg/mL)[8]。
暴露巯基是指在SPI未变性的状态下,埋藏于蛋白分子内部与外界极性环境不相互作用的巯基基团。按照式(2)计算暴露巯基含量和二硫键含量。

1.3.4 表面疏水性的测定
采用8-苯胺基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)荧光探针法测定蛋白质表面疏水性[10]。将蛋白质样品溶于0.01 mol/L、pH 7.0的磷酸缓冲液中,配成质量浓度0.012 5~0.1 g/100 mL的溶液。取一定量的ANS固体,溶于相同的pH 7.0的磷酸缓冲液中,制成8.0 mmol/L的ANS溶液,取25 μL的ANS溶液添加到5 mL的样品溶液中,避光反应15 min在激发波长390 nm、发射波长490 nm的条件下测定样品荧光强度,以SPI添加量和荧光强度作图,斜率即为表面疏水性。
1.3.5 冷冻条件下SPI添加量对SPI巯基、二硫键和表面疏水性的影响
在冷冻时间为72 h、冷冻温度为-18 ℃的条件下,考察冷SPI添加量对SPI的游离巯基、暴露巯基、二硫键和表面疏水性的影响。
1.3.6 冷冻温度对SPI巯基、二硫键和表面疏水性的影响
在冷冻时间为72 h、SPI与水质量比为1∶12的条件下,考察冷冻温度的变化对SPI的游离巯基、暴露巯基、二硫键和表面疏水性的影响。
1.3.7 冷冻时间对SPI巯基、二硫键和表面疏水性的影响
在冷冻温度为-18 ℃、SPI与水质量比1∶12的条件下,考察冷冻时间的变化对SPI的游离巯基、暴露巯基、二硫键和表面疏水性的影响。
1.4 数据处理及分析
所有数据均通过3次平行实验得到,采用Microsoft Excel 2010进行数据处理。
2 结果与分析
2.1 大豆分离蛋白的成分
表1 大豆分离蛋白成分分析( ±s)Table 1 Composition analysis of soy protein isolate ( ±s)

表1 大豆分离蛋白成分分析( ±s)Table 1 Composition analysis of soy protein isolate ( ±s)
成分 水分 粗脂肪 蛋白质 灰分 粗纤维含量/% 3.42±0.17 0.07±0.0290.51±0.235.24±0.11 0.26±0.08
由表1可知,SPI的蛋白质含量(干基)可达到90%以上,含量丰富,因此研究蛋白质结构的变化,对提高和改善SPI在食品应用中的功能性具有重要意义。
2.2 冷冻条件下SPI添加量对SPI巯基、二硫键和表面疏水性的影响
由图1可知,随着SPI添加量的降低,游离巯基逐渐减少,即SPI与水质量比由1∶8降低至1∶16时,此时冷冻后SPI的游离巯基为由5.04 μmol/g减小到2.84 μmol/g,冷冻后的SPI样品与未冷冻的对照组样品相比,游离巯基含量均降低。这是由于大豆蛋白中的巯基具有较强的极性,能够借助氢键与分子间相互作用,把极性的水分子吸附到蛋白分子周围,在冷冻冻结作用下,水分子的氢键断裂,破坏了水分子与巯基之间的平衡作用,游离在蛋白表面的巯基失去依靠,进而转换为二硫键或形成其他作用力[11]。
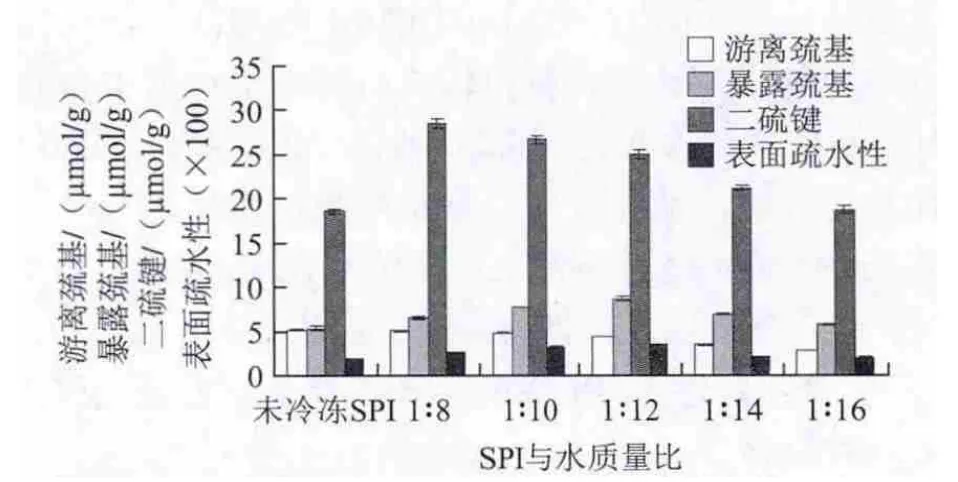
图1 SPI添加量对SPI巯基、二硫键和表面疏水性的影响Fig.1 Effect of SPI/water ratio on the contents of sulfhydryl group and disulfide bond and surface hydrophobic ity of SPI
在冷冻环境下随着大豆蛋白添加量的逐渐降低,SPI的暴露巯基呈现先增加后减小的变化趋势,当SPI与水的质量比为1∶8~1∶12时,暴露巯基的含量由6.55 μmol/g增加到8.7 μmol/g,当SPI与水的质量比为1∶12~1∶16时,暴露巯基的含量由8.7 μmol/g减小至5.74 μmol/g。这可能是由于SPI添加量较高时,蛋白分子间的间距较小,临近的蛋白质之间交织形成复杂的网络,因冷冻作用暴露出的巯基隐藏在重新形成的蛋白网络内部[12];当SPI浓度较低时,虽然蛋白肽链因冷冻作用而得到充分伸展,内部巯基大量暴露,但SPI添加量低,蛋白分子被水分子严密包裹,所以检测到暴露巯基含量较少。
经过冷冻的大豆蛋白的二硫键含量均显著高于对照组,可以得出冷冻后的SPI结构上主要以二硫键的形式存在[13]。随着大豆蛋白浓度的逐渐降低,二硫键的含量也逐渐呈现降低,当SPI与水的质量比为1∶8时,二硫键含量为最大值28.54 μmol/g,当SPI与水的质量比为1∶16时,二硫键含量最小为18.66 μmol/g。冷冻作用下SPI的游离巯基和暴露巯基减少,是因为在冷冻过程中发生缓慢氧化,巯基形成二硫键,导致冷冻后检测到的二硫键含量大于未冷冻的SPI。
疏水相互作用是维持蛋白质三级结构的主要作用力,它对蛋白质结构的稳定性、构象和功能性质具有重要的作用。而表面疏水性由于分子间的相互作用,比整体疏水性对蛋白质功能的影响更大[14]。蛋白质的表面疏水性是与外界极性水环境相连的蛋白质表面疏水性基团数量的一个重要标志[15-16]。随着SPI添加量的减小,表面疏水性先增加后减小,当SPI与水的质量比为由1∶8减至1∶12时,表面疏水性由257.34增至355.47,当SPI与水的质量比为由1∶12减至1∶16时,表面疏水性又减至200.11。冷冻SPI的表面疏水性均大于对照组SPI,说明冷冻能够增加SPI的表面疏水性,这与Noh等[17]的结论一致,认为大豆蛋白的氨基酸侧链疏水性残基是通过疏水键相互结合于蛋白质分子中心,形成疏水性区域,在冷冻变性作用下,蛋白疏水性区域内的氨基酸侧链疏水性残基暴露出来,通过ANS荧光检测,冷冻后的蛋白质分子的荧光强度明显增强。
2.3 冷冻温度对SPI巯基、二硫键和表面疏水性的影响
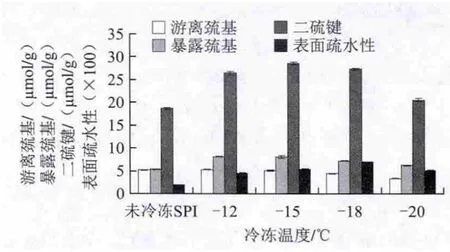
图2 冷冻温度对SPI巯基、二硫键和表面疏水性的影响Fig.2 Effect of freezing temperature on the contents of sulfhydryl group and disulfide bond and surface hydrophobicity of SPI
由图2可知,在较高的冷冻温度下SPI的游离巯基含量较大,与对照组接近,即未冷冻SPI和-12 ℃的游离巯基含量分别为5.17、5.29 μmol/g,随着冷冻温度降低,游离巯基的含量越小,与未冷冻SPI之间的差异越大。表明较低的冷冻温度能够显著改变大豆蛋白游离巯基含量[18-19],并且促使游离巯基含量朝着减小的趋势变化。
在较低冷冻温度下,不同的冷冻温度水平对暴露巯基含量的影响差异不显著(P>0.05),在-12 ℃和-15 ℃时,暴露巯基含量分别为8.13、8.07 μmol/g,而未冷冻SPI的暴露巯基含量为5.35 μmol/g,不同冷冻温度对暴露巯基含量的影响与对照组之间差异显著(P<0.05)。
二硫键含量的变化趋势与暴露巯基相同,均大于未冷冻SPI,在-12 ℃和-15 ℃两个温度水平上,二硫键含量分别为26.42 μmol/g和28.51 μmol/g,明显大于对照组的18.63 μmol/g,表明冷冻处理能够有效增加大豆蛋白二硫键的含量。
随着冷冻温度的降低,SPI的表面疏水性先增加后降低,在-18 ℃时,荧光强度最强,表面疏水性最大。-12 ℃时表面疏水性较小,其原因是冷冻作用下大豆蛋白分子的疏水性残基有效地暴露出来,分子伸展开,理论上表面疏水性是明显增强的[20],但在起初不太低的冷冻温度下,大豆蛋白溶液冷冻浓缩时间延长,水形成冰晶的时间增加,导致冰晶颗粒较大[21],由于机械破坏作用,使得蛋白质的空间结构发生变化,原来展开的肽链重新聚集,部分疏水性基团埋藏于蛋白分子内部,使得表面疏水性降低[22]。随着冷冻温度的降低,机械破坏作用减小,当冷冻温度达到-18 ℃时,蛋白分子暴露的疏水性基团最多,表面疏水性最大,当冷冻温度继续低至-20 ℃时,破坏了在-18 ℃时所保持的肽链伸展状态,因更低温度的影响,使得暴露在外部的疏水性氨基酸残基减少,表面疏水性降低。
2.4 冷冻时间对SPI巯基、二硫键和表面疏水性的影响
在冷冻温度为-18 ℃、SPI与水的质量比为1∶12的条件下,考察冷冻时间的变化对SPI的游离巯基、暴露巯基、二硫键和表面疏水性的影响。

图3 冷冻时间对SPI巯基、二硫键和表面疏水性的影响Fig.3 Effect of freezing time on the contents of sulfhydryl group and disulfide bond and surface hydrophobicity of SPI
由图3可知,与未冷冻SPI相比,冷冻后的SPI,游离巯基含量整体呈下降趋势。在其他冷冻参数恒定时,随着冷冻时间的延长,SPI游离巯基的含量减少,在冷冻72 h时,巯基含量比对照组减少了3/4,其含量为4.15 μmol/g,但是冷冻24 h时,游离巯基含量却出现比对照组略有增加的现象,其增幅不显著,可能是由于SPI在初期冷冻时,蛋白质体系不稳定,各种化学键和分子间作用力发生不同的变化,导致在冷冻时间较短的情况下,SPI的游离巯基含量会略高于对照组。
冷冻时间对SPI暴露巯基的影响与游离巯基相反,随着冷冻时间的延长,暴露巯基含量增加,冷冻时间延长到72 h时,暴露巯基含量达到了最大值为8.89 μmol/g,冷冻时间越短,暴露巯基含量越少,但都大于对照组的5.35 μmol/g的暴露巯基含量。
随着冷冻时间的延长,SPI的二硫键逐渐增加,其增幅不显著,冷冻24~72 h,SPI的二硫键含量从22.76 μmol/g增至25.08 μmol/g,其变化量只有2.32 μmol/g。而未冷冻SPI的二硫键含量18.63 μmol/g,经对比发现,冷冻时间对SPI二硫键影响不大。
在本实验考察的冷冻时间范围内,随着冷冻时间的增加,SPI的表面疏水性呈现先增加后减小的变化趋势。在冷冻时间分别为24、48、72 h时,表面疏水性分别是548.47、699.93和639.47,其中冷冻48 h时的表面疏水性最大,并且与冷冻24 h和72 h之间差异显著(P<0.05)。因为冷冻过程实际上就是对蛋白质结构破坏的过程,在适合的冷冻条件范围内,天然的蛋白分子折叠形成的疏水区域中的疏水性氨基酸侧链因冷冻破坏作用暴露在分子表面,实验结果得出,冷冻48 h时暴露疏水性基团最多,表面疏水性最大;当继续冷冻至72 h时,由于时间的延长,蛋白质的结构遭到进一步破坏,一部分表面巯基可能在储存时间延长的情况下发生氧化作用,形成表面二硫键,使得蛋白分子表面的疏水性基团减少,所以通过ANS荧光检测时,荧光强度变小,表面疏水性减小。
2.5 冷冻后大豆分离蛋白状态与结构的关系
大豆分离蛋白分散液经过冷冻贮存后,会出现不可逆的“絮凝”现象。这一现象的产生与SPI的巯基、二硫键和表面疏水性的变化密切相关。原因在于冷冻过程使得大豆分离蛋白发生不可逆变性,蛋白大分子空间三级、四级结构遭到严重破坏,蛋白分子展开,分子内二硫键断裂,分子表面的巯基重新分布,SPI与水分子结合并发生氧化作用,分子内二硫键形成分子间二硫键,由于SPI暴露出来的巯基与水分子的结合作用,使解冻后的SPI结构变得膨胀而松散,即形成了絮凝状态。
3 结 论
本实验对冷冻条件下SPI的结构变化进行研究,通过单因素实验分析了冷冻过程中SPI的巯基、二硫键及表面疏水性随SPI添加量、冷冻温度和冷冻时间的变化情况,由实验得出随SPI添加量减小、冷冻温度降低和冷冻时间的延长,SPI的巯基、二硫键、表面疏水性与未冷冻SPI相比均减小,其结构在不同因素水平之间差异较大。SPI与水的质量比为1∶8和1∶16时,二硫键含量分别取得最大和最小值,其值分别为28.54、18.66 μmol/g;冷冻温度为-12 ℃时,巯基和二硫键含量最大,表面疏水性较小,-18 ℃时,表面疏水性达到最大;冷冻24 h时SPI的游离巯基含量最大,冷冻72 h时,游离巯基含量最小为4.15 μmol/g。可知冷冻条件变化时,蛋白质的空间结构发生显著变化。
[1]王洪晶, 华欲飞.脱脂豆粕中不同脂肪氧合酶活力对大豆分离蛋白凝胶性质的影响[J].中国粮油学报, 2006, 21(5): 58-62.
[2]关志强, 宋小勇, 李敏.冻藏条件对蛤的蛋白质冷冻变性的影响及其改善的实验研究[J].食品科学, 2005, 26(9):166-169.
[3]黄鸿兵.冷冻及冻藏对猪肉冰晶形态及理化品质的影响[D].南京:南京农业大学, 2005: 16-24.
[4]石彦国, 任莉.大豆制品工艺学[M].北京: 中国轻工业出版社, 2001:98-104.
[5]PIKAL-CLELAND K A, RODRÍ GUEZ-HORNEDO N, AMIDON G L, et al.Protein denaturation during freezing and thawing in phosphate buffer systems: monomeric and tetramericβ-galactosidase[J].Archives of Biochemistry and Biophysics.2000, 384(2): 398-406.
[6]HOU D H, CHANG S K C.Structural characteristics of purified glycinin from soybeans stored under various conditions[J].Journal of Agricultural and Food Chemistry, 2004, 52(12): 3792-3800.
[7]ELLMAN G L.Tissue sulfhydryl groups[J].Archives of Biochemistry and Biophysics, 1959, 82(1): 70-77.
[8]BEVERIDGE T, TOMA S J, NAKAI S.Determination of SH and SS groups in some food proteins using Ellman’s reagent[J].Journal of Food Science, 1974, 39(1): 49-51.
[9]TANG C H.Thermal denaturation and gelation of vicilinrich protein isolates from threePhaseoluslegumes: a comparative study[J].LWYFood Science and Technology, 2008, 41(8): 1380-1388.
[10]WAGNER J R, SORGENTINI D A.Relation between solubility and surface hydrophobicity as an indicator of modifications during preparation processes of commercial and laboratory-prepares soy protein isolates[J].Journal of Agricultural and Food Chemistry, 2000,48: 3159-3165.
[11]莫重文, 马宇翔, 杨国龙.蛋白质化学与工艺性[M].北京: 化学工业出版社, 2007: 143-147.
[12]HUANG Youru, HUA Yufei, QIU Aiyong.Soybean protein aggregation induced by lipoxygenase catalyzed linoleic acid oxidation[J].Food Research International, 2006, 39: 240-249.
[13]陶红.金线鱼胃蛋白酶纯化鉴定及结构研究[D].广州: 华南理工大学, 2008: 35-41.
[14]HOU H D, CHANG K C.Structural characteristics of purified glycinin from soybeans stored under various conditions[J].Journal of Agricultural and Food Chemistry, 2004, 52(12): 3792-3800.
[15]WANG Xiansheng, TANG Chuanhe, LI Biansheng, et al.Effects of highpressure treatment on some physicochemical and functional properties of soy protein isolates[J].Food Hydrocolloids, 2008, 22(4): 560-567.
[16]姜巍巍.转谷氨酰胺酶对大豆蛋白表面疏水性及粘度的影响[D].哈尔滨: 东北农业大学, 2009: 40-46.
[17]NOH E J, PARK S Y, PAK J I, et al.Coagulation of soymilk and quality of tofu as affected by freeze treatment of soybeans[J].Food Chemistry, 2005, 91(4): 715-721.
[18]关志强, 宋小勇, 李敏.冻藏条件对蛤的蛋白质冷冻变性的影响及其改善的实验研究[J].食品科学, 2005, 26(9): 166-169.
[19]BENJAKUL S, VISESSANGUAN W, THONGKAEW C, et al.Comparative study on physicochemical changes of muscle proteins from some tropical fish during frozen storage[J].Food Research Internationa, 2003, 36(8): 787-795.
[20]王凤翼, 钱方.大豆蛋白质生产与应用[M].北京: 中国轻工业出版,2004: 80-81.
[21]HUANG Youru, HUA Yufei, QIU Aiyong.Soybean protein aggregation induced by lipoxygenase catalyzed linoleic acid oxidation[J].Food Research International, 2006, 39(2): 240-249.
[22]XIANG B Y.Effects of pulsed electric fields on structural modification and rheological properties for selected food proteins[D].Macdonald:McGill University, 2008: 36-47.
