HIF-1α、HIF-2α和MT在人甲状腺乳头状癌中的表达及其意义①
2014-02-05董超然刘智敏重庆医科大学分子医学与肿瘤研究中心重庆400016
王 旎 董超然 唐 萃 杨 磊 刘智敏 (重庆医科大学分子医学与肿瘤研究中心,重庆400016)
HIF-1α、HIF-2α和MT在人甲状腺乳头状癌中的表达及其意义①
王 旎 董超然 唐 萃 杨 磊 刘智敏 (重庆医科大学分子医学与肿瘤研究中心,重庆400016)
目的:探讨HIF-1α、HIF-2α和MT在人甲状腺乳头状癌中的表达及其意义。方法:采用免疫组化SP法检测70例人甲状腺乳头状癌组织和40例正常甲状腺组织中HIF-1α、HIF-2α和MT的表达水平,并分析这三种蛋白表达与临床病理指标的相关性及三者间的表达相关性。结果:在70例人甲状腺乳头状癌组织中,HIF-1α、HIF-2α和MT的阳性表达率分别为52.86%(37/70)、50.00%(35/70)和 44.29%(31/70)。HIF-1α、HIF-2α 和 MT 的表达与颈部淋巴结转移有显著相关性(P=0.034,P=0.022,P=0.032)。此外,HIF-1α 与 HIF-2α 的表达呈显著正相关(rs=0.258,P=0.031),HIF-1α 与 MT 的表达呈显著正相关(rs=0.266,P=0.026),HIF-2α 与 MT的表达呈显著正相关(rs=0.259,P=0.030)。两种蛋白(HIF-1α/ HIF-2α,HIF-1α/MT,HIF-2α/MT)联合表达较一种蛋白表达与颈部淋巴结转移更具相关性(HIF-1α/HIF-2α:P=0.004,HIF-1α/MT:P=0.024,HIF-2α/MT:P=0.029)。HIF-1α、HIF-2α和MT三种蛋白联合表达较两种或一种蛋白表达与颈部淋巴结转移更具有相关性(P=0.017)。结论:HIF-1α、HIF-2α和MT在人甲状腺乳头状癌组织中的表达与颈部淋巴结转移密切相关,且三者的表达密切相关,HIF-1α、HIF-2α和MT在人甲状腺乳头状癌中的表达情况可作为监测甲状腺乳头状癌颈部淋巴结转移的指标。
甲状腺乳头状癌;HIF-1α;HIF-2α;MT
低氧是实体肿瘤常见的一种微环境,并在肿瘤进展的不同阶段发挥核心作用[1]。肿瘤细胞对低氧的反应主要是由低氧诱导因子1(Hypoxia inducible factor-1,HIF-1)调节的。HIF-1是由HIF-1α和HIF-1β两个亚基构成的,其中HIF-1β是组成性表达,而HIF-1发挥作用主要是由HIF-1α亚基的活性决定的。HIF-2α与HIF-1α具有高度的同源性,它们主要激活参与细胞增殖、细胞代谢、血管生成和肿瘤转移的基因。金属硫蛋白(Metallothioneins,MTs)是一类富含半胱氨酸的非酶类金属结合蛋白质家族,在细胞增殖、分化和凋亡过程中发挥着重要的作用,并且与肿瘤的发生发展有着密切关系。
甲状腺癌是内分泌系统最常见的恶性肿瘤,占全身恶性肿瘤的1%~2%,其中甲状腺乳头状癌是最常见的一种类型。目前,有关HIF-1α、HIF-2α和MT在人甲状腺乳头状癌组织中的表达及其与临床病理特征的相关性研究报道甚少,本实验通过采用免疫组化SP法检测70例人甲状腺乳头状癌标本和40例正常甲状腺组织中 HIF-1α、HIF-2α和MT的表达情况,并结合临床病理资料分析它们与临床病理因素的关系及三者表达的相关性,进而探讨HIF-1α、HIF-2α和MT能否作为监测甲状腺乳头状癌进展的指标。
1 材料与方法
1.1 材料 收集重庆医科大学附属第二医院外科2010年1月~2011年10月手术后经病理诊断为甲状腺乳头状癌的组织标本共70例和癌旁正常甲状腺组织共40例。依据国际抗癌联盟(UICC)分期标准:其中,Ⅰ期30例,Ⅱ期12例,Ⅲ期28例,Ⅳ期0例;23人无颈部淋巴结转移,47人有颈部淋巴结转移;男性14人,女性56人;患者年龄13~79岁,平均年龄41岁。肿瘤平均直径为 2.4 cm(0.3~6.0 cm)。
1.2 主要试剂 兔抗人HIF-1α多克隆抗体为Bioworld公司产品。兔抗人HIF-2α多克隆抗体和鼠抗人MT单克隆抗体为Abcam公司产品。兔抗人IgG多克隆抗体为Millipore公司产品。免疫组化SP法试剂盒和DAB试剂盒均购于北京中杉金桥公司。
1.3 实验方法 采用链霉亲和素-过氧化物酶法(Streptavidin-Perosidase,SP)。标本均经10%甲醛固定,石蜡包埋及4 μm连续切片,切片分别作HE染色与免疫组化染色。石蜡切片经二甲苯脱蜡2 h,梯度酒精水化。热修复后滴加3%过氧化氢,室温30 min,阻断内源性过氧化物酶。磷酸盐缓冲液(PBS)洗3次,每次5 min。10%山羊血清孵育30 min,PBS洗3次,每次5 min。滴加1∶50稀释的兔抗人HIF-1α和兔抗人 HIF-2α多克隆抗体(Bioworld Technology,USA)和1∶100稀释的鼠抗人MT单克隆抗体(Abcam,USA)稀释液,于4℃过夜。室温复温30 min后,PBS洗3次。滴加生物素化山羊抗兔二抗和生物素化山羊抗鼠二抗,37℃孵育30 min,PBS洗3次。滴加过氧化物酶-链霉亲和素复合物(streptavidin-HRP),室温孵育30 min,PBS洗3次。加入氢化二氨基联苯胺过氧化物酶(DAB)显色液,光学显微镜下控制显色,自来水冲洗终止显色。苏木素复染,常规脱水,透明,中性树胶封片。用已知阳性切片作阳性对照,用兔抗人IgG多克隆抗体替代一抗作阴性对照。
1.4 结果判定 免疫组化染色半定量评分标准包括染色强度和阳性细胞数百分比。强度分为0(未染色)、1(弱染色)、2(中度染色)和3(强染色),阳性细胞数百分比0(<5%阳性细胞)、1(6% ~25%阳性细胞)、2(26% ~50%阳性细胞)、3(51% ~75%阳性细胞)和4(>75%阳性细胞)。将强度得分与阳性细胞数百分比得分相乘得到最终的染色评分:0(未染色)、+(1~4)、++(5~8)和 +++(9~12)。0或+为阴性组,++或+++为阳性组。
1.5 统计学分析 应用SPSS 18.0统计软件对数据进行统计学处理。采用χ2检验和Spearman等级相关分析,P<0.05具有统计学意义。
2 结果
2.1 HIF-1α、HIF-2α 和 MT 在甲状腺乳头状癌组织中的表达及其与临床病理特征的相关性 在40例正常甲状腺组织中,HIF-1α、HIF-2α和 MT阳性表达率均为0,组织中极少量染色细胞(如图1A、B、C)。在70例甲状腺乳头状癌组织中,HIF-1α、HIF-2α和 MT阳性表达率分别为52.86%(37/70)、50.00%(35/70)和44.29%(31/70),三者在胞浆和胞核均有表达(如图1D、G,E、H,F、I)。经 Spearman等级相关分析,由表1可知,HIF-1α、HIF-2α和MT的阳性表达在甲状腺乳头状癌组织和正常甲状腺组织中具有统计学差异(P<0.05)。与此同时,HIF-1α、HIF-2α和MT的阳性表达与颈部淋巴结转移有显著相关性(P<0.05),与年龄、性别、肿瘤大小及TNM分期无显著相关性(P>0.05)。
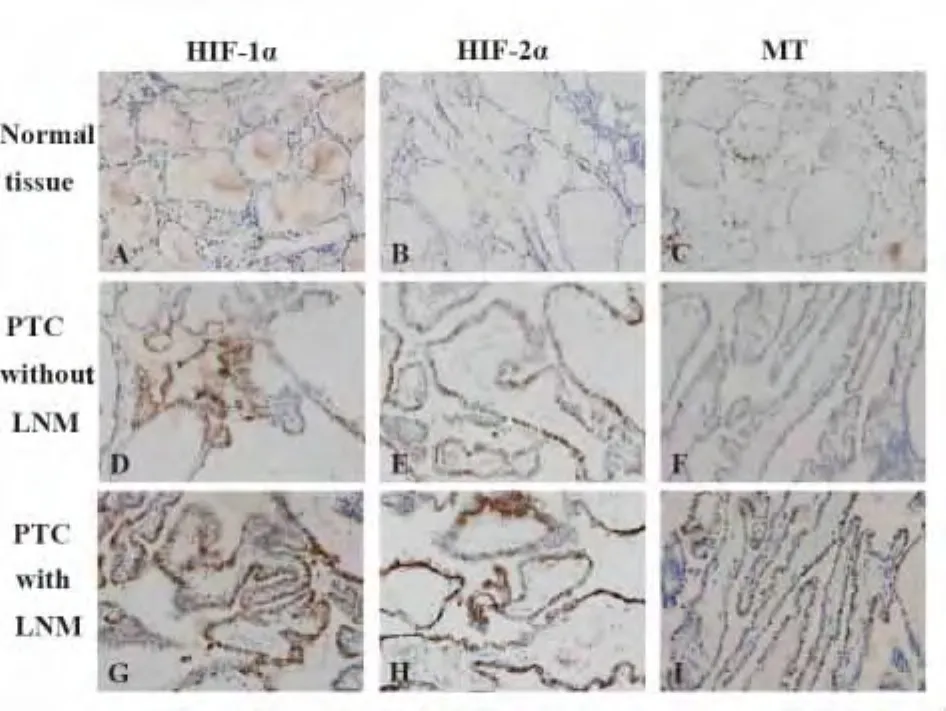
图1 HIF-1α、HIF-2α和MT在正常甲状腺组织和甲状腺乳头状癌组织中的表达(SP法,×400)Fig.1 Expression of HIF-1α,HIF-2α and MT in normal thyroid tissues and papillary thyroid carcinoma tissues(SP method,×400)
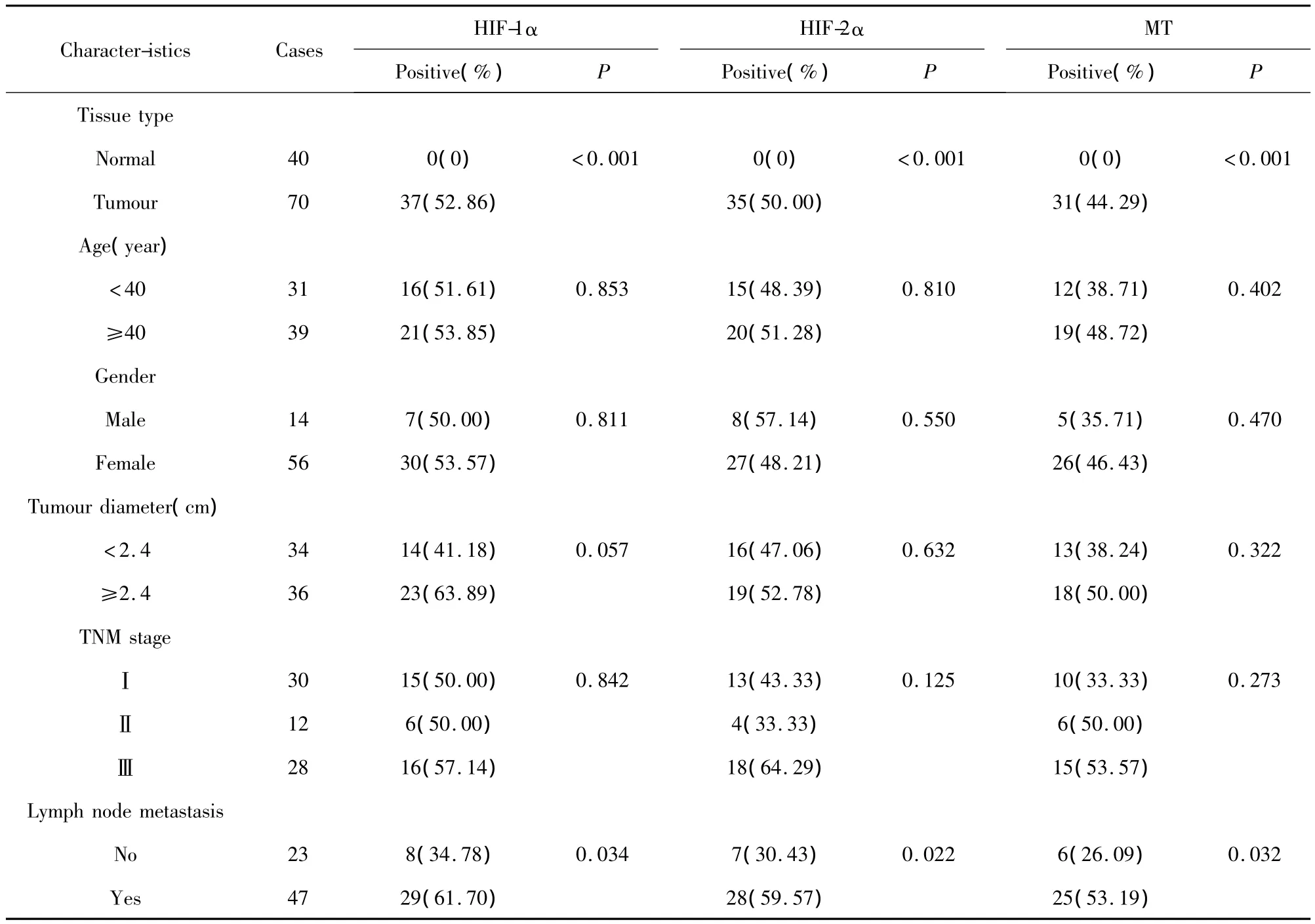
表1 HIF-1α、HIF-2α和MT在甲状腺乳头状癌中的表达及其与临床病理特征的相关性Tab.1 Correlation of HIF-1α,HIF-2α and MT expression with clinicopathological characteristics in papillary thyroid carcinoma

表2 HIF-1α、HIF-2α和MT在人甲状腺乳头状癌中表达的相关性Tab.2 Correlation of HIF-1α,HIF-2α and MT protein expression with one another in 129 PTCs
2.2 HIF-1α、HIF-2α 和 MT 在人甲状腺乳头状癌组织中表达的相关性 经Spearman等级相关分析,由表2可知,在70例甲状腺乳头状癌组织标本中,HIF-1α与 HIF-2α蛋白表达呈显著正相关(rs= 0.258,P=0.031),HIF-1α 与 MT蛋白表达呈显著正相关(rs=0.266,P=0.026),HIF-2α 与 MT 蛋白表达呈显著正相关(rs=0.259,P=0.030)。
2.3 人甲状腺乳头状癌组织中HIF-1α、HIF-2α和MT联合表达与颈部淋巴结转移的相关性 由于HIF-1α、HIF-2α和MT两两蛋白分子间的表达具有正相关性,而统计分析表明,HIF-1α、HIF-2α和MT表达与颈部淋巴结转移具有显著相关性,我们进一步分析 HIF-1α/HIF-2α、HIF-1α/MT 和 HIF-2α/MT两种分子同时表达与颈部淋巴结转移是否具有统计学相关性。如表3所示,HIF-1α/HIF-2α两种分子同时表达的颈部淋巴结转移发生率(91.30%)比仅有其中一种分子表达的颈部淋巴结转移发生率(53.85%)高,类似的结果还见于 HIF-1α/MT和HIF-2α/MT的分子表达中。HIF-1α/HIF-2α、HIF-1α/MT和HIF-2α/MT两种分子同时表达较仅有其中一种分子表达与颈部淋巴结转移具有更为显著的相关性(HIF-1α/HIF-2α:P=0.004,HIF-1α/MT: P=0.024,HIF-2α/MT:P=0.029)。此外,统计分析表明三种分子同时表达较两种分子或仅有其中一种分子表达与颈部淋巴结转移具有更为显著的相关性(P=0.017)。

表3 人甲状腺乳头状癌组织中HIF-1α、HIF-2α和MT联合表达与颈部淋巴结转移的相关性Tab.3 Correlation of concomitant expression of HIF-1α,HIF-2α and MT with cervical lymph node metastasis
3 讨论
甲状腺乳头状癌约占甲状腺恶性肿瘤的80%,其特点是生长缓慢,预后良好。然而,在某些患者中早期就表现出颈部淋巴结转移或远处转移,这往往是导致其不良预后和死亡的主要原因。虽然颈部淋巴结转移并不直接影响甲状腺乳头状癌患者的生存率,但它会增加肿瘤局部复发率和再次手术的机会。国外研究者认为,有颈部淋巴结转移者是无颈部淋巴结转移者复发率和死亡率的30倍[2]。因此,甲状腺乳头状癌颈部淋巴结转移的早期诊断,对指导制定治疗方案以提高临床诊治水平具有重要意义。
实体肿瘤在发生发展过程中普遍处于低氧微环境中,并对缺氧做出一系列的应激反应。肿瘤细胞在缺氧条件下,HIF-1α与HIF-2α的稳定性增加,导致转录因子HIF-1与HIF-2活性增高,进而促进血管生成及肿瘤侵袭转移相关靶基因的转录和翻译[3],促进肿瘤发生发展。MT作为HIF-1的靶基因之一,HIF-1激活可诱导MT表达上调,而MT的过表达与肿瘤细胞过度增生有关[4];另一方面,MT表达上调可增加HIF-1的稳定性,进而增强HIF-1的转录活性[5],两者表现出相互促进作用。HIF-2α与HIF-1α结构相似,推测两者也可能存在相互促进作用。研究表明,HIF-1α在卵巢癌、食管癌和头颈部癌组织中高表达[6-8];HIF-2α在肾透明细胞癌和神经母细胞瘤中表达上调[9,10];MT 在肾、肺、乳腺、前列腺、睾丸、卵巢、膀胱、宫颈、子宫内膜等多种实体肿瘤中表达增加[11,12]。这三种分子在肿瘤组织中表达上调与肿瘤病人的不良预后相关[6-12]。
本研究通过检测70例甲状腺乳头状癌组织中HIF-1α、HIF-2α和MT的表达情况,三种蛋白在甲状腺乳头状癌组织中的表达明显高于正常甲状腺组织(P<0.05)。在70例甲状腺乳头状癌组织中,HIF-1α、HIF-2α和MT的过表达与患者的年龄、性别、肿瘤大小及TNM分期无明显相关性,而与颈部淋巴结转移显著相关(P<0.05)。Spearman等级相关分析提示:HIF-1α与HIF-2α、HIF-1α与MT以及HIF-2α与MT的表达均呈显著正相关(P<0.05),这表明HIF-1α、HIF-2α和MT在甲状腺乳头状癌的发展过程可能具有相互协同作用。
鉴于HIF-1α、HIF-2α和MT的表达与颈部淋巴结转移有关,且三种蛋白两两间存在正相关性。本研究对HIF-1α、HIF-2α和MT两两阳性表达是否与颈部淋巴结转移具有显著相关性进行了进一步分析。结果显示:HIF-1α与 HIF-2α、HIF-1α与 MT、HIF-2α与MT两种蛋白同时表达较仅有其中一种分子表达与颈部淋巴结转移具有更为显著的相关性。三种分子同时表达较两种分子或仅有其中一种分子表达与颈部淋巴结转具有更为显著的相关性。通过本实验及相关文献,在甲状腺乳头状癌中肿瘤低氧微环境可通过激活HIF-1α与HIF-2α上调MT的表达;另一方面,MT可以增加HIF-1α与HIF-2α的稳定性,进而增强HIF-1和HIF-2的转录活性,同时增强肿瘤的侵袭与转移能力,但其分子机制有待进一步研究。
通过本次实验,可初步认为HIF-1α、HIF-2α和MT在甲状腺乳头状癌中的表达情况可作为监测其发展的指标,联合检测HIF-1α、HIF-2α和MT在甲状腺乳头状癌中的表达,可为临床早期诊断发现颈部淋巴结转移提供生物学指标。
[1]Gordan JD,Simon MC.Hypoxia-inducible factors:central regulators of the tumour phenotype[J].Curr Opin Genet Dev,2007,17(1):71-77.
[2]Mazzaferri EL.A vision for the surgical management of papillary thyroid carcinoma:extensive lymph node compartmental dissections and selective use of radioiodine[J].J Clin Endocrinol Metab,2009,94(4):1086-1088.
[3]Dehne N,Fuhrmann D,Brune B.Hypoxia-inducible factor (HIF)in hormone signaling during health and disease[J].Cardiovasc Hematol Agents Med Chem,2013,11(2):125-135.
[4]Murphy BJ,Kimura T,Sato BG,et al.Metallothionein induction by hypoxia involves cooperative interactions between metal-responsive transcription factor-1 and hypoxia-inducible transcription factor-1 alpha[J].Mol Cancer Res,2008,6(3):483-490.
[5]Kojima I,Tanaka T,Inagi R,et al.Metallothionein is upregulated by hypoxia and stabilizes hypoxia-inducible factor in the kidney[J].Kidney Int,2009,75(3):268-277.
[6]Burrows N,Resch J,Cowen RL,et al.Expression of hypoxia-inducible factor 1 alpha in thyroid carcinoma[J].Endocr-Relat Cancer,2010,17(1):61-72.
[7]Mo JH,Choi IJ,Jeong WJ,et al.HIF-1α and HSP90:target molecules selected from a tumorigenic papillary thyroid carcinoma cell line[J].Cancer Sci,2012,103(3):464-471.
[8]Lu X,Kang Y.Hypoxia and hypoxia-inducible factors:master regulators of metastasis[J].Clin Cancer Res,2010,16(24): 5928-5935.
[9]Raval RR,Tran MG,Sowter HM,et al.Contrasting properties of hypoxia-inducible factor 1(HIF-1)and HIF-2 in von Hippel-Lindau-associated renal cell carcinoma[J].Mol Cell Biol,2005,25 (13):5678-5686.
[10]Holmquist-Mengelbier L,Lofstedt T,Noguera R,et al.Recruitment of HIF-1 alpha and HIF-2 alpha to common target genes is differentially regulated in neuroblastoma:HIF-2 alpha promotes an aggressive phenotype [J].Cancer Cell,2007,10(5): 413-423.
[11]Pedersen MO,Larsen A,Stolenberg M,et al.The role of metallothionein in oncogenesis and cancer prognosis[J].Prog Histochem Cytochem,2009,44(1):29-64.
[12]Eckschlager T,Adam V,Hrabeta J,et al.Metallothioneins and cancer[J].Curr Protein Pept Sci,2009,10(4):360-375.
[收稿2013-10-02 修回2013-12-09]
(编辑 许四平)
Expression and significance of HIF-1α,HIF-2α and MT in human papillary thyroid carcinoma
WANG Ni,DONG Chao-Ran,TANG Cui,YANG Lei,LIU Zhi-Min.Molecular Medicine and Cancer Research Center,Chongqing Medical University,Chongqing 400016,China
Objective:To investigate the expression of HIF-1α,HIF-2α and MT in human papillary thyroid carcinoma(PTC) and the association of their expression with clinicopathological indicators.MethodsImmunohistochemistry was used to analyze the expression of HIF-1α,HIF-2α and MT in 70 PTC samples.The correlations of HIF-1α,HIF-2α and MT expression with one another,and with several clinicopathological indicators were statistically analyzed.ResultsIn 70 PTC samples,the positive expression rates of HIF-1α,HIF-2α and MT were 52.86%(37/70),50.00%(35/70)and 44.29%(31/70),respectively.HIF-1α,HIF-2α and MT expression had significant correlations with cervical lymph node metastasis(P=0.034,P=0.022,and P=0.032,respectively).Meanwhile,HIF-1α expression had a positive correlation with HIF-2α (rs=0.258,P=0.031)and MT(rs=0.266,P=0.026).HIF-2α and MT expression were positively correlated(rs=0.259,P=0.030).Concomitant expression of any two or all of the three molecules had stronger correlation with lymph node metastasis than did each alone(P=0.004 for HIF-1α/HIF-2α,P=0.024 for HIF-1α/MT,P=0.029 for HIF-2α/MT,P=0.017 for HIF-1α/HIF-2α/MT).ConclusionHIF-1α,HIF-2α and MT expression in PTC samples have a closely correlation,which are related to cervical lymph node metastasis.Therefore,the expression of HIF-1α,HIF-2α and MT might be used as biomarkers for cervical lymph node metastasis of PTC.
Papillary thyroid carcinoma;HIF-1α;HIF-2α;MT
R736.1
A
1000-484X(2014)05-0662-05
10.3969/j.issn.1000-484X.2014.05.020
①本文受国家自然科学基金面上项目(81072183)、重庆市自然科学基金重点项目(CSTC,2011BA5038)、国家留学人员科技活动启动项目(渝人社办,2011.235号)和重庆医科大学重点科研课题(XBZD201002)资助。
王 旎(1987年-),女,主要从事乳头状甲状腺癌转移机制的研究,E-mail:cqwangni@qq.com。
及指导教师:刘智敏(1962年-),女,博士,教授,硕士生导师,主要从事甲状腺癌方面的研究,E-mail:liuzm9999@aliyun.com。
·临床免疫学·
