小儿激素敏感型肾病综合征血清中IL-4、IL-5、TGF-β与IL-10水平变化及意义
2014-02-05周发为游文忠覃仕锋唐生尧湖北民族学院附属民大医院检验科恩施445000
周发为 游文忠 覃仕锋 唐生尧 (湖北民族学院附属民大医院检验科,恩施 445000)
小儿激素敏感型肾病综合征血清中IL-4、IL-5、TGF-β与IL-10水平变化及意义
周发为 游文忠①覃仕锋 唐生尧 (湖北民族学院附属民大医院检验科,恩施 445000)
目的:探讨小儿激素敏感型肾病综合征(SSNS)治疗前与恢复期Th2细胞相关细胞因子IL-4、IL-5和Treg T细胞相关细胞因子TGF-β、IL-10水平的变化。方法:纳入36例SSNS患儿在治疗前和缓解期以及匹配的18例健康体检儿童,采用ELISA方法检测其血清IL-4、IL-5、TGF-β和IL-10水平,分析其水平变化与各临床指标的相关性。结果:SSNS患儿治疗前血清IL-4、IL-5显著高于缓解期以及健康对照组(P<0.01),肾病治疗前的血清TGF-β显著低于缓解期以及健康对照组(P<0.01),而各组之间的血清IL-10水平差异无统计学意义(P>0.05);SSNS治疗前的血清IL-4水平与血清白蛋白水平负相关(R2= -0.694,P=0.000);与血清胆固醇呈正相关(R2=0.658,P=0.000);血清 TGF-β 表达水平与血白蛋白呈正相关(R2=0.838,P=0.000),与血清胆固醇呈负相关(R2= -0.722,P=0.000)。结论:肾病综合征患儿血清 IL-4、IL-5 升高以及TGF-β水平降低与SSNS发病有关。
肾病综合征;激素敏感型;儿童;IL-4;IL-5;TGF-β;IL-10
肾病综合征(Nephrotic syndrome,NS)是儿童最常见的肾小球疾病,其中90%以上为原发性肾病综合征(Primary nephrotic syndrome,PNS)[1]。85% 以上的PNS患儿病理类型为微小病变型[1],而该型在90%以上的儿童对糖皮质激素治疗敏感[2]。PNS病因尚未完全明了,已有研究表明,其与体液免疫紊乱、异常的 T细胞反应与 Th2细胞因子关系密切[3-5]。Th2细胞以及巨噬细胞的激活与PNS发病密切相关,Th2细胞相关细胞因子可引起肾小球毛细血管壁的糖蛋白发生改变[4,6]。此外,近期研究表明,Treg T细胞功能失调是成人微小病变型NS发病的潜在因素[7]。本研究首次同时检测了小儿激素敏感型肾病综合征(Steroid-sensitive nephrotic syndrome,SSNS)治疗前与缓解期外周血血清中Th2相关细胞因子IL-4、IL-5,Treg T细胞相关的细胞因子TGF-β、IL-10的变化,分析其与血清白蛋白、胆固醇等临床指标的相关性,以期为小儿激素敏感型NS的发病机制与诊治提供科学依据。
1 资料与方法
1.1 研究对象 选择2010年1月至2012年12月间我院儿科住院的SSNS患儿36例;诊断符合我国最新的《儿童常见肾脏疾病诊治循证指南:激素敏感、复发/依赖肾病综合征诊治循证指南》[1]。所有病例均是初诊病例,之前未接受糖皮质激素或免疫抑制剂治疗,排除了继发性肾病、感染、肝功能异常以及免疫性疾病、内分泌疾病等。确诊肾病综合征后给予泼尼松[2 mg/(kg·d)]治疗。足量泼尼松治疗≤4周蛋白尿转阴者为SSNS;水肿等临床症状消失,连续3 d以上蛋白尿转阴为缓解期。
SSNS组平均年龄为6.23岁,最小18个月,最大12岁3个月;男女比例为7∶5;平均身高110.8 cm (85.5 ~150.7 cm),平均体重22.5 kg(12.1 ~32.7 kg),血压平均值95/60 mmHg(85/55~115/70 mm-Hg)。选择2011年1月至2011年6月在我院儿科门诊健康体检儿童18例为健康对照组。健康对照组平均年龄为5.98岁,最小25个月,最大11岁10个月;男女比例为17∶7;平均身高114.2 cm(87.4 ~142.6 cm),平均体重 22.5 kg(12.8 ~31.5 kg),血压平均值105/65 mmHg(86/50~120/80 mmHg)。两组之间的性别、年龄、身高、体重等无统计学差异,具有可比性。本研究经过湖北民族学院附属民大医院伦理委员会审批,所有入选对象的家属知情并同意。
1.2 观察指标及样本采集 记录所有研究对象的年龄、性别、身高、体重、血压等情况,留取研究对象的清晨空腹血标本,均进行血常规、肝功、肾功、离子、心肌酶、免疫球蛋白、CRP以及抗O的检测。其中SSNS组在泼尼松治疗后缓解期蛋白尿转阴后1周内复测上述指标。SSNS组保留治疗前以及缓解期血清,置于-70℃保存,待检测细胞因子。
1.3 免疫球蛋白以及细胞因子检测方法 免疫球蛋白IgG、IgA、IgM采用OLYMPUS AU640型全自动生化分析仪检测,试剂盒为温州伊利康生物技术有限公司。IL-4、IL-5、IL-10以及TGF-β均采用ELISA法检测,ELISA试剂盒购自美国R&D公司;严格按照试剂盒说明书进行检测。
2 结果
2.1 SSNS血清白蛋白、胆固醇、免疫球蛋白水平SSNS组治疗前与缓解期的肝功、血脂检测结果表明,活动期血清白蛋白水平显著下降、胆固醇水平明显升高;而缓解期白蛋白和胆固醇水平逐渐恢复正常,与健康对照组无统计学差异。免疫球蛋白检测结果表明,活动期IgG及IgA水平显著降低,而缓解期IgG及IgA水平与健康对照组有统计学差异(P<0.05)。活动期IgM与缓解期、健康对照组的IgM水平无统计学差异(P>0.05)。结果如表1所示。
2.2 SSNS细胞因子变化 SSNS组活动期与缓解期的 IL-4、IL-5、IL-10以及TGF-β检测结果表明,肾病活动期的血清IL-4、IL-5显著高于缓解期以及健康对照组(P<0.01);与健康对照组比,缓解期血清IL-4、IL-5水平差异无统计学意义(P>0.05)。而各组之间的血清IL-10水平差异无统计学意义(P>0.05)。肾病活动期的血清TGF-β显著低于缓解期以及健康对照组(P<0.01),与健康对照组比,缓解期血清TGF-β水平差异无统计学意义(P>0.05)。结果如表1所示。
表1 SSNS组和对照组的白蛋白、胆固醇、免疫球蛋白及细胞因子水平(±s)Tab.1 Levels of albumin,cholesterol,immunoglobulin and cytokines of in serum of SSNS and control group( ± s)
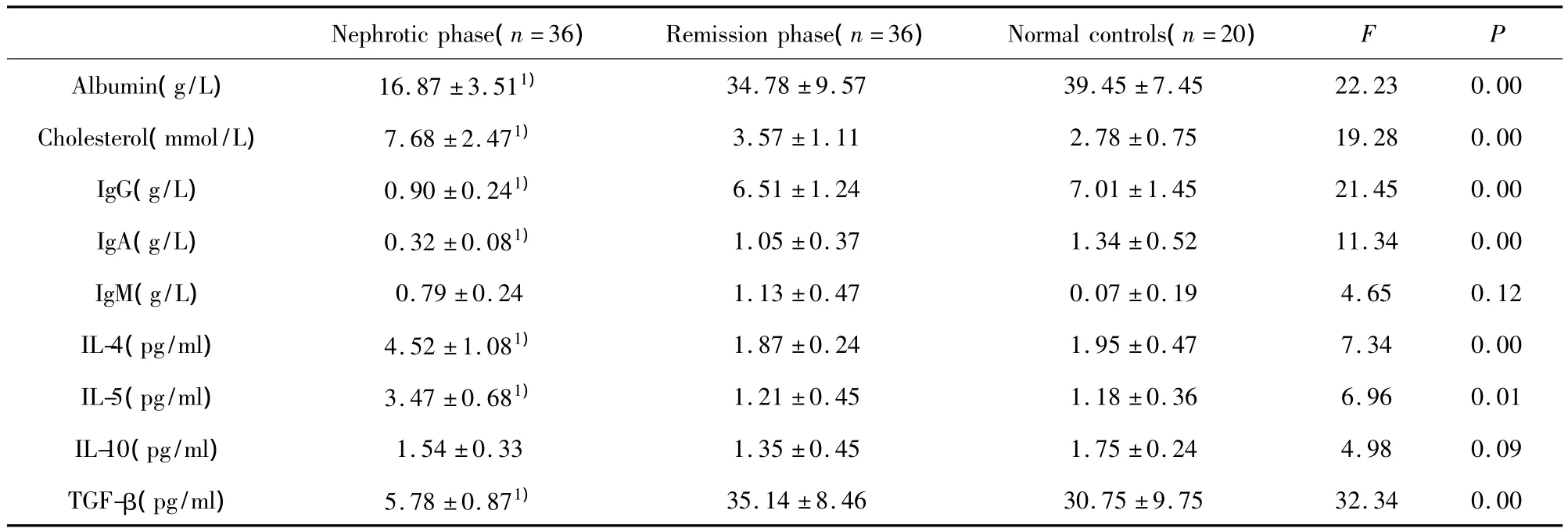
表1 SSNS组和对照组的白蛋白、胆固醇、免疫球蛋白及细胞因子水平(±s)Tab.1 Levels of albumin,cholesterol,immunoglobulin and cytokines of in serum of SSNS and control group( ± s)
Note:Compared to remission phase of SSNS,1)P <0.05.
Nephrotic phase(n=36) Remission phase(n=36) Normal controls(n=20)F P 35.14 ±8.46 30.75 ±9.75 32.34 0.00 34.78 ±9.57 39.45 ±7.45 22.23 0.00 Cholesterol(mmol/L) 7.68 ±2.471) 3.57 ±1.11 2.78 ±0.75 19.28 0.00 IgG(g/L) 0.90 ±0.241) 6.51 ±1.24 7.01 ±1.45 21.45 0.00 IgA(g/L) 0.32 ±0.081) 1.05 ±0.37 1.34 ±0.52 11.34 0.00 IgM(g/L) 0.79 ±0.24 1.13 ±0.47 0.07 ±0.19 4.65 0.12 IL-4(pg/ml) 4.52 ±1.081) 1.87 ±0.24 1.95 ±0.47 7.34 0.00 IL-5(pg/ml) 3.47 ±0.681) 1.21 ±0.45 1.18 ±0.36 6.96 0.01 IL-10(pg/ml) 1.54 ±0.33 1.35 ±0.45 1.75 ±0.24 4.98 0.09 TGF-β(pg/ml) 5.78 ±0.871) Albumin(g/L) 16.87 ±3.511)
2.3 SSNS活动期的细胞因子与血清白蛋白、血胆固醇的相关性 线性回归分析结果表明,SSNS活动期的血清IL-4水平与血清白蛋白水平负相关(R2=-0.694,P=0.000);与血清胆固醇呈正相关(R2= 0.658,P=0.000);见图 1;血清 TGF-β 表达水平与血白蛋白呈正相关(R2=0.838,P=0.000),与血胆固醇呈负相关(R2= -0.722,P=0.000)见图2。血清IL-5表达水平与血白蛋白、胆固醇无显著相关性(分别为:R2=0.091,P=0.599;R2= -0.151,P= 0.378);血清IL-10表达水平与血白蛋白、胆固醇无显著相关性(分别为:R2= -0.115,P=0.504;R2=-0.54,P=0.753)。
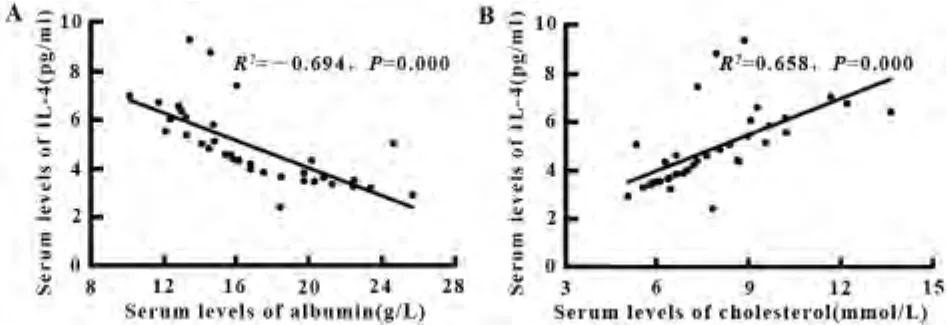
图1 线性回归分析血清IL-4水平和白蛋白(A)、胆固醇(B)水平的相关性Fig.1 Correlations between serum IL-4 and albumin levels(A)and cholesterol levels(B)by linear regression analysis
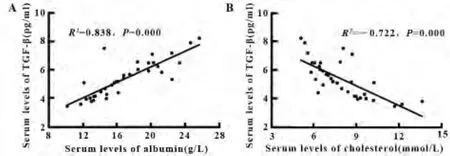
图2 线性回归分析血清TGF-β水平和白蛋白(A)、胆固醇(B)水平的相关性Fig.2 Correlations between TGF-β and albumin levels (A)and cholesterol levels(B)by linear regression analysis
3 讨论
NS发病机制复杂,与免疫因子、免疫紊乱有关[3-5]。研究证实,NS的Th1/Th2细胞平衡倾向于Th2表型方向[4]。IL-4、IL-5是 Th2 细胞分泌的重要细胞因子。本研究中治疗前IL-4、IL-5水平显著升高,而缓解期下降;而且IL-4与血清白蛋白水平呈负相关,与血清胆固醇水平呈正相关。相关研究证实,IL-4可与IL-4受体结合,作用于肾小球内皮细胞,维护肾小球渗透性[8]。分析IL-4可能与肾病综合征的蛋白尿产生有关,是肾病综合征疾病活动性、严重程度的判断的标志物之一。在 Ohtomo等[9]研究中,靶向抑制IL-4、IL-5分泌的药物能有效减少SSNS激素用量。也有研究证实,肾病综合征的治疗前血清IL-5水平高于缓解期[4]。
Treg细胞是一类具有免疫抑制作用的T细胞亚群,通过释放IL-10、TGF-β等发挥抗炎作用以及维持自身免疫耐受功能[10]。本研究表明,SSNS治疗前与缓解期、健康对照组的血清IL-10水平差异无统计学意义(P>0.05);而SSNS活动期的血清TGF-β显著低于缓解期以及健康对照组(P<0.01),与健康对照组比,缓解期血清TGF-β水平差异无统计学意义(P>0.05)。动物实验证明,Treg细胞功能紊乱和急性肾损伤等肾病有关[11,12]。局部Treg细胞比例减少导致组织炎症,与蛋白尿和肾病综合征启动有关[13]。成人肾病综合征Th17/Treg比例增加,血清TGF-β水平升高与尿蛋白增加、血白蛋白下降有关,在肾脏表现出促炎、促纤维化的作用[14]。蛋白尿增加促进TGF-β分泌,调节细胞外基质,导致肾小球硬化、肾间质纤维化[15]。另一方面,有研究证实,血清的低水平TGF-β、IL-10可通过增加Treg细胞的比例对肾脏产生保护作用[7]。本研究中,SSNS治疗前的血清TGF-β表达水平与血清白蛋白呈正相关(R2=0.838,P=0.000),与血清胆固醇呈负相关,也提示TGF-β可能是SSNS的保护因素。
总之,SSNS治疗前Th2相关细胞因子IL-4、IL-5显著升高,Treg T细胞相关的细胞因子TGF-β显著下降;且IL-4与血清白蛋白呈负相关,与血清胆固醇呈正相关;TGF-β与血清白蛋白呈正相关,与血清胆固醇呈负相关,这提示IL-4、IL-5与 TGF-β参与了SSNS的发病过程。
[1]中华医学会儿科学分会肾脏病学组.儿童常见肾脏疾病诊治循证指南(一):激素敏感、复发/依赖肾病综合征诊治循证指南(试行)[J].中华儿科杂志,2009,47(3):167-170.
[2]Ulinski T,Aoun B.Pediatric idiopathic nephrotic syndrome: Treatment strategies in steroid dependent and steroid resistant forms[J].Current Medicinal Chemistry,2010,17(9): 847-853.
[3]丁 楠,郝 丽,黎 淮,等.原发性肾病综合征患者免疫指标变化的临床意义探讨[J].中国免疫学杂志,2011,27(4): 356-359,381.
[4]Kanai T,Shiraishi H,Yamagata T,et al.Th2 cells predominate in idiopathic steroid-sensitive nephrotic syndrome[J].Clinical and Experimental Nephrology,2010,14(6):578-583.
[5]Ohta K,Shimizu M,Yokoyama T,et al.Evaluation of t-cell receptor diversity in pediatric patients with minimal change nephrotic syndrome[J].Clinical Nephrology,2012,77(4):296-304.
[6]Le Berre L,Herve C,Buzelin F,et al.Renal macrophage activation and th2 polarization precedes the development of nephrotic syndrome in buffalo/mna rats[J].Kidney Int,2005,68(5): 2079-90.
[7]Liu LL,Qin Y,Cai JF,et al.Th17/treg imbalance in adult patients with minimal change nephrotic syndrome[J].Clin Immunol,2011,139(3):314-320.
[8]Van den Berg JG,Aten J,Chand MA,et al.Interleukin-4 and interleukin-13 act on glomerular visceral epithelial cells[J].J Am Soci Nephrol,2000,11(3):413-422.
[9]Ohtomo Y,Fujinaga SI,Hattori M.Suplatast tosilate dimethylsulfonium treatment for steroid-dependent nephrotic syndrome[J].Pediatrics International,2005,47(2):230-231.
[10]Weaver CT,Hatton RD.Opinion interplay between the t(h)17 and t-reg cell lineages:A(co-)evolutionary perspective[J].Nature Reviews Immunology,2009,9(12):883-889.
[11]Wang YM,McRae JL,Robson SC,et al.Regulatory t cells participate in cd39-mediated protection from renal injury[J].Eur J Immunol,2012,42(9):2441-2451.
[12]Monteiro RMM,Camara NOS,Rodrigues MM,et al.A role for regulatory t cells in renal acute kidney injury[J].Trans Immunol,2009,21(1):50-55.
[13]Shao XS,Yang XQ,Zhao XD,et al.The prevalence of th17 cells and foxp3 regulate t cells(treg)in children with primary nephrotic syndrome [J].Pediatric Nephrol,2009,24(9): 1683-1690.
[14]de Mik SML,Hoogduijn MJ,de Bruin RW,et al.Pathophysiology and treatment of focal segmental glomerulosclerosis:The role of animal models[J].BMC Nephrol,2013,14(1):74.
[15]Qi W,Chen XM,Holian J,et al.Transforming growth factor-beta(1)differentially mediates fibronectin and inflammatory cytokine expression in kidney tubular cells[J].Am J Physiol-Renal Physiol,2006,291(5):1070-1077.
[收稿2013-11-21]
(编辑 张晓舟)
ChangesofIL-4,IL-5,TGF-β and IL-10 in pediatricsteroid-sensitive nephrotic syndrome
ZHOU Fa-Wei,YOU Wen-Zhong,TAN Shi-Feng,TANG Sheng-Rao.Department of Department of Clinical Laboratory,University Hospital of Hubei University for Nationalities,Enshi 445000,China
Objective:To clarify the dynamics of Th2 related cytokines IL-4、IL-5 and the Treg T cell related cytokines TGF-β、IL-10 in children with primary steroid-sensitive nephrotic syndrome(SSNS)from the nephrotic phase before steroid treatment to the remission phase.MethodsAll 36 SSNS patients and 18 healthy controls matched for age,gender,body weight and height were enrolled,and their clinical characteristics were evaluated.Serum cytokine level was measured by ELISA assay.The serum levels of interleukin (IL)-4,IL-5,IL-10 and transforming growth factor(TGF)-β were compared and correlated with serum albumin and cholesterol.ResultsSerum IL-4 and IL-5 levels in SSNS of nephrotic phase were higher than serum IL-4 and IL-5 levels of SSNS of remission phase and the healthy control,respectively.The serum TGF-β levels of the nephrotic phase were significantly lower than those of remission phase or control group,whereas the serum IL-10 levels showed no significant difference between nephrotic phase and remission phase of SSNS or control group.The serum IL-4 levels had a negative correlation with serum albumin(R2= -0.694,P=0.000),and a positive correlation with serum albumin levels(R2=0.658,P=0.000),whereas the serum TGF-β levels had a positive correlation with serum albumin(R2=0.838,P=0.000),and a negative correlation with serum albumin levels,had(R2= - 0.722,P=0.000).ConclusionThis study indicates that IL-4,IL-5 and TGF-β level is related to the pathogenesis of pediatric SSNS.
Nephrotic syndrome;Steroid-sensitive;Children;IL-4;IL-5;TGF-β;IL-10
R725
A
1000-484X(2014)05-0673-04
10.3969/j.issn.1000-484X.2014.05.023
①湖北民族学院附属民大医院儿科,恩施445000。
周发为(1971年-),副主任技师,检验科主任,主要从事检验工作方面的研究,E-mail:zfwmdyyy@sina.com。
book=676,ebook=132
