小鼠骨髓源耐受性树突细胞的分离培养及功能鉴定①
2014-02-05付静静盛康亮李培培汪庆童陈镜宇吴华勋张玲玲安徽医科大学临床药理研究所抗炎免疫药物教育部重点实验室合肥230032
付静静 盛康亮 李 影 李培培 汪庆童 陈镜宇 吴华勋 张玲玲 魏 伟(安徽医科大学临床药理研究所,抗炎免疫药物教育部重点实验室,合肥230032)
小鼠骨髓源耐受性树突细胞的分离培养及功能鉴定①
付静静 盛康亮②李 影 李培培 汪庆童 陈镜宇 吴华勋 张玲玲 魏 伟(安徽医科大学临床药理研究所,抗炎免疫药物教育部重点实验室,合肥230032)
目的:建立小鼠骨髓源耐受性树突状细胞(CD11b+F4/80+TDCs)体外培养及功能鉴定方法。方法:以重组小鼠粒细胞-巨噬细胞集落刺激因子(rmGM-CSF)和重组白介素4(rmIL-4)体外诱导小鼠骨髓细胞分化为未成熟树突细胞(iDCs),收集第六天的细胞采用流式细胞术分离纯化CD11b+F4/80+TDCs。倒置显微镜动态观察细胞形态学变化,流式细胞术观察并分选CD11b+F4/80+TDCs,CD11b+F4/80+TDCs的耐受功能通过MHCⅡ类分子、CD83、IDO、TLR-2的表达及IL-10和TGF-β1细胞因子的产生进行评价。流式细胞术测定MHCⅡ类分子表达,免疫组化法测定CD83、IDO、TLR-2的表达,ELISA法测定IL-10和TGF-β1的水平,同时设LPS刺激诱导的成熟树突细胞(mDCs)作对照。结果:镜下可见新鲜分离的骨髓细胞呈圆形,体积小,2 d后,部分细胞形态发生改变,体积增大,细胞聚集成团,培养5~6 d,细胞集落增多,形态不规则。同时表面出现较多毛刺样突起。CD11b+F4/80+TDCs含量在23%左右,经流式分选后细胞纯度达到99%以上。与mDCs比较,CD11b+F4/80+TDCs低表达MHCⅡ和CD83,高表达IDO、TLR-2,并分泌IL-10和TGF-β1。结论:用小鼠rmGM-CSF和rmIL-4体外能成功诱导小鼠骨髓源CD11b+F4/80+TDCs,并且CD11b+F4/80+TDCs通过表达IL-10、TGF-β1、IDO和TLR-2显示耐受功能。
耐受性树突细胞;骨髓源;分离;功能鉴定
树突细胞(Dendritic cells,DCs)作为目前发现的功能最强大的专职抗原递呈细胞(Antigen-presenting cell,APC),在参与T细胞免疫和维持外周免疫耐受中起重要作用[1,2]。DCs具有免疫原性和耐受性双重作用,DCs的免疫原性表现为能够激活初始T淋巴细胞,在T淋巴细胞依赖的体液免疫和细胞免疫反应中处于启动、调控以及维持免疫应答的中心环节;DCs的耐受性表现为能够诱导抗原特异性T细胞的凋亡、无能和调节性T细胞(regulatory T cell,Treg)的产生,引起免疫耐受[3,4]。DCs这种独特功能与其不同的激活和分化状态有关:未成熟DCs(immature DC,iDCs)或耐受性DCs(Tolerogenic dendritic cells,TDCs)通过表面受体介导的吞噬、饱饮、内吞作用而摄取、加工和处理抗原,诱导免疫耐受;iDCs在迁移到次级淋巴结过程中逐渐成熟,成熟DCs(mature dendritic cells,mDCs)通过高表达MHCⅡ和共刺激分子提呈抗原并活化T细胞,参与细胞免疫和T细胞依赖的体液免疫反应,表现为免疫原性,诱导免疫应答的产生[5]。
TDCs诱导免疫耐受机制主要通过分泌IL-10及TGF-β1、表达抑制性免疫球蛋白样转录因子-3 (Inhibitory immunoglobulin-like transcript,ILT-3)及程序死亡配体(Programmed cell death legend-1,PDL1)等[6-8];TDCs 分泌吲哚胺 2,3-双加氧酶(Indoleamine 2,3-dioxygenase,IDO),IDO 抑制 T细胞反应、促进效应性T细胞的凋亡、并通过激活 GCN2激酶途径阻滞Treg向Th17的分化,促进免疫耐受形成[4,9];TDCs 高表达 Toll样受体-2(Toll-like receptor,TLR-2),促进 Th0 细胞向 Th2 的分化[10,11]。
TDCs在体内含量非常低,直接从体内分离TDCs操作复杂,且难以分离纯化,限制了TDCs进一步研究与应用。尽管有关DCs的体外分离方法多有报道,但CD11b+F4/80+TDCs的分离和耐受功能的鉴定方法尚无报道。本实验采用体外细胞因子联合培养的方法,诱导小鼠骨髓细胞分化为iDCs,并采用流式细胞术分离纯化CD11b+F4/80+TDCs。对纯化后的CD11b+F4/80+TDCs进行形态学和耐受功能鉴定,为进一步将CD11b+F4/80+TDCs用于炎症免疫性疾病的细胞免疫治疗研究奠定基础。
1 材料与方法
1.1 实验动物 清洁级健康C57BL/6小鼠,雄性,体质量(20±2)g,7~8周龄,购自安徽医科大学动物实验中心,标准化清洁环境中饲养,合格证号: SCXK(皖)2005-001号。
1.2 主要试剂 重组小鼠粒细胞-巨噬细胞集落刺激因子(recombinant mouse granulocyte-macrophage colony stimulating factor,rmGM-CSF)和重组小鼠白介素4(recombinant mouse interleukin-4,rmIL-4)购自Peprotech公司;脂多糖(LPS)购自美国 Sigma公司;RPMI1640培养基购于美国Gibco公司;胎牛血清(Fetal calf serum,FCS)购自Hyclone公司;FITC标记 Anti-mouse-CD11b,PE标记 Anti-mouse-F4/80和APC标记Anti-mouse-MHCⅡ等荧光抗体及同型对照抗体均购于BioLegend公司;兔抗小鼠 IDO(bs-2379R)和兔抗小鼠TLR-2(sc-10739)一抗均购自北京Bioss公司,兔抗小鼠CD83(Bs2204)一抗购自Bioworld公司,辣根过氧化酶羊抗兔IgG抗体购自北京中杉金桥公司;小鼠IL-10和TGF-β1 ELISA试剂盒购自美国R&D公司。
1.3 方法
1.3.1 体外制备骨髓源DCs 脱臼处死小鼠,无菌分离小鼠后肢股骨和胫骨,750 ml/L酒精浸泡5 min,PBS洗2次;剪刀剪去骨两端,用5 ml注射器抽取RPMI1640液,分别从骨两端插入骨髓腔,反复冲洗出骨髓直至骨髓腔变白;200目纱网过滤骨髓悬液,2 000 r/min离心10 min后,弃上清液,以完全培养液(含 RPMI1640,2 mmol/L L-谷氨酰胺,1× 105U/L青霉素,100 g/L链霉素,50 mmol/L 2-巯基乙醇和100 ml/L胎牛血清)重悬细胞,浓度调整为5×109个细胞/L;接种在6孔培养板中,每孔2 ml,置37℃,5 ml/L CO2培养箱培养4 h,去除非黏附粒细胞,更换新鲜培养基,并加入 rmGM-CSF (20 μg/L)和 rmIL-4(20 μg/L);每日用相差显微镜观察细胞的生长和形态变化,隔天半量换液,培养6 d收集悬浮细胞,并轻轻吹打6孔板孔壁,所得一并收集,获得 iDCs。对照组于第 6天加入 LPS (1 mg/L)孵育 24 h,获得 mDCs[5,12]。
1.3.2 流式细胞术分析CD11b+F4/80+TDCs百分含量及MHCⅡ类分子表达 收集培养的DCs,调细胞浓度为1×109个细胞/L,分装于流式管中。加入1 μl的FITC标记的抗小鼠CD11b和PE标记的抗小鼠F4/80、APC标记的抗小鼠MHCⅡ类分子单克隆抗体,同时设PE、FITC或APC标记的正常小鼠
IgG抗体做阴性对照,4℃孵育30 min,流式细胞仪检测CD11b+F4/80+TDCs的百分含量和MHCⅡ类分子表达,并分离纯化CD11b+F4/80+TDCs。流式细胞分选仪分选后的CD11b+F4/80+TDCs用于后续实验。
1.3.3 免疫组化法检测CD83、IDO和TLR-2的表达(采用SP法) 将CD11b+F4/80+TDCs滴入载玻片上至半干,用40 ml/L多聚甲醛固定30 min,PBS洗3次;30 ml/L H2O2去离子水室温孵育10 min,以消除内源性过氧化物酶的活性;在细胞玻片上加50 ml/L羊血清封闭非特异性蛋白室温孵育20 min;加稀释好的一抗4℃过夜,CD83、IDO和TLR-2稀释比例为1∶200。其余步骤按说明书进行。同时设LPS诱导的mDCs作为对照。
1.3.4 ELISA 法测定 DCs上清 IL-10 和 TGF-β1 水平 第7天收集诱导的DCs细胞上清,1 500 r/min离心5 min,上清收集后-20℃保存。细胞培养上清IL-10和 TGF-β1水平检测采用 ELISA法,同时设LPS诱导的mDCs作为对照。步骤按说明书进行。1.4 统计学分析 所有数据以x-±s表示。数据采用SPSS17.0软件进行统计分析,组间比较用方差分析,P<0.05为具有统计学意义。
2 结果
2.1 骨髓源DCs的形态观察 新鲜分离的小鼠骨髓细胞呈圆形,体积小,培养4 h后开始贴壁;2 d后,在细胞因子的刺激下,细胞体积逐渐变大,并且增殖旺盛,细胞贴壁生长,单个散在的细胞呈现较小的集落,簇状生长,少部分细胞形态由圆形变为卵圆形;培养3~4 d,10~20个细胞聚集成团,可见有少量散在的半悬浮细胞,高倍镜下可见细胞边缘呈毛刺样突起;培养5~6 d,集落体积变小,5~10个细胞聚集成团,但半悬浮生长的集落数量增多,细胞呈卵圆形,少数细胞形态不规则,同时高倍镜下可见细胞表面出现较多毛刺样突起,此时为典型的iDCs(图1)。
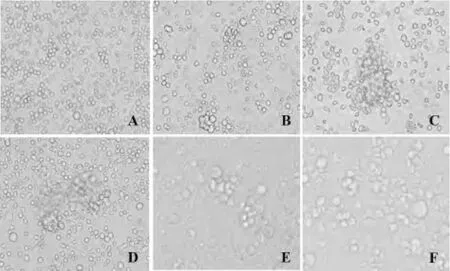
图1 骨髓源DCs的形态学变化(×200)Fig.1 Morphology of bone marrow DCs in different time
2.2 流式细胞术分析CD11b+F4/80+TDCs百分含量 收集培养第6天的细胞,应用荧光抗体双标记染色和流式细胞仪对两组小鼠髓源性TDCs表面标志物 CD11b+F4/80+进行检测,检测结果显示rmGM-CSF和 rmIL-4诱导的 CD11b+F4/80+TDCs,含量为20%左右(图2)。并采用流式细胞分选系统分离纯化CD11b+F4/80+TDCs,纯化后细胞纯度达99%左右(图2)。并将纯化后的CD11b+F4/80+TDCs用于后续实验。
2.3 CD11b+F4/80+TDCs低表达CD83和 MHCⅡ类分子 CD83是mDCs的特异性标志,TDCs几乎不表达CD83。本实验收集纯化后的骨髓源TDCs,采用免疫组化SP法检测CD83在TDCs中的表达,CD83阳性产物呈棕褐色,结果显示:rmGM-CSF和rmIL-4诱导的 CD11b+F4/80+TDCs,CD83表达缺乏,而经LPS诱导的DCs有大量CD83表达,且表达在DCs细胞胞膜上(图3)。
MHCⅡ类分子是一个抗原呈递表面分子,主要表达在免疫原性和活化的mDCs上。本实验采用流式细胞术检测两组DCs中MHCⅡ类分子表达,结果显示,与mDCs相比,TDCs表达MHCⅡ类分子明显较低,差异有统计学意义(P<0.05),提示rmGMCSF和rmIL-4诱导的DCs呈现非成熟表型,而LPS诱导的DCs显示成熟特性(图4)。
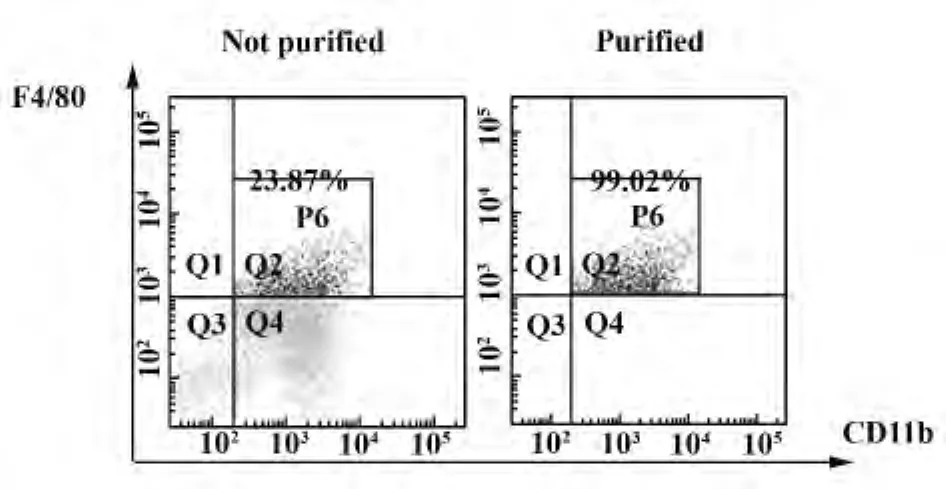
图2 流式细胞术分析并纯化CD11b+F4/80+TDCsFig.2 Evaluation and purify of CD11b+F4/80+TDCs by fluorescence-activated cell sorting system
2.4 CD11b+F4/80+TDCs高表达耐受性标志IDO和TLR-2 本实验收集纯化后的骨髓源TDCs,用免疫组化SP法分别检测IDO和TLR-2在TDCs中的表达。结果显示:rmGM-CSF和rmIL-4诱导的TDCs高表达 IDO,且IDO表达在TDCs细胞胞浆中,而LPS诱导的DCs表达IDO较少(图5);TDCs同样也高表达TLR-2,且TLR-2表达在TDCs细胞胞浆和胞膜中,而LPS诱导的DCs胞膜和胞浆中TLR-2表达明显减少(图6)。提示rmGM-CSF和rmIL-4诱导的CD11b+F4/80+TDCs可表达抑制性酶IDO和TLR-2,而显示耐受潜能。
2.5 CD11b+F4/80+TDCs培养上清中 IL-10和TGF-β1水平 ELISA法测定骨髓源 CD11b+F4/ 80+TDCs培养上清IL-10和TGF-β1的表达。结果显示rmGM-CSF和rmIL-4诱导的TDCs培养上清IL-10和TGF-β1水平较高,明显高于 LPS诱导的mDCs培养上清IL-10和TGF-β1水平(图7)。
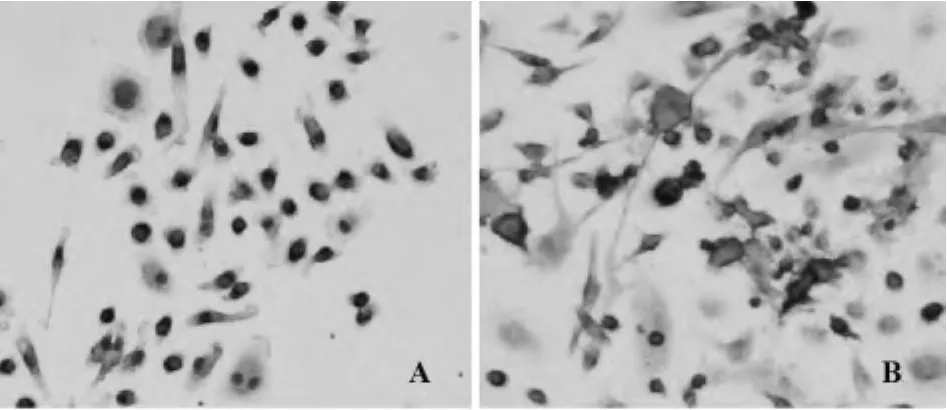
图3 CD83在CD11b+F4/80+TDCs和LPS诱导的mDCs的表达Fig.3 Expression of CD83 in CD11b+F4/80+TDCs and LPS-induced mDCs
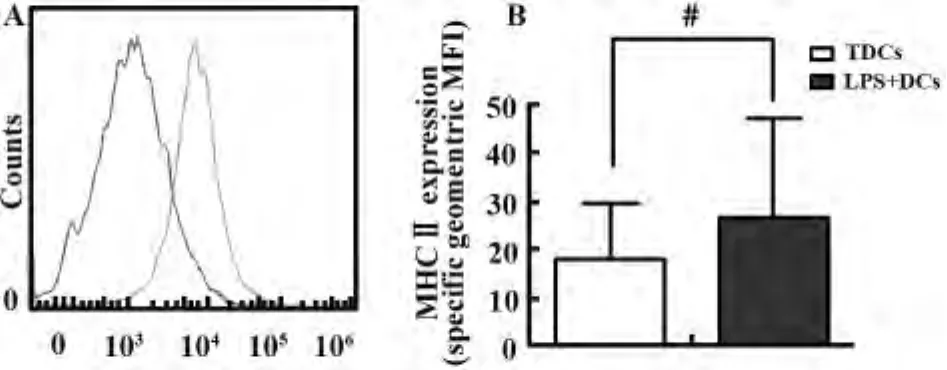
图4 流式细胞术分析MHCⅡ在CD11b+F4/80+TDCs和LPS诱导的mDCs的表达Fig.4 Evaluation of MHCⅡ expression in CD11b+F4/ 80+TDCs and LPS-induced mDCs by flow cytometry
3 讨论
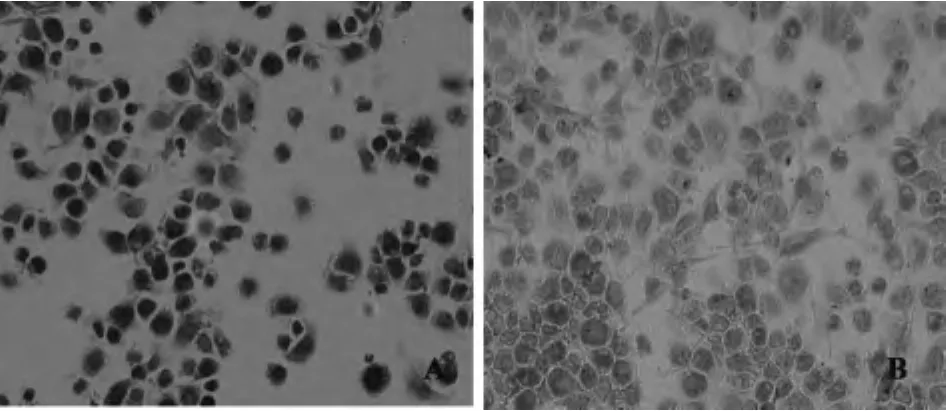
图5 IDO在CD11b+F4/80+TDCs和LPS诱导的mDCs的表达Fig.5 Expression of IDO in CD11b+F4/80+TDCs and LPS-induced mDCs
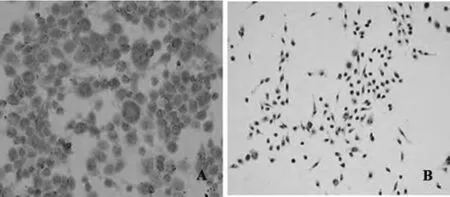
图6 TLR-2在CD11b+F4/80+TDCs和LPS诱导的mDCs的表达Fig.6 Expression of TLR-2 in CD11b+F4/80+TDCs and LPS-induced mDCs

图7 CD11b+F4/80+TDCs和LPS诱导的mDCs培养上清IL-10和TGF-β1的水平Fig.7 Level of IL-10 and TGF-β1 in CD11b+F4/80+ TDCs and LPS-induced mDCs
DCs前体细胞主要来自外周血和骨髓,主要为CD14+外周血单个核细胞以及CD34+干细胞,且来源于不同前体细胞的DCs功能上有一定的区别,研究显示,与外周血前体细胞来源的DCs相比,骨髓来源的 DCs更适合于培养 TDCs[13,14]。因此本实验采用小鼠骨髓来源的前体细胞诱导培养TDCs。
细胞因子在体外诱导培养TDCs过程中起关键作用,rmGM-CSF促进DCs发育和分化,是最重要的细胞因子,但是也会引起其他杂细胞(中性粒细胞和巨噬细胞)的大量增殖,降低DCs的纯度;IL-4能抑制中性粒细胞和巨噬细胞的分化,体外联合采用rmGM-CSF和rmIL-4能产生大量高纯度的iDCs[15-17]。但此时尚残存有部分杂细胞,并且部分DCs可能不表现耐受特性,影响对TDCs的研究。本实验联合采用rmGM-CSF和rmIL-4成功诱导了小鼠骨髓源iDCs,并采用流式细胞分选系统分离纯化得到的具有CD11b+F4/80+表型的TDCs,细胞纯度到达99%。图1中可见骨髓前体细胞培养5~6 d,细胞呈卵圆形,半贴壁簇状生长,少数细胞形态不规则,同时表面出现较多毛刺样突起。
mDCs高表达共刺激分子(如MHCⅡ、CD80/ CD86),分泌炎症性细胞因子(如IFN-γ、IL-12、IL-6、IL-15、IL-18等),刺激T细胞增殖和分化,诱导正向免疫应答。TDCs低表达共刺激分子(如MHCⅡ),高表达CD11b,抑制初始CD4+T细胞活化并通过阻滞Th17的分化促进外周耐受的形成[4,18-20]。APC表达的F4/80蛋白不仅仅是细胞发育和分布所需,而且还携带免疫耐受信号,诱导外周免疫耐受。CD11b+F4/80+TDCs被认为是一种耐受性DCs,能抑制效应性T细胞(Th1、Th17等)的活化并限制炎性细胞因子(IFN-γ、IL-12 等)分泌[21]。本实验采用rmGM-CSF和 rmIL-4联合诱导,CD11b+F4/80+TDCs百分含量在20%左右。
CD83和MHCⅡ是与mDCs相关的表面分子,CD83特异性表达于mDCs上,而MHCⅡ是高表达在mDCs上的重要抗原呈递分子[22]。本实验采用免疫组化法测定骨髓源TDCs中CD83的表达,流式细胞术测定MHCⅡ类分子的含量,结果显示rmGMCSF和 rmIL-4诱导的 CD11b+F4/80+TDCs,CD83表达缺乏、MHCⅡ类分子低表达,而 LPS诱导的mDCs大量表达CD83、MHCⅡ类分子高表达。IDO通过色氨酸代谢物,如3-HAA,促进Treg的分化和TDCs中 TGF-β1 的表达[23,24]。TDCs高表达 TLR-2,通过下游信号,进而诱导Treg的产生[25]。IL-10及TGF-β1是 TDCs分泌的重要可溶性分子,通过PI3K/Akt/NF-κB-MyD88/MAPK-和 Ras/Raf/MAPK-途径抑制TDCs的成熟和活化[26],并且有研究发现转染IL-10和TGF-β1基因的DCs能成功表现耐受特性,TDCs通过产生高水平的IL-10和TGF-β1抑制效应性T细胞活化并促进Treg的分化[27]。本实验研究发现骨髓源 CD11b+F4/80+TDCs高表达IDO和TLR-2,TDCs培养上清表达高水平的IL-10和TGF-β1,因此 rmGM-CSF和 rmIL-4联合诱导的CD11b+F4/80+TDCs表现耐受特性。
综上所述,尽管有关DCs的体外分离方法多有报道,目前常规方法对小鼠骨髓源TDCs的纯化和鉴定的方法尚无报道,本实验采用流式细胞术分选具有CD11b+F4/80+表型的DCs,并提供了一种对CD11b+F4/80+TDCs鉴定的方法。经研究发现,CD11b+F4/80+TDC具有形态典型且具有耐受潜能的特点。为进一步将CD11b+F4/80+TDCs用于炎症免疫性疾病的细胞免疫治疗的研究奠定基础。
[1]Jongbloed SL,Benson RA,Nickdel MB,et al.Plasmacytoid dendritic cells regulate breach of self tolerance in autoimmune arthritis[J].J Immunol,2009,182(2):963-968.
[2]Amodio G,Gregori S.Dendritic cells a double-edge sword in autoimmune responses[J].Front Immunol,2012,3:233-247.
[3]Khan S,Greenberg JD,Bhardwaj N.Dendritic cells as targets for therapy for Rheumatoid Arthritis[J].Nat Rev Rheumatol,2009,5(10):566-571.
[4]付静静,张玲玲,魏 伟.树突细胞在类风湿性关节炎病理机制中的免疫原性和耐受性双重作用[J].中国药理学通报,2012,28(9):1185-1188.
[5]余 昆,苟 欣,周青松,等.小鼠髓源性树突状细胞的体外扩增及生物学特性的鉴定[J].国际检验医学杂志,2010,31 (6):521-523.
[6]Saei A,Hadjati J.Tolerogenic dendritic cells:key regulators of peripheral tolerance in health and disease[J].Int Arch Allergy Immunol,2013,161(4):161:293-303.
[7]Vlad G,Chang CC,Colovai AI,et al.Membrane and soluble ILT3 are critical to the generation of T suppressor cells and induction of immunological tolerance[J].Int Rev Immunol,2010,29 (2):119-132.
[8]Svajger U,Obermajer N,Jeras M.Dendritic cells treated with resveratrol during differentiation from monocytes gain substantial tolerogenic properties upon activation [J].Immunology,2010,129(4):525-535.
[9]Chen W,Liang X,Peterson AJ,et al.The indoleamine 2,3-dioxygenase pathway is essential for human plasmacytoid dendritic cellinduced adaptive T regulatory cell generation [J].J Immunol,2008,181(8):5396-5404.
[10]Chamorro S,García-Vallejo JJ,Unger WW,et al.TLR triggering on tolerogenic dendritic cells results in TLR2 up-regulation and a reduced proinflammatory immune program [J].J Immunol,2009,183(5):2984-2994.
[11]Bhattacharya P,Gopisetty A,Ganesh BB,et al.GM-CSF-induced,bone-marrow-derived dendritic cells can expand natural Tregs and induce adaptive Tregs by different mechanisms[J].J Leukoc Biol,2011,89(2):235-249.
[12]Cho YS,Challa S,Clancy L,et al.Lipopolysaccharide-induced expression of TRAIL promotes dendritic cell differentiation [J].Immunology,2010,130(4):504-515.
[13]Miloud T,Hammerling GJ,Garbi N.Review of murine dendritic cells:types,location,and development[J].MethodsMol Biol,2010,595:21-42.
[14]刘 飞,杨明珍,李庆生,等.1,25-二羟维生素D3对其诱导的树突状细胞上Toll样受体7表达的抑制作用[J].中国临床药学杂志,2012,25(5):276-280.
[15]Torres-Aguilar H,Aguilar-Ruiz SR,Gonzalez-Perez G,et al.Tolerogenic dendritic cells generated with different immunosuppressive cytokines induce antigen-specific anergy and regulatory properties in memory CD4+T cells[J].J Immunol,2010,184 (4):1765-1775.
[16]Kalantari T,Kamali-Sarvestani E,Zhang GX,et al.Generation of large numbers of highly purified dendritic cells from bone marrow progenitor cells after co-culture with syngeneic murine splenocytes[J].Exp Mol Pathol,2013,94(2):336-342.
[17]郭慈仁,欧启水,李良庆.小鼠骨髓来源树突细胞体外扩增和鉴定[J].福建医科大学学报,2004,38(3):261-263.
[18]Morelli AE,Thomson AW.Tolerogenic dendritic cells and the quest for transplant tolerance [J].Nat Rev Immunol,2007,7 (8):610-621.
[19]Hubo M,Trinschek B,Kryczanowsky F,et al.Costimulatory molecules on immunogenic versus tolerogenic human dendritic cells[J].Front Immunol,2013,4:82.
[20]Park MJ,Park KS,Park HS,et al.A distinct tolerogenic subset of splenic IDO(+)CD11b(+)dendritic cells from orally tolerized mice is responsible for induction of systemic immune tolerance and suppression of collagen-induced arthritis[J].Cell Immunol,2012,278:45-54.
[21]Hesske L,Vincenzetti C,Heikenwalder M,et al.Induction of inhibitory central nervous system-derived and stimulatory bloodderived dendritic cells suggests a dual role for granulocyte-macrophage colony-stimulating factor in central nervous system inflammation[J].Brain,2010,133(Pt 6):1637-1654.
[22]Bock F,Rössner S,Onderka J,et al.Topical application of soluble CD83 induces IDO-mediated immune modulation,increases Foxp3+T cells,and prolongs allogeneic corneal graft survival[J].J Immunol,2013,191(4):1965-1975.
[23]Sharma MD,Hou DY,Liu Y,et al.Indoleamine 2,3-dioxygenase controls conversion of Foxp3+Tregs to TH17-like cells in tumor-draining lymph nodes[J].Blood,2009,113(24):6102-6111.
[24]Yan YP,Zhang GX,Bruno G,et al.IDO upregulates regulatory T cells via tryptophan catabolite and suppresses encephalitogenic T cell responses in experimental autoimmune encephalomyelitis[J].J Immunol,2010,185(10):5953-5961.
[25]Nawijn MC,Motta AC,Gras R,et al.TLR-2 activation induces regulatory T cells and long-term suppression of asthma manifestations in mice[J].PLoS One,2013,8(2):e55307.
[26]Cai Z,Zhang W,Li M,et al.TGF-beta1 gene-modified,immature dendritic cells delay the development of inflammatory bowel disease by inducing CD4(+)Foxp3(+)regulatory T cells[J].Cell Mol Immunol,2010,7(1):35-43.
[27]Chen LH,Qiu ML,He WB,et al.Functional study of immature dendritic cells co-transfected with IL-10 and TGF-beta 1 genes in vitro[J].Mol Biol Rep,2012,39(6):6633-6639.
[收稿2013-09-20 修回2013-12-12]
(编辑 倪 鹏)
Isolated culture and functional identification of mouse bone marrow derived tolerogenic dendritic cells
FU Jing-Jing,SHENG Kang-Liang,LI Ying,LI Pei-Pei,WANG Qing-Tong,CHEN Jing-Yu,WU Hua-Xun,ZHANG Ling-Ling,WEI Wei.Institute of Clinical Pharmacology,Anhui Medical University,Key Laboratory of Antiinflammatory and Immune Medicine(Anhui Medical University),Ministry of Education,Hefei 230032,China
Objective:To establish the methods of isolated culture and functional identification of mice bone marrow derived tolerogenic dendritic cells(CD11b+F4/80+TDCs)in vitro.MethodsMice bone marrow cells were isolated and cultured to obtain iDCs with the simulation of mouse rmGM-CSF and rmIL-4.CD11b+F4/80+TDCs were purified by fluorescence-activated cell sorting on day 6.The morphological changes of TDCs were observed with the inverted microscope dynamically.The expression of CD11b+F4/ 80+TDCs were analyzed by the flow cytometry.Tolerogenic function of CD11b+F4/80+TDCs was evaluated by the expression of MHCⅡ,CD83,IDO,TLR-2,IL-10 and TGF-β1.The expression of MHCⅡ was analyzed by the flow cytometry,and the expression of CD83,IDO and TLR-2 were analyzed by immune-histochemistry.The levels of IL-10 and TGF-β1 in the supernatant of CD11b+F4/ 80+TDC were analyzed by ELISA.Meanwhile mature DCs(mDCs)induced by LPS were used as control.ResultsThe fresh isolated bone marrow cells look like round and small under microscope.After two days of culture,cells became big and formed into clusters.Five or six days later,cells clusters increased,and the morphology of cells became irregular.At the same time,more dendrite appeared on the surface of cells.The percentage of CD11b+F4/80+TDCs induced by rmGM-CSF and rmIL-4 was about 23%,and the purity of the purified BM CD11b+F4/80+iDC was about 99%.Compared with mDCs,CD11b+F4/80+TDCs expressed low levels of MHCⅡ and CD83 and high levels of IDO,TLR-2,IL-10 and TGF-β1.ConclusionCD11b+F4/80+TDCs derived from mouse bone marrow could be induced successfully by rmGM-CSF and rmIL-4 in vitro.CD11b+F4/80+TDCs showed tolerogenic function by the expressions of IL-10,TGF-β1,IDO and TLR-2.
Tolerogenic dendritic cells;Bone marrow-derived;Isolation;Functional identification
R392.12
A
1000-484X(2014)05-0633-06
10.3969/j.issn.1000-484X.2014.05.014
①本文为国家自然科学基金 (No.81330081,31100640,81173075)和省自然科学基金(No.11040606M195)资助项目。
②共同第一作者。
付静静(1988年-),女,主要从事抗炎免疫药理学方面研究,E-mail:fujj07@163.com。
及指导教师:张玲玲(1972年-),女,医学博士,教授,硕士生导师,主要从事抗炎免疫药理学方面研究,E-mail:llzhang@ahmu.edu.cn。
