Akt磷酸化在A549细胞抵抗rsTRAIL蛋白诱导细胞凋亡的研究①
2014-02-05方艳秋齐亚灵芦小单魏海峰吉林省人民医院医学诊治中心长春130021
刘 磊 方艳秋 齐亚灵 芦小单 魏海峰 谭 岩 (吉林省人民医院医学诊治中心,长春 130021)
Akt磷酸化在A549细胞抵抗rsTRAIL蛋白诱导细胞凋亡的研究①
刘 磊 方艳秋②齐亚灵③芦小单 魏海峰 谭 岩 (吉林省人民医院医学诊治中心,长春 130021)
目的:研究Akt磷酸化抵抗rsTRAIL蛋白诱导肺癌A549细胞株凋亡的作用机制。方法:rsTRAIL蛋白和哌立福新单独和联合作用于细胞株A549,Western blot检测A549细胞中Akt磷酸化水平变化、c-FLIPLL表达水平变化、caspase-8蛋白活化变化情况。流式细胞术进行细胞凋亡检测。MTT法检测A549细胞增殖率。结果:Western blot结果显示,rsTRAIL蛋白可以导致A549细胞中Akt磷酸化水平的增加,哌立福新能够抑制A549细胞中Akt的磷酸化水平及c-FLIPLL表达水平,增强A549细胞中caspase-8的活化。哌立福新能提升rsTRAIL蛋白诱导A549细胞的细胞凋亡率至(76.5±3.02)%和杀伤活性到(83.2±2.54)%。结论:Akt磷酸化是导致A549细胞对抵抗rsTRAIL诱导细胞凋亡的重要原因,抑制其活性可以促进rsTRAIL蛋白发挥抗NSCLC的活性。
A549细胞株;重组TRAIL蛋白;Akt;哌立福新
非小细胞肺癌(Non-small cell lung carcinoma,NSCLC)占肺癌发病率的70% ~80%,目前临床尚未发现更为有效的临床化疗方案[1]。TRAIL (Tumor necrosis factor-related apoptosis-inducing ligand)是一种天然的杀伤肿瘤细胞因子,能强烈诱导转化细胞、肿瘤细胞和病毒感染细胞等凋亡,而正常组织细胞却对其不敏感[2]。研究证实,rsTRAIL蛋白可以有效地诱导NSCLC细胞株的凋亡发生[3],同时在实体肿瘤临床实验中展现出了良好的抗肿瘤效应[4]。部分肿瘤细胞对TRIAL诱导凋亡的抵抗效应是制约着其在临床应用研究广泛深入的主要因素。研究发现,凋亡信号通路中部分蛋白功能的失活导致肿瘤细胞抵抗TRAIL诱导凋亡的主要原因[5]。PI3K(Phosphatidylinositol3-kinase)/Akt信号途径参与多种肿瘤的发生、发展过程。Akt的磷酸化可以通过增强c-FLIPL蛋白水平而导致caspase8失活,进而导致TRAIL凋亡信号通路的传递的中断[6]。本研究以NSCLC细胞系A549细胞为模型,选择Akt的磷酸化的靶向抑制剂哌立福新联合rsTRAIL蛋白共同作用于肿瘤细胞,探讨靶向抑制Akt活性能否增强rsTRAIL蛋白诱导NSCLC的细胞凋亡。
1 材料与方法
1.1 主要材料与试剂 人非小细胞肺癌细胞株A549由本实验室传代保存。重组rsTRAIL蛋白由本研究室表达纯化[3]。IMDM培养基、胰蛋白酶(Gibco公司)。小牛血清(杭州四季青生物材料公司)。哌立福新/Perifosine(Selleck Chemicals LLC公司),Annexin-V-FITC 和PI染料,兔抗 AKT、兔抗磷酸化蛋白激酶B(p-AKT),鼠抗人anti-caspase8,鼠抗人anti-cFLIPL,兔抗人β-actin单克隆抗体(Santa Cruz公司),四甲基偶氮唑蓝(MTT)(Sigma)生物素标记的马抗小鼠IgG和小鼠抗兔IgG及辣根过氧化物酶标记的亲和素,购自北京晶美公司。
1.2 药物干预分组 对培养至对数生长期的A549细胞,进行以下分组干预。①用100 ng/ml的rsTRAIL蛋白处理12 h(TRAIL组);②用10 μmol/L哌立福新作用24 h后加入100 ng/ml的rsTRAIL蛋白处理12 h(哌立福新组);③未进行干预组(对照组),各设3复孔。
1.3 Western blot检测各类蛋白的表达水平 收取细胞并用裂解液获取总蛋白,测定各组细胞蛋白含量并将蛋白样品浓度调整为10 μg/μl。10%SDS聚丙烯酰胺凝胶电泳、转膜2 h,10%脱脂奶封闭液1 h。弃去封闭液,加入用封闭液稀释的一抗工作液(依据检测蛋白的不同而异),4℃振摇孵育过夜。辣根过氧化物酶标记的二抗稀释液室温下孵育2 h。TBST液洗膜×3次,加入50 μl DAB,室温下显色15 min。以β-actin作为内参照,检测各组细胞Akt蛋白、p-Akt蛋白、c-FLIPLL和 caspase-8活化,采用BandScan5.0分析软件进行灰度分析。
1.4 MTT法检测A549细胞增殖抑制率 获取对数生长期的A549细胞,调整浓度为5×105ml-1,并接种于96孔板,每孔100 μl,待其生长至80%汇合时,对培养细胞进行以下分组干预。①用100 ng/ml的rsTRAIL蛋白处理12 h(TRAIL组);②用10 μmol/L哌立福新作用24 h后加入100 ng/ml的rsTRAIL蛋白处理12 h(哌立福新组);③未进行干预组(对照组),各设3复孔。各组干预后,每孔加入新配制的5 mg/ml的 MTT 20 μl,37℃继续孵育4 h,弃上清后加150 μl DMSO溶解,混匀后在490 nm波长测定吸光度。
肿瘤细胞生长抑制率(%)=(1-实验组吸光度/对照组吸光度)×100%。
1.5 细胞凋亡率的测定 Annexin-V/FITC与PI匹配标记细胞,流式细胞仪测定细胞凋亡率。
1.6 统计学处理 计量资料数据以x-±s表示,两组间参数比较采用t检验,多组间数据采用方差分析,P<0.05为差异有显著统计学意义,采用SPSS10.0统计软件包进行统计处理。
2 结果
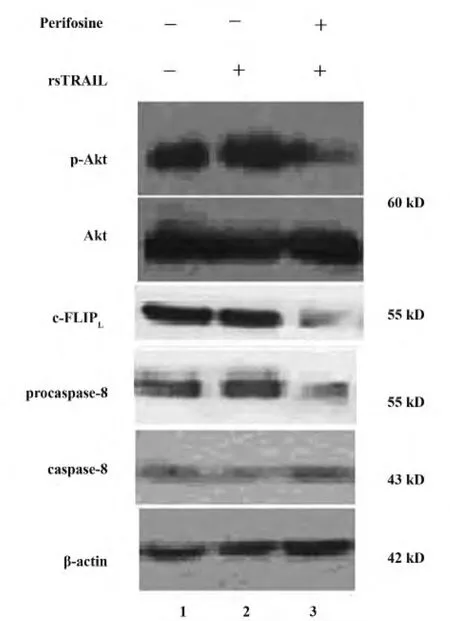
图1 A549细胞中Akt磷酸化水平,c-FLIPL表达水平及caspase-8活化变化Fig.1 Expression of p-AKT,c-FLIPLand caspase-8 in A549 cells
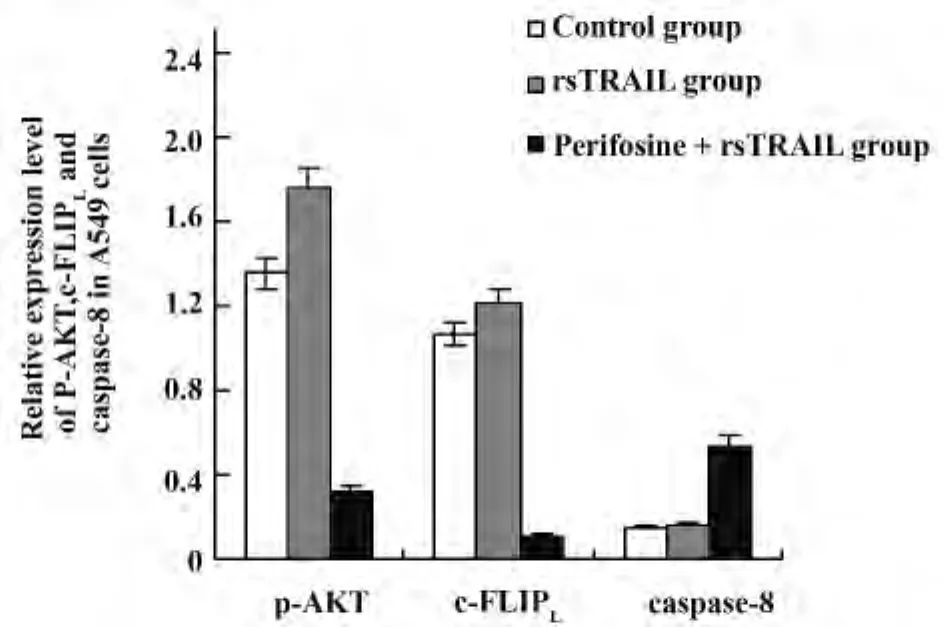
图2 A549细胞p-Akt,c-FLIPL和caspase-8表达Fig.2 Expression of p-Akt,c-FLIPLand caspase-8 in A549 cells
2.1 A549细胞的Akt磷酸化水平,c-FLIPL表达和caspase-8活化 Western blot结果显示,100 ng/ml rsTRAIL蛋白处理A549细胞12 h后,A549细胞中p-Akt的表达较对照组有增加的现象,说明TRAIL引起的细胞内信号通路会导致p-Akt表达改变。哌立福新预处理24 h后的细胞内磷酸化Akt水平显著受到抑制,rsTRAIL蛋白作用后Akt磷酸化明显低于正常水平,说明Akt特异性抑制剂有效地阻止了活化Akt水平。Akt抑制剂哌立福新作用后,随着Akt磷酸化水平的降低,c-FLIPL表达水平降低,活化的caspase-8(43 kD)表达增加(见图1)。采用BandScan5.0分析软件进行灰度分析结果显示,p-Akt条带与β-actin条带灰度比值在各组的比值分别为:对照组 1.35 ±0.24,rsTRAIL 蛋白单独作用组1.76+0.35,派立福新联合 rsTRAIL 蛋白组 0.32 ± 0.13,有显著性差异,P <0.05;c-FLIPL与 β-actin 条带灰度比值在各组分别为:对照组1.07±0.19,rsTRAIL蛋白单独作用组为1.21+0.22,派立福新rsTRAIL联合 rsTRAIL蛋白为0.11±0.03,有显著性差异,P<0.05;活化的 caspase-8(43 kD)β-actin条带灰度比值在各组的比值分别为对照组0.15± 0.04,rsTRAIL 蛋白单独作用组为 0.16+0.06,派立福新rsTRAIL蛋白组为0.53±0.15,有显著性差异,P <0.05(图2)。
2.2 抑制Akt活化对rsTRAIL蛋白对A549细胞杀伤的影响 流式细胞术分析显示,哌立福新联合rsTRAIL蛋白(100 ng/ml)可以有效诱导A549细胞的凋亡,A549细胞的凋亡率为(76.5±3.02)%,远高于单独应用rsTRAIL蛋白(3.21±0.96)%。MTT结果显示,单独应用rsTRAIL(100 ng/ml)作用A549细胞 24 h后,细胞生长抑制率仅为(5.24± 0.25)%;哌立福新预处理24 h后,rsTRAIL(100 ng/ ml)对 A549细胞的生长抑制率增加到(83.2± 2.54)%,说明通过靶向抑制细胞内Akt磷酸化可以逆转A549细胞对rsTRAIL蛋白诱导凋亡的抵抗作用,促进其对肿瘤细胞的杀伤活性。
3 讨论
非小细胞肺癌(NSCLC)占全部肺癌的70% ~80%,多数病人在诊断时已属晚期,联合化疗的预后很差。我们前期研究证实[3],TRAIL对NSCLC有很好的抗肿瘤活性,但一些肺癌细胞株对TRAIL诱导的凋亡存在耐药。TRAIL耐药机理的探索有利于将TRAIL在临床的广泛应用。
PI3K/Akt信号转导通路在NSCLC肿瘤化疗和放疗抗拒中的机理正逐步被研究揭示[7]。磷酸化是Akt的活化形式,活化的Akt(p-Akt)在抑制肿瘤细胞的凋亡、促进肿瘤细胞的运动、细胞的增殖及肿瘤的侵袭方面起着重要的作用,与肿瘤的耐药也密切相关[8]。本研究显示,在NSCLC细胞株A549中,存在着p-Akt的表达增高。应用rsTRAIL蛋白作用于A549细胞后,发现p-Akt的表达水平进一步增高,肿瘤细胞未能表现出明显的凋亡现象,提示p-Akt参与着A549细胞对TRAIL诱导凋亡抵抗作用。
特异性抑制剂或小RNA干扰阻断P13K/Akt通路可逆转一些细胞对TRAIL的原发耐药,增强TRAIL敏感性的研究已在多种肿瘤细胞中进行[9]。哌立福新(Perifosine)是一杂环的烷基磷酸胆碱,是Akt的靶向抑制剂,通过降低 Akt的活性,控制众多Akt的下游信号的传递[10]。Tazzari等[6]证实 Akt的磷酸化是导致THP-1白血病细胞内c-FLIP、XIAP等凋亡抑制蛋白水平增高的主要原因,而c-FLIP、XIAP蛋白表达的改变是影响细胞凋亡信号传导的重要原因。p-Akt可以作为探索肿瘤细胞抵抗rsTRAIL蛋白耐药的重要靶点。本研究发现,10 μmol/L的哌立福新作用于A549细胞24 h后就可以有效地抑制Akt的活化,降低p-Akt的表达水平。Western blot结果显示,p-Akt表达水平的降低,伴随着细胞内c-FLIPL蛋白水平的降低。c-FLIPL蛋白是抑制凋亡信号途径重要分子caspase-8活化的关键因素。我们前期研究发现[5],RNAi靶向性抑制 c-FLIPL蛋白的表达,促进了rsTRAIL蛋白对A549细胞诱导凋亡作用。本研究结果发现,通过抑制Akt的活化调节c-FLIPL蛋白的表达,也可促进caspase-8活化,增强rsTRAIL蛋白对A549细胞诱导凋亡作用。哌立福新联合rsTRAIL蛋白对A549细胞作用48 h后,对肿瘤细胞的生长抑制率达到(83.2± 2.54)%,PI3K/Akt可以作为 NSCLC细胞抵抗TRAIL诱导细胞凋亡研究的新靶点。探索PI3K/ Akt信号转导通路在rsTRAIL蛋白诱导肿瘤细胞凋亡的作用,有利于rsTRAIL蛋白在NSCLC治疗的研究。
[1]Bareschino MA,Schettino C,Rossi A,et al.Treatment of advanced non small cell lung cancer[J].J Thorac Dis,2011,3 (2):122-133.
[2]Stuckey DW,Shah K.TRAIL on trial:preclinical advances in cancer therapy[J].Trends Mol Med,2013,19(11):685-694.
[3]刘 磊,方艳秋,谭 岩,等.重组可溶性TRAIL表达及诱导A549和H460wt细胞凋亡[J].吉林大学学报(医学版),2008,34(2):270-273.
[4]Cretney E,Takeda K,Smyth MJ.Cancer:novel therapeutic strategies thatexploitthe TNF-related apoptosis-inducing ligand (TRAIL)/TRAIL receptor pathway[J].Int J Biochem Cell Biol,2007,39(2):280-286.
[5]谭 岩,刘 磊,方艳秋,等.抑制c-FLIPL表达增强rhTRAIL蛋白杀伤肺癌A549细胞的研究[J].中国免疫学杂志,2012,28(10):890-893.
[6]Tazzari PL,Tabellini G,Ricci F,et al.Synergistic proapoptotic activity of recombinant TRAIL plus the Akt inhibitor Perifosine in acute myelogenous leukemia cells[J].Cancer Res,2008,68 (22):9394-9403.
[7]Papadimitrakopoulou V.Development of PI3K/AKT/mTOR pathway inhibitors and their application in personalized therapy for non-small-cell lung cancer[J].J Thorac Oncol,2012,7(8): 1315-1326.
[8]Willems L,Tamburini J,Chapuis N,et al.PI3K and mTOR signaling pathways in cancer:new data on targeted therapies[J].Curr Oncol Rep,2012,14(2):129-138.
[9]Pier Luigi Tazzari,Giovanna Tabellini,et al.Activity of recombinant TRAIL plus the Akt inhibitor perifosine in acute myelogenous leukemia cells[J].Cancer Res,2008,68:(22):9394-9430.
[10]Al Sawah E,Chen X,Marchion DC,et al.Perifosine,an AKT inhibitor,modulates ovarian cancer cell line sensitivity to cisplatin-induced growth arrest[J].GynecolOncol, 2013,131 (1):207.
[收稿2013-12-17]
(编辑 张晓舟)
Akt phosphorylation and mechanism of TRAIL-resistance in A549 cells
LIU Lei,FANG Yan-Qiu,QI Ya-Ling,LU Xiao-Dan,WEI Han-Feng,TAN Yan.Medical Treatment and Experiment Center,Jilin Province Hospital,Changchun 130021,China
Objective:To investigate mechanism of TRAIL-resistance in A549 cells(a cell line of non-small cell lung carcinoma cells)due to Akt phosphorylation.MethodsA549 cells were treated with Akt inhibitor Perifosine and rsTRAIL protein individually and in combination.The expressions of Akt phosphorylation(p-Akt),c-FLIPLLand caspase-8 were detected by Western blot.The apoptotic rate of the A549 cells treated was detected by flow cytometry and the cell proliferation was evaluated by MTT assay.ResultsA549 cells showed the increased level of Akt phosphorylation mediated by rsTRAIL protein.Treatment with the Akt inhibitor Perifosine induced a suppression of Akt activation in A549 cells and a concomitant decrease in the expression of c-FLIPLL.As a result,Perifosine significantly enhanced TRAIL-induced apoptosis rate of(76.5 ±3.02)%and cytotoxic rate of(83.2 ±2.54)%by promoting the activity of caspase-8.ConclusionAkt activity promotes A549cells survival against TRAIL-induced apoptosis and that the cytotoxic effect of rsTRAIL protein can be enhanced by modulating the Akt phosphorylation in human non-small cell lung carcinoma cells.
A549 cells;rsTRAIL protein;Akt;Perifosine
R733.6
A
1000-484X(2014)05-0630-04
10.3969/j.issn.1000-484X.2014.05.013
①本文受吉林省科技厅基础项目(No.201115201)、吉林省科技厅重点实验室项目(No.20122113)、吉林省卫生厅项目(No.20082036)和吉林省科技厅科技创新项目(No.20082102)的资助。
②通讯作者,E-mail:yq.fang@163.com;E-mail:qiyaling87016@ 163.com。
③佳木斯大学,佳木斯154007。
刘 磊(1978年-),男,医学博士,主要从事肿瘤免疫相关研究。
·免疫学技术与方法·
