亚甲基蓝对单增李斯特菌菌膜的光动力杀伤作用
2014-01-18李红爱唐姝姝刘永强唐书泽吴希阳陈振强
李红爱,唐姝姝,刘永强,邓 曦,唐书泽,*,吴希阳,陈振强
(1.暨南大学理工学院,广东 广州 510632;2.广州皇上皇集团有限公司,广东 广州 510240)
亚甲基蓝对单增李斯特菌菌膜的光动力杀伤作用
李红爱1,唐姝姝1,刘永强2,邓 曦1,唐书泽1,*,吴希阳1,陈振强1
(1.暨南大学理工学院,广东 广州 510632;2.广州皇上皇集团有限公司,广东 广州 510240)
探讨单增李斯特菌(Listeria monocytogenes,LM)生物菌膜的生长特性及亚甲基蓝对LM生物菌膜光动力杀伤作用。通过结晶紫染色法判断与观察LM生物菌膜的形成并用酶标仪在595 nm波长处对其不同生长阶段的生物量进行测定,同时通过细菌平板菌落计数法研究亚甲基蓝对LM生物菌膜的光动力杀伤作用。结果表明:结晶紫染色法可用于定性判断与观察LM生物菌膜,且随着培养时间的延长,LM生物菌膜生物量不断增加,形成的网状结构越来越致密。当光敏剂质量浓度为10 μg/mL的亚甲基蓝在光功密度为200 mW/cm2的可见光照射30 min时,即可使LM生物菌膜的失活率达到99.99%以上,其菌落数降低了4.08(lg(CFU/mL))。亚甲基蓝对LM生物菌膜的光动力灭活作用非常显著,其杀伤效果主要取决于光敏剂质量浓度和光照时间。
生物菌膜;单增李斯特菌;亚甲基蓝;光动力灭菌技术
自然界中各种微生物并非仅以单个的浮游菌(planktonic)存在,主要是以生物菌膜(biofilm,BF)形式生存[1-2]。BF是指细菌在适宜条件下附着于介质表面并不断增殖形成复杂膜状结构,主要由吸附的细菌及其分泌的胞外多糖、蛋白质等物质构成的细菌群落[3-4]。相比于浮游状态的细菌,BF具有更复杂的结构及较强的群体感应(quorum sensing,QS)[5-6],其对常用灭菌方法(如热杀菌、生物杀菌剂、辐射杀菌等)有更强的抵抗能力[7-8]且难以被彻底清除[9]。因此,病原微生物一旦在食品加工设备表面吸附、形成BF后,受到加工污染的食品,灭菌将变得更加困难,从而影响食品安全[10]。研究认为,在食品加工环境中形成BF的主要食品致病菌是单增李斯特菌(Listeria monocytogenes,LM)[10-11]。LM是最重要的食源性致病菌之一,已引发多起食源性疾病[12],临床死亡率高达20%~30%[13]。即食肉制品、家禽制品及冷藏冷冻食品极易受LM的污染[14],导致潜在食物中毒。
光动力灭菌技术(anti-microbial photodynamic technology,APDT)是利用光敏剂对活性细菌的优先聚集特性,在特定波长的光照射激发下,光敏剂吸收能量产生单线态氧、自由基等活性氧物质,再通过氧化作用灭活细菌,而不伤害周围组织和细胞的杀菌技术[15]。本课题组前期研究已经证实APDT对曲霉孢子[16]、蜡样芽孢杆菌[17]、金黄色葡萄球菌[18]、沙门氏菌[19]、LM[20]及大肠杆菌O157[21]等浮游菌具有显著的杀菌效果。
亚甲基蓝是一种溶于水中具有阳性电荷的碱性染料,基于其高浓度时仍对人类的低毒性而被广泛应用于新鲜冷冻血浆中病毒的光灭活研究[22]。本实验选用LM菌标准菌株ATCC19111作为实验菌株,对LM生物菌膜的形成过程进行观察并以亚甲基蓝(methylene blue,MB)作为光敏剂,探讨MB-APDT对LM生物菌膜的杀伤效果。
1 材料与方法
1.1 菌株与培养基
LM标准株ATCC19111 广州市微生物研究所。
细菌计数培养基、LB肉汤培养基 青岛海博生物技术有限公司。
1.2 试剂与仪器
亚甲基蓝 上海红绿光敏剂研究所有限公司;结晶紫 天津市科密欧化学试剂开发中心;75 W溴钨灯(光功密度200 mW/cm2) 北京卓立汉光仪器有 限公司;MK3酶标仪 美国赛默飞世尔;双目型XSP-2CA显微镜 上海团结仪器制造有限公司。
1.3 菌种培养及前处理
将活化的 LM 接种于5 mL胰蛋白胨大豆肉汤(tryptone soy broth,TSB)培养基中,37 ℃振荡培养至对数生长期后期(约12~14 h);以4 500 r/min离心10 min,弃上清液,重新悬浮菌体于0.1 mol/L、pH 7.4的无菌磷酸缓冲溶液(phosphat buffered saline,PBS)中,调整其 OD600nm值为0.4左右 (约为108CFU/mL)。
1.4 LM生物菌膜形成的判定与检测
1.4.1 结晶紫染色法观察LM生物菌膜
在96孔平底板中加入200 μL LB肉汤培养基(含0.45 g/100 mL葡萄糖)[23],再加入10 μL已制备的菌悬液,在37 ℃培养48 h,吸出菌悬液,用无菌水洗数次以去除浮游菌;加200 μL 0.5%的结晶紫染色5 min,用无菌水洗至无紫色脱出,自然干燥,拍照。同时,做空白对照组(不加菌悬液培养)。
在6孔平底板(放置了18 mm×18 mm的载玻片)中加入5 mL LB肉汤培养基(含0.45 g/100 mL的葡萄糖),再加入50 μL菌悬液,在37 ℃分别培养0、24、48、72 h,小心取出载玻片,用无菌水洗数次以去除浮游菌;用10%甲醇固定10 min,再加0.5%结晶紫染色5 min,用无菌水洗至无紫色脱出,自然干燥,置显微镜下观察。同时,做空白对照组(不加菌悬液培养)。
1.4.2 96孔酶标板制备LM生物菌膜及其生物量的测定
取10 μL处理好的菌悬液接种到已加有200 μL LB肉汤培养基(含0.45 g/100 mL葡萄糖)的96孔平底酶标板中,分别在37 ℃培养0、4、8、12、24、48、72、96、120 h,按如下操作[24]:吸出菌悬液,用无菌水洗数次以去除浮游菌;加 200 μL 0.5%的结晶紫染色5 min,用无菌水洗至无紫色脱出;再用95%乙醇溶解5 min,酶标仪于595 nm波长处测其光密度值。同时,做空白对照组。实验重复3次,取平均值。用OD595nm值反映生物量的大小。
1.5 APDT对LM生物菌膜的灭活实验
1.5.1 MB质量浓度对LM生物菌膜失活率和菌落数的影响
取10 μL制备的菌悬液接种到有200 μL LB肉汤培养基(含0.45 g/100 mL葡萄糖)的96孔板中,在37 ℃培养24 h,吸出菌悬液,用无菌水洗数次以去除浮游菌;加入不同质量浓度的MB(0、0.01、0.1、1、10、50 μg/mL),37 ℃避光孵育30 min,将96孔板放置于溴钨灯光前20 cm处,照射30 min。光照组用L+表示,同时设置对照组(不光照组:L-)。
1.5.2 光照时间对LM生物菌膜失活率和菌落数的影响
LM生物菌膜处理同1.4.1节,加入1 μg/mL MB,37 ℃避光孵育30 min,将96孔板放置于溴钨灯光源前20 cm处,分别照射0、5、10、20、30 min。光敏剂组用S+表示,同时设置对照组(不加光敏剂组:S-)。
1.5.3 细菌平板菌落计数
按照1.4.1、1.4.2节不同方式处理后,将96孔杯放入超声振荡仪中,振荡(2.5×104Hz)30 s,间隔30 s,重复3次,使得生物菌膜完全从96孔杯壁及底部脱落下来,分散于菌悬液中。将所得的菌悬液均以1∶10梯度稀释,各取100 μL梯度稀释液涂板于细菌计数培养基平板中,于37 ℃生化培养箱中恒温培养,48 h后取出进行菌落计数。实验重复3次,取平均值。

式中:N对照组菌落数/(CFU/mL);n为实验组菌落数/(CFU/mL)。
1.6 统计学分析
2 结果与分析
2.1 结晶紫染色法判定LM生物菌膜的形成
图1A表示在96孔酶标板中培养LM生物菌膜,用结晶紫染色后能清楚地看到被染上紫色的环,即为生物菌膜,无紫色环的孔杯为空白对照组。图1B~E表示在载玻片上培养且经过结晶紫染色后用显微镜观察的LM生物菌膜照片,其中,图1B为培养0 h,即空白载玻片观察到的图片,无紫色的菌体;图1C一部分菌株相连且呈较稀疏的网状结构;图1D相比培养24 h 的生物菌膜,相连菌株数量明显增多且网状结构更密集;图1D可见大量菌株相连且网状结构致密。LM生物菌膜结晶紫染色法观察结果分析发现,从浮游菌到生物菌膜是一个菌体数量由少到多,菌膜结构由简单到复杂的形成过程,这与已有研究报道结果基本一致,Lizcano等[25]对肺炎链球菌BF的形成研究表明,BF形成初期只有薄薄的一层;培养中期菌体数大量增加形成“地毯”;后期BF形成厚厚的融合层,部分菌体聚集成团。

图1 结晶紫染色法观察LLMM的生物菌膜Fig.1 Formation of L.monocytogenes biofilms visualized by crystal violet staining
2.2 LM生物菌膜生物量变化

图 2 LM生物菌膜培养120 h的光密度变化Fig.2 Optical density of L.monocytogenes biofilms during 120 h incubation
由图2可知,随着培养时间的增加,光密度不断上升,即生物菌膜的生物量不断增加。在最初的8 h,生物量增长速度最快;随着生物菌膜不断生成并趋向成熟,生物量增长平稳。这也说明在生物菌膜形成过程中,菌体数量由少到多聚集,与2.1节的分析结果相吻合。
2.3 MB质量浓度对LM生物菌膜光动力灭活作用的影响
由图3可知,当MB的质量浓度低至0.01 μg/mL时,光照30 min,能够使LM杀伤效果约为60%;当MB质量浓度为50 μg/mL时,几乎全部LM生物菌膜都被灭活,菌落数降低约7(lg(CFU/mL))。因此,在相同光照条件下,随着MB质量浓度的增加,光动力杀菌技术对LM生物菌膜的杀伤作用逐渐增强。而光敏剂对照组和光照对照组均没有明显的灭活作用。

图3 不同质量浓度MB对 LM生物菌膜失活率(A)和菌落数(B)的影响Fig. 3 Effect of MB concentration on inactivation rate (A) and colony counts (B) of L. monocytogenes biofilms
2.4 光照时间对LM生物菌膜APDT灭活作用的影响
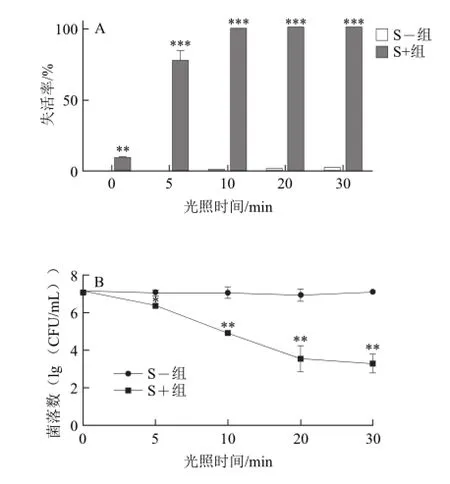
图4 不同光照时间对LM生物菌膜失活率(A)和菌落数(B)的影响Fig.4 Effect of illumination time on inactivation rate (A) and colony counts (B) of L. monocytogenes biofilms
由图4可知,当MB质量浓度为1 μg/mL时,光照5 min即可使约80%的LM生物菌膜失活;当光照时间为30 min时,可以使LM生物菌膜的失活率达到99.99%。表明当MB质量浓度一定时,APDT对LM生物菌膜的杀伤作用随着光照时间的延长而增强。
本课题组前期研究[16-21]已经证实APDT对浮游菌具有显著的杀菌效果。本实验进一步证实APDT对于结构更复杂、对常用杀菌方法抵抗力更强的生物菌膜也有非常强的灭活作用。但相较于浮游的LM[20],要达到相同的灭活效果,仅需要MB的质量浓度为0.2 μg/mL,同样光源下光照10 min。即相对于浮游菌,使LM生物菌膜灭活需要更高浓度的光敏剂和更长的光照时间,也说明生物菌膜更难被消灭与控制。这与Buchovec等[26]的研究结果基本相似,以5-氨基乙酰丙酸(5-aminolevulinic acid,ALA)为光敏剂对LM浮游菌及LM生物菌膜进行光动力灭菌,生物菌膜所需的光敏剂质量浓度比浮游LM使用的质量浓度更高,光照时间更长。
3 结 论
结晶紫染色法可用于定性判断与检测单增李斯特菌生物菌膜的形成且能用于观察其菌膜形成的状况,此法简单易行。在一定培养时间内,单增李斯特菌生物菌膜随着培养时间延长,其生物量不断增加且菌膜的网状结构变得更为致密,此结果可用于解释为什么生物菌膜比浮游菌更难消灭与控制,也为选择灭活生物菌膜的更佳条件提供依据。光敏剂亚甲基蓝质量浓度为10 μg/mL在光功密度为200 mW/cm2的溴钨灯下光照30 min,可使单增李斯特菌生物菌膜的失活率达到99.99%以上,其菌落数降低了4.08(lg(CFU/mL))。因此,亚甲基蓝对单增李斯特菌生物菌膜有非常显著的光动力灭活作用,其效果主要受光敏剂质量浓度和光照时间的影响。光动力杀菌技术可作为一种有效的非热生物菌膜灭活技术应用于食品加工设备及食品加工环境中的消毒灭菌。
[1] POULSEN L V. Microbial biofilms in food processing[J]. Lebensmittel-Wissenschaft & Technologie, 1999, 32: 321-326.
[2] PRAKASH B, VEEREGOWDA B M, KRISHNAPPA G. Biofilms: a survival strategy of bacteria[J]. Current Science, 2003, 85(9): 1299-1307.
[3] MOLOBELA I P, ILUNGA F M. Impact of bacterial biofilms: the importance of quantitative biofi lm studies[J]. Annals of Microbiology, 2012, 62(2): 461-467.
[4] RAMAGE G, VANDE WALLE K, WICKES B L, et al. Characteristics of biofi lm formation by Candida albicans[J]. Revista Iberoamericana de Micologia, 2001, 18(4): 163-170.
[5] RICE S A, KOH K S, QUECK S Y, et al. Biofilm formation and sloughing in Serratia marcescens are controlled by quorum sensing and nutrient[J]. Journal of Bacteriology, 2005, 187(10): 3477-3485.
[6] WILLIAMS P. Quorum sensing, communication and cross-kingdom signaling in the bacterial world[J]. Microbiology-SGM, 2007, 153: 3923-3938.
[7] ANDERSON G G, O’TOOLE G A. Innate and induced resistance mechanisms of bacterial biofi lms[J]. Current Topics in Microbiology and Immunology, 2008, 322: 85-105.
[8] RAY V A, MORRIS A R, VISICK K L. A semi-quantitative approach to assess biofilm formation using wrinkled colony development[J]. Journal of Visualized Experiments, 2012, 64:e4035. doi: 10.3791/4035.
[9] FUX C A, COSTERTON J W, STEWART P S, et al. Survival strategies of infectious biofi lms[J]. Trends in Microbiology, 2005, 13(1): 34-40.
[10] CHMIELEWSKI R A N, FRANK J F. Biofi lm formation and control in food processing facilities[J]. Comprehensive Reviews in Food Science and Food Safety, 2003, 2: 22-32.
[11] REIJ M W, den AANTREKER E D. Recontamination as a source of pathogens in processed foods[J]. International Journal of Food Microbiology, 2004, 91(1): 1-11.
[12] GILMOUR M W, GRAHAM M, DOMSELAAR G V, et al. Highthroughput genome sequencing of two Listeria monocytogenes clinical isolates during a large foodborne outbreak[J]. BMC Genomics, 2010, 11: 120-135.
[13] GOMBAS D E, CHEN Y H, CLAVERO R S, et al. Survey of Listeria monocytogenes in ready-to-eat Foods[J]. Journal of Food Protection, 2003, 66(4): 570-577.
[14] ZHU Meijun, DU Min, CORDRAY J, et al. Control of Listeria monocytogenes contamination in ready-to-eat meat and products[J]. Comprehensive Reviews in Food Science and Food Safety, 2005, 4(2): 34-42.
[15] MAISCH T. Anti-microbial photodynamic therapy: useful in the future[J]. Lasers in Medical Science, 2007, 22(2): 83-91.
[16] 李颖, 唐书泽, 任雅清, 等. 光敏化作用对曲霉孢子失活的影响[J].食品与发酵工业, 2008, 34(8): 22-24.
[17] 任雅清, 唐书泽, 吴希阳, 等. 光动力对细菌的杀伤作用研究[J]. 中国调味品, 2008(6): 37-40.
[18] 任雅清, 唐书泽, 吴希阳, 等. 光动力对金黄色葡萄球菌的杀伤作用及其AFM观察[J]. 食品与发酵工业, 2008, 34(8): 56-59.
[19] 严琼琼. 血啉甲醚对沙门氏菌的光动力作用及其失活机制研究[D].广州: 暨南大学, 2010.
[20] LIN Shaoling, HU Jiamiao, TANG Shushu, et al. Photodynamic inactivation of methylene blue and tungsten-halogen lamp light against food pathogen Listeria monocytogenes[J]. Photochemistry and Photobiology, 2012, 88(4): 985-991.
[21] 唐姝姝, 唐书泽, 李红爱, 等. 亚甲基蓝对大肠杆菌O157的光动力杀伤作用及机理[J]. 食品与发酵工业, 2012, 38(7): 25-29.
[22] DETTY M R,GIBSON S L,WAGNER S J. Current clinical and preclinical photosensitizers for use in photodynamic therapy[J]. Journal of Medicinal Chemistry, 2004, 47(16): 3897-3915.
[23] SHEIKN J, HICKS S, DALL’AGNOL M, et al. Roles for fis and yafk in biofilms formation by enteroaggregative Escherichia coli[J]. Molecular Microbiology, 2001, 41(5): 983-997.
[24] DI BONAVENTURA G, PICCOLOMINI R, PALUDI D, et al. Influence of temperature on biofilm formation by Listeria monocytogenes on various food-contact surfaces:relationship with motility and cell surface hydrophobicity[J]. Journal of Applied Microbiology, 2008, 104(6): 1552-1561.
[25] LIZCANO A, CHIN T, SAUER K, et al. Early biofilm formation on microtiter plates is not correlated with the invasive disease potential of Streptococcus pneumonia[J]. Microbial Pathogenesis, 2010, 48: 124-130.
[26] BUCHOVEC I, PASKEVICIUTE E, LUKSIENE Z. Photodynamic inactivation of food pathogen Listeria monocytogenes[J]. Food Technology and Biotechnology, 2010, 48(2): 207-213.
Antimicrobial Photodynamic Activity of Methylene Blue against Listeria monocytogenes Biofilms
LI Hong-ai1, TANG Shu-shu1, LIU Yong-qiang2, DENG Xi1, TANG Shu-ze1,*, WU Xi-yang1, CHEN Zhen-qiang1
(1. College of Science and Engineering, Jinan University, Guangzhou 510632, China; 2. Guangzhou Huangshanghuang Group Co. Ltd., Guangzhou 510240, China)
The formation of Listeria monocytogenes (LM) biofi lms (BF) and its photodynamic inactivation by methylene blue (MB) were investigated. The LM BF formation process was identifi ed by crystal violet staining, and the amount of biomass was tested with an enzyme-linked immunosorbent assay (ELISA) plate reader at 595 nm. The inactivation effect of MB on LM BF was verifi ed by counting colony-forming units (CFU). Res ults indicated that crystal violet staining could be used to visualize and quan tify LM BF. The amount of biomass increased and the formed network structure became more complicated as the incubation time was extended. Over 99.99% of LM BF was inactivated and colony-forming units were reduced by 4.08 (lg(CFU/mL)) after illumination with visible light (power density 200 mW/cm2) for 30 min. LM BF were effectively inactivated by MB, and the effi cacy mainly de pended on the concentration of photosesitizer and illumination time.
biofi lm (BF); Listeria monocytogenes (LM); methylene blue (MB); anti-microbial photodynamic technology (APDT)
TS207.3
A
1002-6630(2014)03-0144-04
10.7506/spkx1002-6630-201403029
2013-01-12
广东省自然科学基金资助项目(S2012010008479);广东省突发公共事件应急技术研究中心专项([2011]733)
李红爱(1987—), 女,硕士研究生,研究方向为食品安全。 E-mail:lha_sunny@hotmail.com
*通信作者:唐书泽(1957—),男, 教授,博士后,研究方向为食品安全。E-mail:tangsz@jnu.edu.cn
