苦参碱二元醇质体的制备及其质量评价
2014-01-13何冰倩李俊丽刘小平林如文
何冰倩, 李俊丽, 刘小平, 林如文
(武汉理工大学化工学院制药工程系,湖北 武汉430070)
苦参碱(Matrine)是豆科植物苦参、苦豆子、山豆根等药用植物的活性成分,于1958 年被首次分离和确认,属四环喹嗪啶类化合物[1],具有抗菌、抗炎、抗心律失常、抗肿瘤等重要作用。现代药理研究表明,苦参碱对多种病原微生物、阴道滴虫等有显著抑制作用,故常用于治疗妇科炎症。由于妇科炎症发病率高、发作反复、临床表现多样化、发作年龄段广等特点,因此对妇科炎症的治疗刻不容缓[2]。目前,临床治疗主要以局部给药为主,常用的有栓剂、软膏、溶液等[3]。但由于存在皮肤角质层的屏障作用使得药物难以透过皮肤发挥药效,临床疗效差。所以促进药物在给药部位的渗透吸收成为研究热点。
醇质体(Ethosomes)是一种由磷脂、高浓度低分子量的醇、水组成的具有脂质双分子层结构的新型柔性脂质体,能有效地运送药物通过角质层进入皮肤更深层甚至血液循环,凭借其高渗透率、高包封率、高变形性等显著优点越来越受到青睐[4-5]。但醇质体中存在的高浓度乙醇的挥发性易引起稳定性问题,用乙醇和丙二醇的混合醇替换单一的乙醇来制备醇质体,即二元醇质体,与普通醇质体相比,具有良好的变形性、透皮性及稳定性,具有良好的应用前景[6-7]。
本实验拟制备苦参碱二元醇质体,对其处方进行优化,并对其质量控制进行研究,以期为研发新型苦参碱制剂奠定实验基础。
1 仪器与材料
1.1 仪器 FA2004 电子分析天平(上海精密科学仪器有限公司);DF-101S 恒温加热磁力搅拌器(巩义市英峪予华仪器厂);TGL16C 超速离心机(上海安亭科学仪器厂);LC-20AT 高效液相色谱仪(HPLC,日本岛津);BI-200SM动态光散射仪(DLS,美国BROOKHAVEN);Tecnai G220 S-TWIM 透射电子显微镜(TEM,美国FEI);LS-3000 低温光照仪(药物制剂国家工程研究中心)。
1.2 材料 苦参碱 (江苏天晟药业有限公司,批号20130203,纯度98%);苦参碱对照品(中国食品药品检定研究院,批号110805-201302);卵磷脂、胆固醇等(均购于国药集团化学试剂有限公司);其他试剂均为分析纯,流动相所用乙腈、乙醇(色谱纯,国药集团化学试剂公司)。
2 方法与结果
2.1 醇质体的制备
2.1.1 苦参碱二元醇质体的制备 采用醇注入法制备[8]。称取处方量卵磷脂溶于处方量乙醇与丙二醇混合溶液中,同时称取处方量苦参碱溶于处方量醋酸盐缓冲液(pH =4.5)。(37 ±1)℃恒温密封持续搅拌条件下,将醇相缓慢注入到水相中,注射完毕后,继续恒温搅拌30 min,过0.22 μm 滤膜滤过即得醇质体溶液。
2.1.2 空白醇质体的制备 称取处方量卵磷脂溶于处方量乙醇与丙二醇混合溶液中,量取处方量醋酸盐缓冲液,其他操作同上。
2.2 苦参碱测定方法的确定
2.2.1 色谱条件 YMC-Pack NH2色谱柱 (4.6 mm ×250 mm,5 μm);流动相乙腈-乙醇(9 ∶1,V/V);体积流量0.8 mL/min;检测波长215 nm;柱温室温;进样量20 μL。
2.2.2 标准曲线的确定 精密称取10 mg 苦参碱对照品,置于100 mL 量瓶中,加流动相溶解,稀释至刻度并摇匀,得100 μg/mL 的苦参碱溶液。精密量取上述溶液1 mL 置于100 mL 量瓶中,另取1、2、4、6、8 mL 分别置于10 mL 量瓶中,加流动相稀释至刻度并摇匀,分别得苦参碱质量浓度为1、10、20、40、60、80、100 μg/mL 的溶液。按“2.2.1”项下条件进行检测,以峰面积(A)对质量浓度(C)进行线性回归,得回归方程A =32 046C +22 081,r2=0.999 1,结果表明苦参碱在1 ~100 μg/mL 范围内峰面积与质量浓度呈良好的线性关系。
2.2.3 方法学考察
2.2.3.1 精密度试验 精密吸取低、中、高质量浓度苦参碱对照品溶液,分别按“2.2.1”项下条件进行检测,重复进样5 次,以峰面积计算,RSD 分别为0.59%、0.76%、0.57%,平均RSD=0.64%。
2.2.3.2 稳定性试验 精密吸取低、中、高质量浓度苦参碱对照品溶液,分别在0、24、48 h 按“2.2.1”项下条件进行检测,以峰面积计算,RSD 分别为0.83%、0.75%、0.76%,平均RSD=0.78%,表明标准溶液在48 h 内稳定性良好。
2.2.3.3 回收率试验 量取3 份空白醇质体溶液10 mL,分别加入苦参碱对照品100、200、300 mg,使苦参碱完全溶解。按“2.2.1”项下条件进行检测,以峰面积计算,求得平均回收率为96.88% (n=9);RSD 为0.47%。
2.2.3.4 供试品溶液专属性 供试品溶液的制备:精密吸取苦参碱二元醇质体溶液0.1 mL,置于10 mL 量瓶中,加适量甲醇破乳,加流动相定容摇匀后,即得供试品溶液。空白对照溶液:精密吸取空白醇质体溶液0.1 mL,置于10 mL量瓶中,加适量甲醇破乳,并用流动相定容摇匀后,即得空白对照溶液。
专属性试验 精密吸取苦参碱对照品溶液、供试品溶液和空白对照液,按“2.2.1”项下条件进行测定,色谱图见图1。表明苦参碱对照品及所制备的苦参碱二元醇质体在该色谱条件下4 min 左右出峰,峰形稳定,且空白醇质体对苦参碱的测定无干扰。
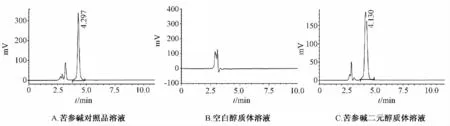
图1 3 种溶液的HPLC 图谱
2.3 包封率的测定 量取苦参碱二元醇质体0.5 mL 置于超滤离心管中,置于超速离心机中以12 000 r/min 离心20 min,离心完成后吸取下层清液0.1 mL 于10 mL 量瓶中,用流动相定容摇匀后,按“2.2.1”项下条件进行测定,计算游离药物质量m游;精密吸取0.1 mL 醇质体,甲醇破乳,0.22 μm 微孔滤膜滤过后进行测定,计算醇质体中药物总量m总,包封率(%) = (m总-m游)/m总×100%。
2.4 渗漏率的测定 测定苦参碱二元醇质体制备完成首日的包封率后,在一定条件下保存一段时间后再测定其包封率,渗漏率(%) = (首日包封率-定期测定包封率)/首日包封率×100%。
2.5 正交试验优化苦参碱二元醇质体处方 通过考察单因素试验的结果,选择对苦参碱二元醇质体包封率影响较大的乙醇与丙二醇醇溶液总体积与醋酸盐缓冲液的体积比(A)、苦参碱与卵磷脂质量比(B)、乙醇与丙二醇的体积比(C)作为考察因素,每个因素取3 个水平,选L9(34)正交表进行处方正交试验设计,以包封率为筛选指标,确定苦参碱二元醇质体的最佳制备工艺。考察因素与水平见表1,实验设计及结果见表2。由表2 可知,可知对包封率的影响因素大小为B >A >C,A3B3C2为较优处方。按照最佳处方制备3 组苦参碱二元醇质体,可得包封率分别为65.38%、68.01%、67.56%,平均包封率为66.98%。
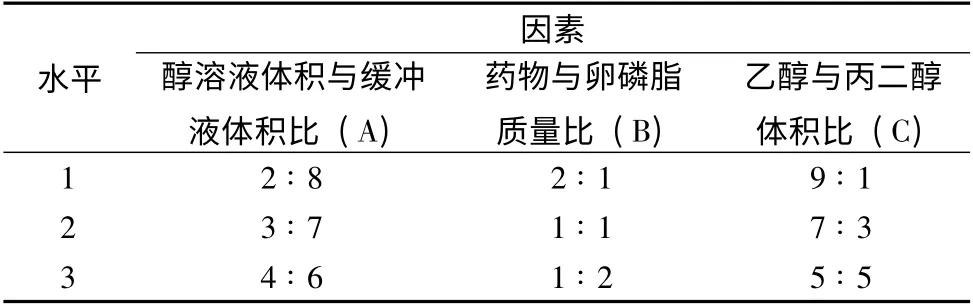
表1 L9(34)正交试验因素水平
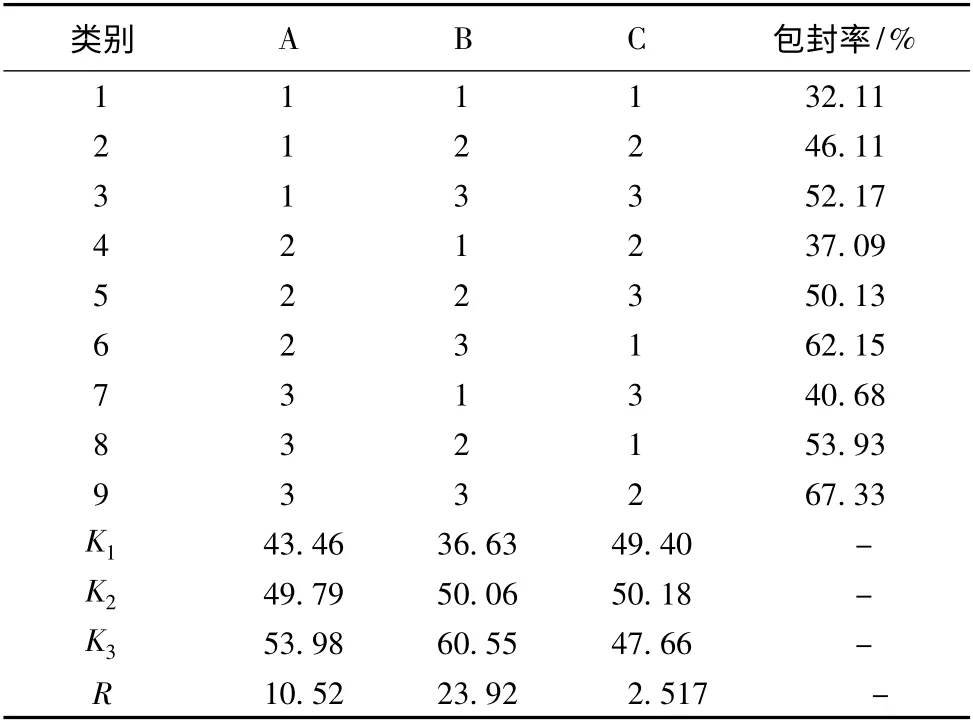
表2 正交试验设计与结果(n=3)
2.6 苦参碱二元醇质体的质量控制研究
2.6.1 形态观察 将苦参碱二元醇质体样品用30%乙醇溶液稀释10 倍,取一定量的稀释液,固定于铜丝网格上,用透射电子显微镜观察,可见醇质体为类球状小囊泡,形态圆整。

图2 苦参碱二元醇质体在透射电子显微镜下的形态
2.6.2 粒径 取苦参碱二元醇质体适量,适当稀释后用动态光散射仪测定其粒径及分布,结果见图3。结果显示,较优方案制备的苦参碱二元醇质体平均粒径为275.8 nm,聚合度为0.064,分布均匀。
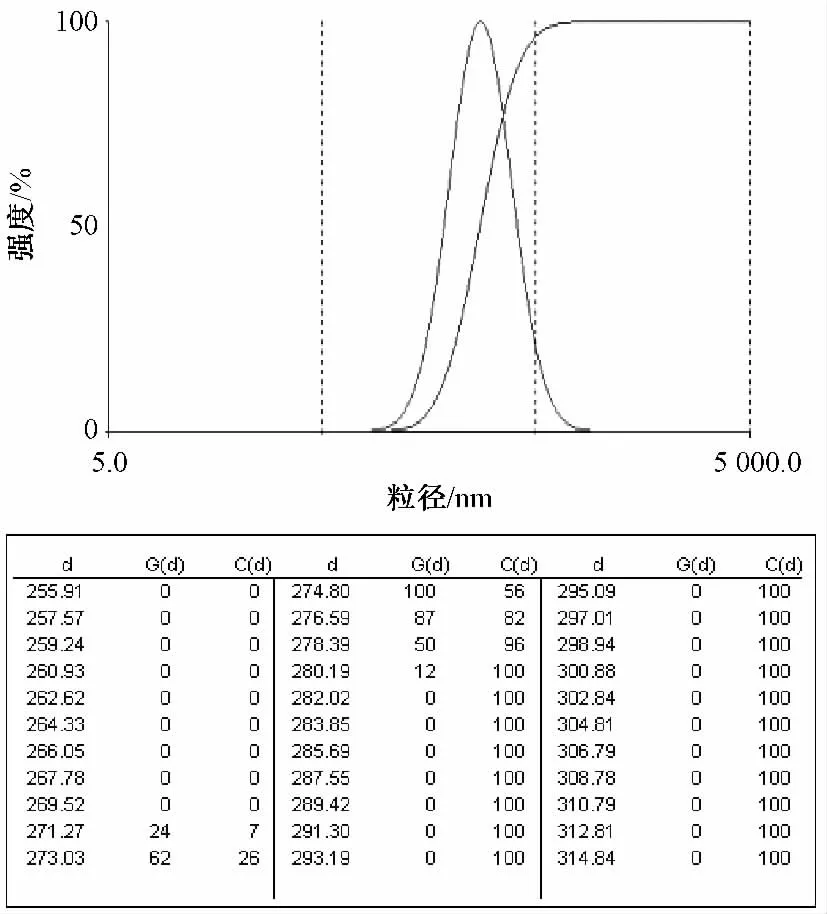
图3 苦参碱二元醇质体粒径分布图(Gd 为醇质体个数,Cd 为累积百分比)
2.7 初步稳定性试验
2.7.1 渗漏率的测定 采用最佳制备工艺制备的苦参碱二元醇质体3 批测得首日包封率后,于冰箱4 ℃保存7 d 后依照“2.4”项下的方法测定其渗漏率,平均首日包封率为67.12%,7 d 后平均包封率为66.58%,渗漏率为0.81%。
2.7.2 光照对稳定性的影响 采用最佳制备工艺制备的苦参碱二元醇质体3 批测得首日包封率后,于低温光照仪4 ℃、4 500 Lx 照度条件下保存14、30 d 后测其渗漏率。首日包封率为68.11%,14 d 后包封率为64.48%,渗漏率为5.33%;30 d 后包封率为59.48%,渗漏率为12.67%。分别对制备当天及光照条件下保存14 d 及30 d 后的醇质体进行形态观察:制备当天的苦参碱二元醇质体为均匀同质的乳白色溶液,光照下有蓝色乳光。在4 ℃、4 500 Lx 照度条件下保存14 d,仍为均匀同质的乳白色溶液,光照下有蓝色乳光;30 d 后颜色不及刚制备时明亮,有少许沉淀,轻轻摇晃,可恢复原状。
2.7.3 温度对稳定性的影响 测定采用最佳制备工艺制备的苦参碱二元醇质体6 批的平均首日包封率,将其分为两组分别置于低温(4 ℃)及室温(25 ℃)下避光保存30 d,两组首日包封率分别为67.38%、67.12%,30 d 后包封率分别为65.33%、58.83%,渗漏率分别为2.58%、12.36%。分别对制备当天及30 d 后的醇质体进行形态观察:刚制备完成的苦参碱二元醇质体为均匀同质的乳白色溶液,光照下有蓝色乳光。在4 ℃条件下避光放置30 d 后,无明显变化;在室温(25 ℃)条件下密封避光放置30 d 后,有少许沉淀产生,无明显颜色变化,轻轻摇晃后可恢复原状。
3 讨论
采用醇注入法制备的苦参碱二元醇质体为类球状小囊泡,形态圆整,具有较高的包封率,平均粒径为275.8 nm,聚合度为0.064,分布均匀。且实验设备操作简单,重现性好,安全性更佳。通过对苦参碱二元醇质体处方的正交筛选结果可知,丙二醇的适当加入可使醇质体包封率增加,可能的原因是丙二醇分子渗入到磷脂膜材中降低了醇质体双分子层内的流动性,增加其亲水性,使苦参碱药物分子进入其中而使包封率增加。但当丙二醇的质量分数增大到一定程度时,磷脂膜柔性过大可以形成粒径更小的醇质体使内水相减少,导致包封率降低[9]。另外,通过对醇质体的初步稳定性试验,确定了其贮存条件及存放时间,对保证制剂的质量具有一定的实际意义。
醇质体具有磷脂膜结构,能够很好地融合或者穿透皮肤细胞。其中含有的高体积分数乙醇在一定程度上起到了促渗作用,提高药物疗效,但其也具有较大挥发性,稳定性差,使药物容易泄露,在一定程度上限制了其应用。而丙二醇黏度较大,不易挥发,刺激性小,可改善挥发性及对皮肤的刺激性,增加醇质体的稳定性。同时,丙二醇作为透皮吸收促进剂时,单独应用的效果不佳,而与其他促进剂合用,可增加药物及促进剂的溶解度。丙二醇与乙醇合用,与普通醇质体相比,既可产生显著的促透协同作用,也可增加药物的溶解度[10]。
[1] 张军芳,韩 飞. 苦参碱制剂的临床应用研究进展[J].西部中医药,2012,25(5):107-110.
[2] 李伟泽,赵 宁,闫菁华,等. 阴道用苦参柔性脂质体泡沫气雾剂的制备研究[J]. 中成药,2012,24(1):41-45.
[3] 刘星言,刘 宏,张阳德,等. 苦参碱醇质体的制备及其体外透皮性能[J]. 中国组织工程研究与临床康复,2009,25(13):4857-4860.
[4] Liu X P,Lin R W,Zhu F,et al. Evaluation of in vitro percutaneous permeation and anti-inflammatory and antinociceptive activity of aconitine ethosomes[J]. Lat Am J Pharm. 2013,32(7):960-967.
[5] Nikalje A P,Tiwari S. Ethosomes:A novel tool for transdermal drug delivery[J]. Int J Res Pharm Sci,2012,2(1):1-20.
[6] Zhou Y,Wei Y H,Liu H X,et al. Preparation and in vitro evalution of ethosomal total alkaloids of sophora alopecuroides loaded by a transmembrane pH-gradient method[J]. Pharm Sci Tech,2010,11(3):1350-1358.
[7] 王 军,何 文. 酮洛芬二元醇质体凝胶的研制及其质量考察[J]. 中国药师,2012,15(6):780-782.
[8] 杨羽行,刘小平. 美洛昔康醇质体凝胶的研制[J]. 中国医药导报,2011,35(8):78-80.
[9] 韩文霞,李伟泽,汪兴军,等. 盐酸青藤碱纳米柔性脂质体的制备及其性质研究[J]. 中草药,2011,42(4):671-675.
[10] 袁李芳,何 文,陈 莎. 盐酸青藤碱二元醇质体的制备及其体外性质研究[J]. 山西医科大学学报,2012,43(9):658-661.
