高效液相色谱法测定金银花中绿原酸和木犀草苷的含量
2014-01-08潘文琴杭州市拱墅区康桥街道社区卫生服务中心杭州3100浙江工业大学药学院杭州310015
刘 琴 ,潘文琴(1.杭州市拱墅区康桥街道社区卫生服务中心,杭州 3100;.浙江工业大学药学院,杭州310015)
金银花化学成分复杂,现已鉴别出70 多种。对金银花及其枝叶的有效成分绿原酸的含量测定方法较多,但对木犀草苷的测定报道较少。使用高效液相色谱(HPLC)法测定金银花中绿原酸和木犀草苷的鲜有研究。本文探索并优化HPLC法,选择最佳的色谱条件,测定金银花中绿原酸和木犀草苷这2 个有效成分的含量。
1 材料
1.1 仪器与试药
岛津LC-10ATvp 高效液相色谱仪;R224CN 电子天平;KQ3200 超声波清洗器。
1.2 药品与试剂
绿原酸对照品(批号:12031401,成都曼思特生物科技有限公司生产);木犀草苷对照品(批号:10122401,成都曼思特生物科技有限公司生产);金银花药材:为忍冬科植物忍冬的干燥花蕾及初开的花(华东医药有限公司生产)。甲醇(色谱纯,TEDIA Company.INC 生产);乙睛(色谱纯,上海汇普工业化学品有限公司生产);超纯水、冰乙酸(分析纯,杭州市北大桥化工区生产);乙醇(色谱纯,天津市四友精细化学品有限公司生产);精密pH 试纸0.45 μm;微孔滤膜。
2 方法与结果
2.1 色谱条件
色谱柱:依利特Hypersil ODS2(4.6 mm×250 mm,5 μm);流动相:0.5% 冰乙 酸-乙腈;线性梯度洗脱:0~20 min(90∶10~78 ∶22),20~35min(78 ∶22~76 ∶24),35~37min(76 ∶24~65 ∶35),37~40 min(65 ∶35~90 ∶10);流 速:1.0 ml/min;检测波长:绿原酸326 nm,木犀草苷350 nm;柱温:30 ℃;进样量:10 μl。
2.2 溶液的制备
2.2.1 供试品溶液的制备:(1)金银花供试品溶液的制备:精密称取金银花粉末0.5 g,置于锥形瓶中,精密加入70%甲醇50 ml,称定质量,超声处理(功率250 W,频率35 kHz)30 min,放冷,再称定质量,用70%甲醇补足减失的质量,摇匀,过滤。(2)绿原酸供试品溶液的制备:精密移取上述滤液5~25 ml 置容量瓶中,加70%甲醇至刻度,摇匀即得。(3)木犀草苷供试品溶液的制备:精密移取上述滤液1~10 ml 置容量瓶中,加70%甲醇至刻度,摇匀即得。
2.2.2 对照品溶液的配制:(1)绿原酸对照品溶液的制备:精密称定绿原酸对照品10.0 mg,用70% 甲醇溶解并转移置100 ml容量瓶中,加70%甲醇至刻度,摇匀。(2)木犀草苷对照品溶液的制备:精密称定木犀草苷对照品10.0 mg,用70%甲醇溶液并转移置50 ml 容量瓶中,加70%甲醇至刻度,摇匀。精密移取上述溶液1~50 ml 容量瓶中,加70%甲醇至刻度,摇匀。(3)流动相溶液0.5%冰乙酸的配制:量取2.5 ml 冰乙酸,用重蒸水定容至500 ml,混合均匀,测定pH 值,用0.45 μm微孔滤膜过滤,并超声脱气20 min,备用。
2.3 色谱条件的选择
2.3.1 绿原酸检测波长的确定:进绿原酸对照品溶液10 μl,扫描波长,结果显示,在波峰达100 mAV 时,绿原酸的检测波长范围在300~340 nm,最佳检测波长为326 nm。
2.3.2 木犀草苷检测波长的确定:进木犀草苷对照品溶液10 μl,扫描波长,结果显示,在波峰达175 mAU 时,木犀草苷的检测波长范围在245~270 nm/330~360 nm,最佳检测波长为350 nm。
2.4 流动相的确定
2.4.1 流动相配比:流动相为:0.5%冰乙酸-乙腈(A-B)。实验以洗脱时间为因素,经15 次无机相和有机相配比调整,得绿原酸和木犀草苷色谱图。观察两者分离效果。结果表明:最佳的流动相配比为:0~20 min(90∶10~78∶22),20~35 min(78∶22~76∶24),35~37 min(76∶24~65∶35),37~40 min(65∶35~90∶10),该流动相分离效果好,峰形好,且峰高和峰面积较高。第13 个流动相色谱图见图1,其他14 个配比流动相比例的分离效果均不理想。
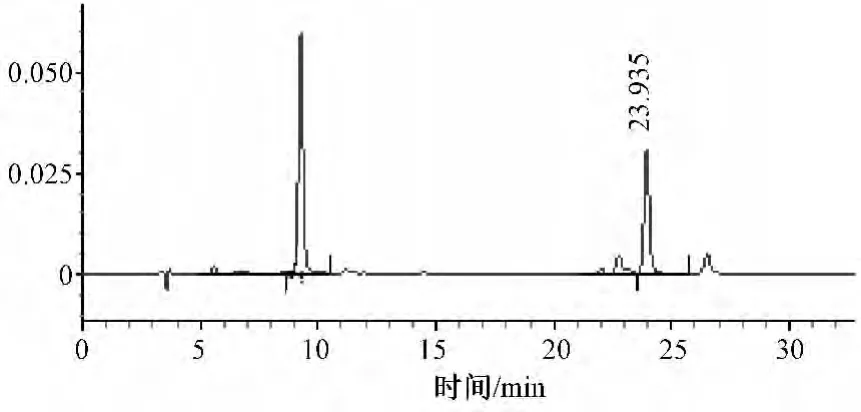
图1 绿原酸和木犀草苷色谱图Fig 1 HPLC chromatogram of Chlorogenic acid and Luteoloside
2.4.2 其他条件的确定:多次试验验证,柱温为30 ℃、流速为1.0 ml/min 时,金银花中绿原酸和木犀草苷的分离效果良好。
2.5 线性关系考察试验
分别精密移取绿原酸对照品溶液2、4、6、8、10 ml 置10 ml容量瓶中,加70%甲醇至刻度,摇匀。各取10 μl 进样,得绿原酸标准曲线:Y= 26 347 606.481 5X- 76 704.900 0(R2=0.999 0),线性区间为0.021 6~0.108 0 mg/ml。分别精密移取木犀草苷对照品溶液1、2、3、4、5 ml 置10 ml 容量瓶中,加70%甲醇至刻度,摇匀。各取10 μl 进样,得木犀草苷标准曲线:Y=28 566 947.115 4X+22.150 0(R2=0.999 1),线性区间为0.000 416~0.002 080 mg/ml。
2.6 仪器精密度考察试验
各取绿原酸和木犀草苷对照溶液10 μl,分别连续进样,绿原酸进样5 次、木犀草苷进样6 次。绿原酸对照品峰面积为1 545 705、1 595 679、1 591 407、1 591 079、1 599 343,RSD为1.39%;木犀草苷对照品峰面积为59 965、60 026、60 136、59 872、60 042、60 338,RSD为0.267%,结果表示精密度均良好。
2.7 重复性试验
各取绿原酸和木犀草苷对照溶液样品10 μl,分别连续进样6 次。绿原酸对照品峰面积为1 892 130、1 891 252、1 883 133、1 884 348、1 874 805、1 878 004,RSD为0.368%;木犀草苷峰面积为31 823、31 789、31 944、31 825、32 045、32 313,RSD为0.632%,结果表明重复性良好。
2.8 重现性试验
精密称取同一批金银花粉末6 份,每份0.5 g,按供试品方法分别制备供试品溶液6 份,分别进样10 μl。得绿原酸峰面积为1 585 941、1 600 474、1 649 284、1 628 870、1 505 830、1 513 773,RSD 为3.746%;得木犀草苷峰面积为33 561、33 732、35 696、35 559、35 526、35 908,RSD为3.018%。
2.9 加样回收率试验
精密称取同一批金银花粉末3 份,每份0.5 g,按供试品方法分别制备供试品溶液分别进样10 μl。结果表明,该方法具有良好的回收率,见表1。

表1 绿原酸和木犀草苷加样回收率试验结果Tab 1 Results of recovery test on chlorogenic acid and luteoloside
2.10 稳定性试验
2.10.1 绿原酸稳定性试验:精密移取绿原酸对照品溶液2、10 ml,分别加70%的甲醇至10 ml,摇匀,绿原酸在0、6、12、24、48 h 进样。低浓度(0.019 8 mg/ml)的绿原酸在各时间段的峰面积为610 754.5、621 798、628 247、625 951、671 158;高浓度(0.099 0 mg/ml)的绿原酸在各时间段的峰面积为3 105 036、3 180 842、3 242 950、3 323 039、3 861 145。结果表明,绿原酸对照品溶液在24 h 内稳定,绿原酸峰面积的RSD分别为1.25%和2.88%;绿原酸在48 h 内不稳定。
2.10.2 木犀草苷稳定性试验:精密移取木犀草苷对照品溶液1、5 ml 加70%甲醇至10 ml,摇匀,在0、6、12、24、48 h、6 d进样。低浓度(0.000 416 mg/ml)的木犀草苷在各时间段的峰面积为11 905.5、12 114、12 105、11 967、12 696、13 964;高浓度(0.002 080 mg/ml)木犀草苷在各时间段的峰面积为59 918.5、60 392、61 026、60 547、68 433、70 342。结果表明,木犀草苷对照品溶液在48 h 内稳定,木犀草苷峰面积的RSD分别为2.62%和0.755%;木犀草苷在6 d 内不稳定。
2.11 样品含量测定
不同提取方法的含量测定结果见表2。比较4 种提取样品中绿原酸和木犀草苷含量的方法,考虑提取方法操作的方便性和经济性,本实验选择提取方法为“70%甲醇50 ml,超声处理30 min”。
3 讨论
3.1 检测波长的适应性
对绿原酸与木犀草苷紫外扫描图可知,绿原酸的检测波长范围在300~340 nm,最佳检测波长为326 nm,与《中华人民共和国药典》推荐的检测波长327 nm 基本一致[1];木犀草苷的检测波长范围在245~270 nm/330~360 nm,最佳检测波长为350 nm。两者共同吸收的波长范围还是较宽,两者重叠波长在300~340 nm,与黄海侠的结论基本一致,与《中华人民共和国药典》推荐的检测波长350 nm 和张元元实验结果有些出入[2-3]。同时测定绿原酸与木犀草苷时,可根据具体情况选择最佳波长。

表2 不同提取方法样品中绿原酸和木犀草苷的含量Tab 2 Contents of chlorogenic acid and luteoloside extracted by different extraction method
3.2 最佳色谱条件的选择
绿原酸与木犀草苷极性相差大,且样品中两者含量差别也大,一般等度洗脱不能将两者分离,须选择最佳色谱条件,方可取得满意的提取效果。经考察,最终确定HPLC 法测定金银花中2 种成分含量的最佳色谱条件即流动相:0.5%冰乙酸-乙腈,线性梯度洗脱:0~20 min(90∶10~78∶22),20~35 min(78∶22~76∶24),35~37 min(76∶24~65∶35),37~40 min(65∶35~90∶10);流速:1.0 ml/min;检测波长:绿原酸326 nm,木犀草苷350 nm;柱温:30 ℃;色谱柱:依利特Hypersil ODS2(4.6 mm×250 mm,5 μm);进样量:10 μl。在此色谱条件下2 种成分完全分离。
3.3 金银花有效成分提取方法
比较了不同提取方法的提取率,最优的提取方法为精密称取金银花粉末0.5 g,置于锥形瓶中,加入70%甲醇50 ml,称定质量,超声处理(功率250 W,频率35 kHz)30 min,放冷,再称定质量,用70%甲醇补足减失的质量,摇匀,滤过[4]。测得的绿原酸和木犀草苷的含量分别为3.416%、0.124%。该方法提取时间短,方法简、效果好。
[1] 国家药典委员会.中华人民共和国药典: 一部[S].2010 年版.北京:中国医药科技出版社,2010:595-596.
[2] 王海侠,汪玮鑫,时维静,等.金银花中绿原酸和木犀草苷的同时提取及测定研究[J].安微科技学院学报,2011,25(5):37-41.
[3] 张元元,李进,陈涛,等.高效液相色谱法同时测定金银花中绿原酸和木犀草苷的含量[J].天津中医药大学学报,2011,30(2):107-109.
[4] 许哲,朱国庆.金银花提取工艺研究[J].黑龙江医药,2010,23(3):396-398.
