肉碱/有机阳离子转运体OCTN1/2在眼表上皮细胞的定位及功能*
2014-01-01安翠平毕建成李宝全许顺江宋国威
安翠平, 毕建成, 李宝全, 许顺江, 宋国威
1河北省石家庄市第一医院检验科,石家庄 050011
2河北省中医院检验科,石家庄 050011
3河北医科大学第一医院中心实验室,石家庄 050031
干眼症(dry eye syndrome,DES)又称角结膜干燥症,是眼科的常见病,可引起上皮干燥和角膜刺激征,严重影响患者的生活质量。引起干眼症的关键因素之一是眼表渗透压的升高,导致眼表上皮细胞皱缩甚至死亡。为缓解眼内高渗状态,人们在人工泪液中加入多种可溶性物质,滴入眼中以平衡眼内渗透压,有助于眼表组织细胞的生存[1]。有报道认为左旋肉碱(L-carnitine)具有调节渗透压的作用,可作为治疗干眼症的可溶性物质之一[2-3]。临床研究发现干眼症患者局部应用左旋肉碱可以迅速、持久地改善眼部症状[4]。这些结果表明左旋肉碱除了已知的有助于长链脂肪酸进入线粒体形成乙酰化肉碱酯类进行β氧化以外,对保持眼内局部渗透压的稳定具有重要作用[5]。但是,左旋肉碱分子在眼表上皮细胞的转运机制至今未明。
近年来大量研究表明,有机阳离子转运蛋白(organic cation transporter,OCTN)可转运肉碱进入细胞内,故又称肉碱/有机阳离子转运蛋白[6]。OCTN包括OCTN1、OCTN2和OCTN3三个亚型,其中OCTN3仅在小鼠体内表达[7]。我们的前期工作采用RT-PCR和Western blot法分别在基因和蛋白水平证实了OCTN1和OCTN2在人角膜和结膜上皮细胞的表达(待发表),但其在人眼表上皮组织的分布与定位及对左旋肉碱的转运功能尚不清楚。
本研究采用免疫细胞化学和免疫组织化学的方法分别检测HCLE和HCjE细胞以及兔眼角膜和结膜上皮组织中OCTN1和OCTN2的分布和定位,并从功能上研究左旋肉碱在这些细胞的转运特性,以揭示左旋肉碱在人眼表上皮细胞的转运机制,为临床应用左旋肉碱治疗干眼症及开发含左旋肉碱的人工泪液提供理论依据。
1 材料与方法
1.1 试剂与主要仪器
无血清角质细胞培养液(K-SFM)、表皮生长因子(epidermal growth factor,EGF)、DMEM/F12培养液购于美国Invitrogen-Gibco公司;羊抗人OCTN1和OCTN2多克隆抗体、配套供应的抗原阻断肽及德克萨斯红(Texas Red)标记的兔抗羊IgG抗体购于美国 Santa Cruz公司;[3H]-L-carnitine购于英国GE Healthcare公司;其余试剂购于美国Sigma公司。8孔腔式培养玻片(eight-well chamber slides)和Ⅰ型胶原蛋白包被的双层培养板购于美国Falcon公司;上皮伏特欧姆表(epithelial voltohm meter,EVOM)购于澳大利亚 Word精密仪器公司;CO2培养箱购于德国Heraeus公司;Nikon 80i荧光显微镜购于日本Nikon公司;LS-6500型多功能液体闪烁计数器购于美国贝克曼公司。
1.2 细胞培养
本研究所用人角膜缘上皮细胞和人结膜上皮细胞(HCLE和HCjE,美国波士顿Schepens眼科研究所Ilene Gipson教授惠赠)按文献[8]报道方法培养。将复苏传代的HCLE和HCjE细胞用无血清K-SFM培养液悬浮,接种于100mL培养瓶中(2×104/cm2),加入25μg/mL牛垂体浸膏、0.2ng/mL表皮生长因子和0.4mmol/L CaCl2,置37℃、5%的CO2培养箱内培养至覆盖50%瓶底时,更换为1∶1混合培养液(KSFM和低钙的DMEM/F12)继续培养备用。
1.3 免疫细胞化学分析
将HCLE或HCjE细胞接种于用Ⅰ型胶原蛋白包被的8孔腔式培养玻片上(10μg/cm2),加入K-SFM培养液培养至覆盖70%底部。去掉培养液,用PBS液洗涤细胞3次。在每孔中加入0.8 mL 3.7%的甲醛,室温下固定细胞15min,用PBS清洗,再用含5%Triton X-100的PBS液孵育细胞20min,对细胞进行打孔。用封闭液(含3%BSA的兔血清)封闭细胞1h,以阻断非特异性结合。加入羊抗人OCTN1或OCTN2多克隆抗体孵育细胞,4℃环境过夜。PBS清洗3次后,室温下加入荧光标记的二抗避光孵育细胞1h。PBS清洗,用含有核酸染料DAPI的封片剂封片,荧光显微镜下拍照。为保证抗体反应的特异性,用正常羊血清取代一抗作为阴性对照。另设一组,加入一抗和含有OCTN1或OCTN2结合位点合成肽的混合液,竞争性结合OCTN1或OCTN2多克隆抗体,进行阻断反应。细胞核用DAPI染为蓝色。
1.4 免疫组织化学分析
取新西兰大白兔1只,雌性,体重2.3kg,购于河北省实验动物中心。肌注克他命(ketamine,35 mg/kg)和甲苯噻嗪(xylazine,5mg/kg)麻醉动物,摘取眼球于3.7%的甲醛中固定。分离角膜和结膜组织,石蜡包埋、切片(厚度2μm)、脱蜡和水化后,以0.4%胃蛋白酶在37℃环境中孵化3h,进行抗原修复。余下步骤同1.3项。
1.5 放射摄入实验
将HCLE或HCjE细胞接种于用Ⅰ型胶原蛋白包被的双层培养板上层微孔滤膜上(孔径0.45 μm),细胞密度为1×106/cm2,培养细胞至满层并建立紧密连结(tight junctions),用上皮伏特欧姆表检测跨上皮电阻值(transepithelial electrical resistance,TER),以无细胞微孔滤膜上下两侧的电阻值作为基线值。当细胞长成紧密单层细胞且具有最大电阻值时,可用于后续的放射摄入实验。首先吸掉单层细胞上下两侧的培养液,并用摄入缓冲液(uptake buffer,含 25mmol/L Tris/HEPES,140 mmol/L NaCl,5.4mmol/L KCl,1.8mmol/L CaCl2,0.8mmol/L MgSO4和5mmol/L葡萄糖,pH 7.4.)洗涤2次后,置37℃、5%的CO2培养箱内孵育60min;然后,分别在微孔滤膜的上层(细胞顶端)、下层(细胞基底端)和上下两层(总和)加入含24nmol/L[3H]-L-carnitine的摄入缓冲液继续孵育30min。另设一组加入含有过量非标记左旋肉碱(20mmol/L)的摄入缓冲液作为非特异性摄入。孵育结束后吸掉摄入缓冲液,迅速用冰冷的PBS洗涤细胞2次,每次30s,以终止摄入反应。将剩余PBS吸干净,加入0.2mL细胞裂解缓冲液(含0.1mol/L NaOH,0.1%Triton X-100)充分裂解细胞,振荡混匀。取10μL用于蛋白定量。另取100μL加入10mL闪烁液,在液体闪烁计数器上测定细胞内放射性强度,计算HCLE或HCjE细胞通过顶端或基底端摄取[3H]-L-carnitine的量(fmol/mg蛋白)。该实验每组做3个平行管,整个实验重复4次。
1.6 统计学分析
2 结果
2.1 OCTN1和OCTN2蛋白在HCLE和HCjE细胞的表达
采用免疫细胞化学的方法分别检测OCTN1和OCTN2蛋白在HCLE和HCjE细胞的表达(见图1、2)。结果显示:在HCLE和HCjE细胞中均检测到了清晰而强烈的荧光信号,并且主要分布在细胞膜上,阴性对照片则完全检测不到荧光信号。为了证实抗体反应的特异性,我们在加入一抗的同时,加入过量的抗原阻断肽来竞争性结合特异性抗体,结果只能检测到微弱荧光信号,表明加入的抗原阻断肽与检测标本具有相同的结合位点,能够阻断一抗与细胞上OCTN1或OCTN2蛋白的结合,从而证实了该反应的特异性。
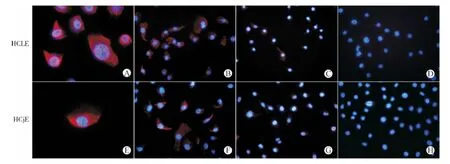
图1 免疫细胞化学方法检测OCTN1在HCLE和HCjE细胞的表达与分布Fig.1 Expression and distribution of OCTN1in HCLE and HCjE cells detected by immunohistochemistry

图2 免疫细胞化学方法检测OCTN2在HCLE和HCjE细胞的表达与分布Fig.2 Expression and distribution of OCTN2in HCLE and HCjE cells detected by immunohistochemistry
2.2 OCTN1和OCTN2蛋白在兔角膜和结膜上皮组织中的表达
采用免疫组织化学的方法分别检测OCTN1和OCTN2蛋白在兔角膜和结膜上皮组织中的表达(图3)。结果显示:在兔角膜和结膜上皮组织中均检测到了清晰而强烈的荧光信号,并且主要分布在细胞的顶端,阴性对照片则完全检测不到荧光信号,抗原阻断片仅检测到微弱荧光信号。另外,OCTN1在兔角膜和结膜上皮组织中表达的荧光信号强度基本相似,但OCTN2在兔结膜上皮组织中表达的荧光信号强度明显高于角膜上皮组织。

图3 免疫组织化学方法检测OCTN1和OCTN2在兔眼表上皮组织的表达与分布(×40)Fig.3 Expression and distribution of OCTN1and OCTN2in ocular surface epithelial tissues of rabbits detected by immunohistochemistry(×40)
2.3 HCLE和HCjE细胞对左旋肉碱的摄取功能
采用放射摄入实验观察HCLE和HCjE细胞对左旋肉碱的摄取功能。将HCLE或HCjE细胞接种于用Ⅰ型胶原蛋白包被的双层培养板上层微孔滤膜上后,随着细胞的生长,上下两层培养液之间的跨上皮电阻值逐渐递增。当细胞培养至第3天时,获得最大电阻值,提示细胞生长到满汇合并建立了紧密连结。此时在培养液中加入放射性标记的左旋肉碱,观察HCLE和HCjE细胞对左旋肉碱的转运功能。结果显示HCLE和HCjE细胞通过细胞顶端摄入的[3H]-L-carnitine明显多于基底端,差异有统计学意义(P<0.01,图4)。
3 讨论

图4 HCLE和HCjE细胞通过基底端或顶端摄入游离[3 H]-L-carnitine相对量的比较Fig.4 Comparison of relative[3 H]-L-carnitine intake by apical part and basal part of HCLE and HCjE cells
左旋肉碱是一种小分子化合物,在促进脂肪酸的β氧化方面具有重要作用,可作为载体携带长链脂肪酸进入线粒体内氧化供能,并维持辅酶A在细胞内的稳态[9]。左旋肉碱的缺乏可导致疲劳、肌无力、心肌病、低血糖症及意识混乱等疾病[7]。哺乳动物体内左旋肉碱的主要来源是通过饮食摄入和少量自身合成[7]。左旋肉碱通过有机阳离子转运系统运输,以保持其在体内多种组织中的浓度稳定性,如骨骼肌和心肌等[10-12]。OCTN1和 OCTN2是新型有机阳离子转运体(organic cation transporter,OCT)超家族成员[6,13],是与左旋肉碱具有高亲和力的运输蛋白。眼部组织和泪液中含有一定量的游离左旋肉碱,其一方面可以保护角膜上皮细胞免受干眼症时高渗透压的损害,另一方面也可以保护视网膜色素上皮细胞免受氧化应激损害,提示这种微量营养素在防止氧化应激导致的眼病中具有重要作用[14]。有功能性研究提示兔眼角膜和结膜存在载体介导的有机阳离子转运系统[4,15]。然而,目前尚未见在分子水平的确切研究报道。
我们的前期研究采用RT-PCR和Western blot法分别在基因和蛋白水平证实了OCTN1和OCTN2在人角膜和结膜上皮细胞的表达。本研究采用免疫细胞化学的方法观察到OCTN1和OCTN2蛋白在HCLE和HCjE细胞均有表达,且主要分布在细胞膜上,符合跨膜蛋白的特点。进而,我们采用免疫组织化学的方法观察到兔角膜/结膜上皮组织中均表达OCTN1和OCTN2蛋白,二者主要分布在细胞的顶端,这与我们前期的Western blot分析结果一致。提示这2种转运蛋白主要位于HCLE和HCjE细胞的顶端。这种位于顶端的极性表达曾在呼吸道上皮和胎盘的合胞体滋养层细胞被发现[16]。另外,有研究应用抗乙酰化微管抗体进行双染发现,上皮细胞基底部纤毛上表达OCTN2,但不表达OCTN1[17]。关于OCTN1和OCTN2在多种组织细胞表达和分布不同的意义目前还不清楚。
阐明眼表上皮细胞内肉碱转运体的表达和定位具有重要意义。有研究发现左旋肉碱能够保护视网膜色素细胞免受过氧化氢诱导的氧化损伤,乙酰化的左旋肉碱可以促进视神经生长发育和增强视觉功能[14],二者还可以保护α-晶状体蛋白的分子伴侣活性,减少氧化应激引起的翻译后修饰效应,并阻止白内障的形成[18]。另外,干眼症通常是机体老化的结果,其特点是眼表上皮细胞发生炎症反应及分泌产生高渗性泪膜[19],有研究显示左旋肉碱作为一种可溶性物质,可以保护角膜上皮细胞免受高渗性应激损伤[4],提示左旋肉碱可以维持眼内环境稳定,对干眼症具有潜在的治疗作用。本研究的功能实验结果表明HCLE和HCjE细胞均可将培养液中游离的左旋肉碱摄入细胞内,并且通过细胞顶端摄入的左旋肉碱明显多于基底端,这与其在细胞上的分布特点相一致。本研究结果为研究角膜和结膜上皮细胞左旋肉碱运输过程提供了结构和功能基础。关于OCTN1和OCTN2在HCLE和HCjE细胞转运左旋肉碱的功能特点及影响因素还需进一步的研究。
总之,本研究结果表明人角膜和结膜上皮细胞存在功能性OCTN1和OCTN2转运蛋白的表达,并且OCTN1和OCTN2主要分布于HCLE和HCjE细胞的顶端。为进一步研究左旋肉碱在眼表上皮细胞的转运机制及功能特点提供了实验依据。
[1] Pessotto P,Liberati R,Petrella O,et al.In experimental diabetes the decrease in the eye of lens carnitine levels is an early important and selective event[J].Exp Eye Res,1997,64(2):195-201.
[2] Corrales R M,Luo L,Chang E Y,et al.Effects of osmoprotectants on hyperosmolar stress in cultured human corneal epithelial cells[J].Cornea,2008,27(5):574-579.
[3] Garrett Q,Min-Hsuan Shih S,Simmons P A,et al.Carnitine and the potential osmoprotectants protect corneal epithelial cells from hyperosmolar solution induced damage[C].Fort Lauderdale(FL):ARVO Annual Meeting,2010.
[4] Simmons P,Chang-Lin J,Chung Q,et al.Selection of compatible solutes for inclusion in a lubricant eye drop[C].Sicily(Italy):TFOS Meeting,2007September.
[5] Kerner J,Hoppel C.Genetic disorders of carnitine metabolism and their nutritional management[J].Annu Rev Nutr,1998,18(1):179-206.
[6] Grube M,Meyer zu Schwabedissen H E,Prager D.Uptake of cardiovascular drugs into the human heart:expression,regulation,and function of the carnitine transporter OCTN2(SLC22 A5)[J].Circulation,2006,113(8):1114-1122.
[7] Flanagan J L,Simmons P A,Vehige J,et al.Role of carnitine in disease[J].Nutr Metab(Lond),2010,7(1):30-43.
[8] Gipson I K,Spurr-Michaud S,Argueso P,et al.Mucin gene expression in immortalized human corneal-limbal and conjunctival epithelial cell lines[J].Invest Ophthalmol Vis Sci,2003,44(6):2496-2506.
[9] Zhang R,Zhang H,Zhang Z,et al.Neuroprotective effects of pre-treament with l-carnitine and acetyl-l-carnitine on ischemic injury in vivo and in vitro[J].Int J Mol Sci,2012,13(2):2078-2090.
[10] Inazu M,Takeda H,Maehara K,et al.Functional expression of the organic cation/carnitine transporter 2in rat astrocytes[J].J Neurochem,2006,97(2):424-434.
[11] Inazu M,Takeda H,Matsumiya T.Molecular and functional characterization of an Na-independent choline transporter in rat astrocytes[J].J Neurochem,2005,94(5):1427-1437.
[12] Kobayashi D,Goto A,Maeda T,et al.OCTN2-mediated transport of carnitine in isolated Sertoli cells[J].Reproduction,2005,129(6):729-736.
[13] Kwok B,Yamauchi A,Rajesan R,et al.Carnitine/xenobiotics transporters in the human mammary gland epithelia,MCF12 A[J].Am J Physiol,2006,290(3):R793-R802.
[14] Shamsi F A,Chaudhry I A,Boulton M E,et al.L-carnitine protects human retinal pigment epithelial cells from oxidative damage[J].Curr Eye Res,2007,32(6):575-584.
[15] Ueda H,Horibe Y,Kim K J,et al.Functional characterization of organic cation drug transport in the pigmented rabbit conjunctiva[J].Invest Ophthalmol Vis Sci,2000,41(3):870-876.
[16] Grube M,Schwabedissen H M,Draber K.Expression,localization,and function of the carnitine transporter OCTN2(SLCCA5)in human placenta[J].Drug Metab Dispos,2005,33(1):31-37.
[17] Horvath G,Schmid N,Fragoso M A,et al.Epithelial organic cation transporters ensure pH-dependent drug absorption in the airway[J].Am J Respir Cell Mol Biol,2007,36(1):53-60.
[18] Peluso G,Petillo O,Barbarisi A,et al.Carnitine protects the molecular chaperone activity of lens alpha-crystallin and decreases the post-translational protein modifications induced by oxidative stress[J].FASEB J,2001,15(9):1604-1606.
[19] De Paiva C S,Villarreal A L,Corrales R M.Dry eye-induced conjunctival epithelial squamous metaplasia is modulated by interferon-gamma[J].Invest Ophthalmol Vis Sci,2007,48(6):2553-2560.
