靶向瘦素基因小干扰RNA抑制肝星状细胞增殖和细胞内钙离子浓度*
2014-01-01薛秀兰林菊生
薛秀兰, 林菊生
1厦门大学附属第一医院感染科,厦门 361000
2华中科技大学同济医学院附属同济医院肝病研究所,武汉 430030
肝硬化是各种慢性肝病发展的最终阶段,是肝脏对各种慢性损伤的一种应答反应。尽管有许多关于肝硬化的研究,但肝硬化的机制尚未完全阐明。目前认为活化的肝星状细胞(hepatic stellate cell,HSC)是肝纤维化的主要来源细胞。HSC的激活最终可造成细胞外基质(extracellular matrix,ECM)在肝内过量沉积,导致肝纤维化[1]。各种生长因子和细胞因子可刺激HSC活化[2];活化的HSC钙离子通道大量开放,使细胞内钙离子浓度(intracellular Ca2+concentration,[Ca2+]i)增加,导致细胞收缩明显,钙离子在介导HSC舒缩中发挥重要作用[3]。此外,一系列证据还显示脂质蓄积与纤维化有一定的联系。流行病学研究证明肥胖和脂肪肝是酒精性肝病和慢性丙型肝炎发展成肝硬化的危险因子[4]。然而,目前还没有直接证据表明肝内脂肪累积与肝硬化有因果关联。
瘦素(leptin)是由ob基因编码的分泌型蛋白质,主要由贮脂细胞产生的。研究表明活化的HSC中leptin mRNA和蛋白质合成增加。有研究报道leptin在大鼠肝纤维化中起一定作用[5-6],然而leptin在肝硬化发展过程中的作用仍未明确。由于小干扰 RNA(small interfering RNA,siRNA)能够长期发挥阻断基因的作用[7],因此本研究构建leptinsiRNA转染HSC,观察其对HSC生物活性的影响和细胞内[Ca2+]i变化,以期为以leptin为靶点的肝纤维化基因治疗奠定基础。
1 材料与方法
1.1 实验试剂和主要仪器
瘦素兔抗鼠多克隆IgG抗体为Santa Cruz公司产品;RPMI-1640培养液为Gibco公司产品;MTT为美国Sigma公司产品。免疫组化SP试剂盒购自福州迈新生物技术开发公司。β-actin一抗、二抗为博士德生物工程有限公司产品。leptin-siRNA和siRNA对照组均为上海生工生物技术研究所合成,基因序列为:leptin-siRNA,上游引物5′-TCCCAACCCTCATCAAGACCATTGCCACCCAATGGTCTTGATGAGGGTTT-3′,下游引物 5′-CAAAAAACCCTCATCAAGACCATTGGGTGGCAATGGTCTTGATGAGGGTT-3′;siRNA 对照组,上游引物 5′-TCCCAGCATGCCGTACAGACATCTACCACCTTAGATGTCTGTACGGCATGCTT-3′, 下游 引 物 5′-CAAAAAGCATGCCGTACGACAATCTAAGGTGGTTAGATGTCTGTACGGCATGCT-3′。Annexin-FITCPI为南京凯基生物科技发展有限公司产品。脂质体Lipofectamine2000为Invitrogen公司产品。碘化丙啶(PI)购自Sigma公司。主要仪器:FCM流式细胞仪(美国BD公司);Ca2+成像系统(Olympus FV-300);倒置显微镜(O-lympus IX-70型);激光聚焦显微镜(Olympus FV-300)。
1.2 细胞培养和基因转染
细胞分为4组:正常对照组、空载体对照组、siRNA对照组和leptin-siRNA组。HSC由华中科技大学同济医学院附属同济医院肝病研究所提供。细胞复苏后,加入含10%FBS的RPMI-1640培养液,37℃恒温密闭式5%CO2培养箱培养。将细胞经0.25%胰酶消化后按每孔4×104个细胞接种至6孔培养板上,待细胞长至80%融合后进行转染。应用Lipofectamine2000转染,每孔 Lipofectamine 4 μL,siRNA质粒2μL。转染后在300μg/mL G418培养液中进行筛选,筛选3周后换新鲜不含抗生素的培养液继续培养。
1.3 免疫细胞化学SP法检测leptin蛋白表达
收集细胞并计数,取1×105细胞PBS洗3次后,用涂片机将细胞甩于已涂多聚赖氨酸的载玻片上。用1∶1丙酮和无水乙醇固定。加1∶10马血清封闭,37℃湿盒内放置30min。弃去血清,加一抗和二抗,加过氧化物酶标记的亲和素。浸入新鲜底物溶液(DAB 50mg+100mL THB),显色并照相。
1.4 Western blot测定leptin蛋白含量
每组收集1×107细胞,冷PBS洗涤细胞2次,常温晾干,加入50μL裂解液裂解细胞,样品冰浴45min,Bradford法检测蛋白质含量,取上述蛋白50μg进行聚丙烯酰胺凝胶电泳及转移电泳,随后与特异性抗体进行Western blot分析。一抗为羊抗鼠leptin多克隆蛋白抗体(1∶100),二抗用辣根过氧化酶标记的IgG抗体(1∶1 000),杂交膜用增强化学发光试剂盒(ECL)法于暗室显影并照相。
1.5 细胞周期检测
采用流式细胞仪分析细胞DNA含量。以0.25%胰酶和0.02%EDTA处理各组细胞,用冷PBS洗涤,然后悬浮在冰冷的反应缓冲液中,使细胞密度为1×106/mL;取100μL细胞悬液加入5 μL PI室温避光染色30min,再加入反应缓冲液400 μL终止反应,流式细胞仪检测。实验重复3次。
1.6 细胞活性检测
以MTT法检测细胞活性。分别在96孔板上按4 000~6 000个/孔接种各组细胞,于细胞处理24、48、72h后,每孔加入20μL 0.5%MTT 溶液37℃作用4h;再加入150μL/孔DMSO,置摇床上摇10min,用自动酶标仪于490nm波长下测定吸光度(A)值。计算细胞抑制率=(1-实验组A值/正常对照组A值)×100%。
1.7 Fura-2/AM 检测[Ca2+ ]i
将第2代或第3代细胞接种于6孔板中,按照分组要求处理细胞,当细胞达80%融合时,用含Fura-2/AM的含钙液孵育细胞,去酯化。将灌流槽放于倒置荧光显微镜上进行观察,并用340nm与380 nm波长的激发光激发Ca2+荧光探针Fura-2发射荧光,用CCD拍摄荧光动态变化并通过钙荧光成像系统IPA software进行分析,以340nm和380nm激发波长下荧光强度比值反映[Ca2+]i。荧光强度越大,[Ca2+]i越高。以上每组实验重复5次。
1.8 流式细胞术检测细胞凋亡
收集各组细胞,预冷无钙PBS洗2次,调整细胞密度为1×106/L。70%乙醇4℃固定24h后加入RNA酶(终浓度为50μg/mL),37℃反应1h;100μg/mL碘化丙啶溶液染色20~30min后,流式细胞仪行单色荧光流式细胞计数,计算凋亡率。
1.9 统计学方法
应用SPSS 13.0统计软件进行分析,多组间均数的比较采用F检验,两组间均数的比较用t检验,以P<0.05为差异有统计学有意义。
2 结果
2.1 免疫细胞化学检测leptin蛋白的含量
leptin阳性染色呈黄~棕黄色颗粒,定位于细胞质。正常对照组、空载体组及siRNA对照组细胞着色呈强阳性(图1A~C);leptin-siRNA组呈弱阳性(图1D)。计算机图像分析系统测量显示:leptinsiRNA组的平均吸光度(A)值为(0.08±0.02),较正常对照组(0.13±0.01)明显减弱,差异有统计学意义(P<0.05);空载体组为(0.12±0.01),siRNA对照组为(0.11±0.02),与正常对照组比较差异均无统计学意义(均P>0.05)。

图1 免疫细胞化学法检测HSC细胞中leptin蛋白表达(SP法,×400)Fig.1 Expression of leptin protein detected by immunocytochemistry(SP method,×400)
2.2 Western blot分析leptin蛋白的表达
从图2可见leptin-siRNA组蛋白条带亮度明显低于正常对照组、空载体组和siRNA对照组。以leptin/β-actin灰度值比值反映leptin蛋白的表达,结果显示:正常对照组为(1.04±0.01),空载体组为(1.02±0.02),两组leptin蛋白表达差异无统计学意义(P>0.05);siRNA对照组为(1.00±0.02),与正常对照组相比差异亦无统计学意义(P>0.05);leptin-siRNA组为(0.90±0.03),明显低于正常对照组,差异有统计学意义(P<0.05)。
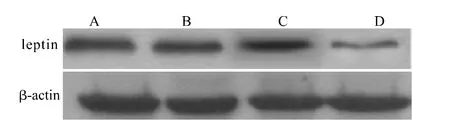
图2 leptin-siRNA抑制HSC中leptin蛋白的表达Fig.2 Inhibition of leptin protein expression by leptin-siRNA in HSC
2.3 细胞活性检测
以正常对照组细胞增殖抑制率为0,计算各实验组细胞增殖抑制率。Leptin-siRNA组与正常对照组、空载体组和siRNA对照组相比,增殖抑制率明显升高(均P<0.05),且随着时间增加(24、48、72 h),增殖抑制率逐渐升高,差异均有统计学意义(均P<0.05)。见表1。
表1 Leptin-siRNA转染后各时点HSC增殖抑制率(±s,%)Table 1 Proliferation inhibition rates of HSC after leptin-siRNA transfection(±s,%)
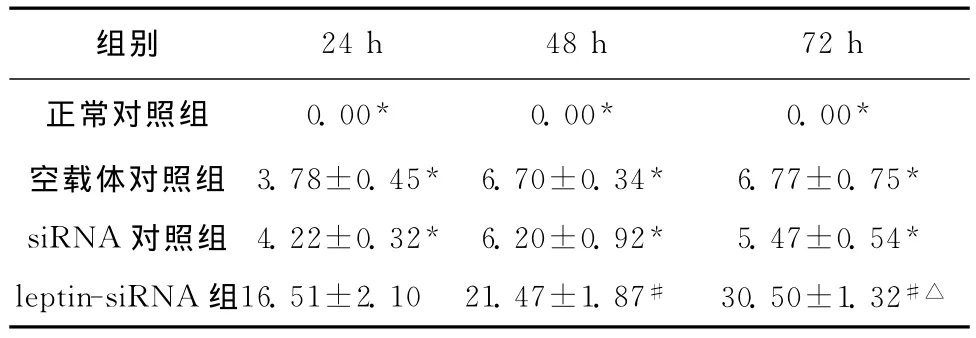
表1 Leptin-siRNA转染后各时点HSC增殖抑制率(±s,%)Table 1 Proliferation inhibition rates of HSC after leptin-siRNA transfection(±s,%)
与leptin-siRNA组比较,*P<0.05;与leptin-siRNA转染24h比较,#P<0.05;与leptin-siRNA转染48h比较,△P<0.05
组别24h 48h 72h正常对照组 0.00* 0.00* 0.00*空载体对照组 3.78±0.45* 6.70±0.34* 6.77±0.75*siRNA对照组 4.22±0.32* 6.20±0.92* 5.47±0.54*leptin-siRNA组16.51±2.10 21.47±1.87# 30.50±1.32#△
2.4 细胞周期及凋亡率分析
根据DNA含量直方图分析转染48h后HSC细胞周期各时相比率,分析结果表明,leptin-siRNA组的细胞周期有显著变化,出现明显的G1和G2期阻滞,表现为G1和G2期细胞增多,而S期细胞明显减少,从而导致HSC的有丝分裂延迟(表2)。各组细胞凋亡检测显示:空白对照、空载体对照组和siRNA对照组凋亡细胞数少,而leptin-siRNA组细胞凋亡比例高达为(53.60±10.11)%,明显高于其它各组(均P<0.01),见图3、表3。
2.5 细胞内[Ca2+]i测定
以340nm和380nm激发波长下荧光强度比值反映[Ca2+]i。与正常对照组相比,空载体和siRNA对照组的荧光强度无明显变化,HSC中[Ca2+]i变化不明显,差异无统计学意义(P>0.05)。Leptin-siRNA组荧光强度明显减弱,说明 HSC中[Ca2+]i下降,与其它各组相比差异有统计学意义(均P<0.05)。见表3。
表2 Leptin-siRNA转染后对HSC细胞周期的影响(±s,%)Table 2 Effect of leptin-siRNA transfection on cell cycle in HSC(±s,%)

表2 Leptin-siRNA转染后对HSC细胞周期的影响(±s,%)Table 2 Effect of leptin-siRNA transfection on cell cycle in HSC(±s,%)
与leptin-siRNA组比较,**P<0.01
组别 G0/G1期 G2/M期 S期正常对照组 47.45±4.68** 10.65±3.01** 32.01±2.38**空载体组 59.11±11.02**16.42±8.01** 28.45±4.20**siRNA对照组 64.48±6.63** 18.55±2.37** 29.15±3.56**leptin-siRNA组75.49±4.61 26.91±2.01 8.60±2.00

图3 流式细胞仪检测转染48h后HSC凋亡Fig.3 Flow cytometric analysis of HSCs 48hafter transfection with different siRNAs
表3 Leptin-siRNA转染48h后对HSC凋亡率和钙离子浓度的影响(±s,n=5)Table 3 Apoptosis rate and[Ca2+]iof HSC 48hafter leptin-siRNA transfection(±s,n=5)

表3 Leptin-siRNA转染48h后对HSC凋亡率和钙离子浓度的影响(±s,n=5)Table 3 Apoptosis rate and[Ca2+]iof HSC 48hafter leptin-siRNA transfection(±s,n=5)
与leptin-siRNA组比较,*P<0.05**P<0.01
组别 凋亡率(%) 荧光强度正常对照组 1.03±0.11** 1 032.01±42.56*空载体组 4.68±0.35** 938.11±55.30*siRNA对照组 4.37±0.24** 859.15±33.56*leptin-siRNA组53.60±10.11 604.61±165.20
3 讨论
肝纤维化的形成主要是由于HSC激活,ECM在肝内大量沉积所致。氧化应激、炎症、EMC的改变等因素可刺激HSC活化。在肝纤维化形成过程中,HSC数量是增多的,而在肝纤维化的逆转过程中其数量是减少的[1]。促进 HSC细胞凋亡、减少HSC数量、减少ECM已成为肝纤维化治疗的新策略[8-9]。Tang等[10]证 实leptin作 用 下 Ⅰ 型 前 胶 原mRNA水平增高;Leclercq等[11]发现leptin缺乏的ob/ob小鼠肝纤维化程度显著降低;临床实验表明leptin可能参与酒精性肝硬化[12]。因此,可以推断leptin参与了各种肝病的肝纤维化病理进程。而目前有关leptin对HSC活性的影响尚不明确。
本研究构建了leptin-siRNA,免疫细胞化学法及 Western blot检测显示leptin-siRNA可以沉默leptin基因表达,证实leptin-siRNA构建成功。leptin-siRNA转染HSC后,细胞生长受到抑制,细胞毒性分析(MTT法)显示leptin-siRNA组增殖抑制率明显升高(P<0.05),且随着时间延长,增殖抑制率逐渐升高。流式细胞检测表明leptin-siRNA可阻滞细胞于G1和G2期,S期细胞明显减少,从而导致细胞的有丝分裂延迟。同时,leptin-siRNA转染细胞后,可使细胞凋亡率升高(P<0.01),提示lep-tin可影响HSC活性,leptin表达的下调或缺失可抑制HSC的增殖,促进HSC的凋亡,进而可能抑制肝纤维化的进程。
Ca2+作为重要的细胞内信使,参与细胞多种生理活动的调控。活化的HSC钙通道大量开放,使得[Ca2+]i增加,增加[Ca2+]i与钙调蛋白结合,后者引起细胞收缩,细胞收缩使窦腔狭窄限制肝窦血流,增加肝内血管阻力,有利于门脉高压形成[3]。本实验细胞转染48h后,leptin-siRNA 组[Ca2+]i明显降低,因而推测leptin-siRNA可使HSC的收缩受到抑制。
总之,leptin表达在肝纤维化发生中起重要作用,利用 RNA 干扰技术,将leptin-siRNA 转染HSC后能明显降低leptin蛋白表达、抑制细胞内[Ca2+]i、抑制细胞增殖、促进细胞凋亡,为进一步以leptin为靶点的肝纤维化的基因靶向治疗提供了实验依据。
[1] Friedman S L.Seminars in medicine of the Beth Israel Hospital,Boston.The cellular basis of hepatic fibrosis.Mechanisms and treatment strategies[J].N Engl J Med,1993,3289(25):1828-1835.
[2] Friedman S L.Molecular regulation of hepatic fibrosis,an in-tergrated cellular response to tissue injury[J].J Biol Chem,2002,275(4):2247-2250.
[3] Yee H F Jr.Ca2+and rho signaling pathways:Two paths to hepatic stellate cell contraction[J].Hepatology,2001,33(4):1007-1008.
[4] Hourigan L F,Macdonald G A,Purdie D,et al.Fibrosis in chronic hepatitis C correlates significantly with body mass index and steatosis[J].Hepatology,1999,29(4):1215-1219.
[5] Anania F A.Leptin,liver,and obese mice-fibrosis in the fat lane[J].Hepatology,2002,36(1):246-248.
[6] Marra F.Leptin and liver fibrosis:a matter of fat[J].Gastroenterology,2002,122(5):1529-1532.
[7] Paddison P J,Caudy A A,Hannon G J.Stable suppression of gene expression by RNAi in mammalian cells[J].Proc Natl Acad Sci USA,2002,99(3):1443-1448.
[8] Oakley F,Meso M,Iredale J P,et al.Inhibition of inhibitor of kappaB kinases stimulates hepatic stellate cell apotosis and accelerated recovery from rat liver fibrosis[J].Gastroenterology,2005,128(1):108-120.
[9] 黄加权,焦云桃,李兰,等.siRNA干预CTGF和TIMP-1对大鼠肝星状细胞胶原分泌的影响[J].华中科技大学学报:医学版,2012,41(1):22-26.
[10] Tang M,Potter J J,Meze E.Leptin enhances the effect of transforming growth factor beta in increasing typeⅠcollagen formation[J].Biochem Biophs Res Commun,2002,297(4):906-911.
[11] Leclercq I A,Farrell G C,Schriemer R.Leptin is essential for the hepatic fibrogenic response to chronic liver injury[J].J Hepatol,2002,37(2):206-213.
[12] Schudoma C,May P,Nikiforova V,et al.Sequence-structure relationships in RNA loops:establishing the basis for loop homology modeling[J].Nucleic Acids Res,2010,38(3):970-980.
