Sertoli细胞对同种异体调节性T细胞/辅助性T细胞17分化平衡的调节作用*
2014-01-01陈莲一
陈莲一, 谢 林
1湖北省医学会,武汉 430071
2华中科技大学同济医学院附属同济医院器官移植研究所,器官移植教育部重点实验室,卫生部器官移植重点实验室,武汉 430030
现阶段,对血睾屏障的认识早已不仅仅局限于上皮细胞的紧密连接(解剖学屏障),Sertoli细胞等睾丸间质细胞形成的免疫屏障越来越受到研究者的重视,血睾屏障能够阻挡精子的抗原性,防止机体对精子产生抗体而发生自身免疫反应[1],因此睾丸也被认为是免疫特惠器官之一。基于Sertoli细胞表达及分泌的细胞因子在睾丸免疫特惠微环境中发挥着重要的免疫调节和免疫抑制作用,本课题旨在研究Sertoli细胞对同种异体免疫反应过程中调节性T细胞(Treg)/辅助性T细胞17(Th17)平衡的影响。
1 材料与方法
1.1 实验动物
选取雄性Balb/c小鼠,鼠龄为2周,用于获取睾丸Sertoli细胞和骨髓来源的树突状细胞(DC)。另选取雄性C57BL/6小鼠,鼠龄为4周,用于获取效应性T淋巴细胞。所有实验用小鼠均购自北京华阜康公司。
1.2 Sertoli细胞分离与培养
无菌条件下切取Balb/c小鼠睾丸,用含1 mmol/L乙二胺四乙酸(EDTA)和0.5%牛血清白蛋白(BSA)的 Hank’s平衡液(HBSS)清洗,剪碎至1mm×1mm×1mm小块;采用胶原酶Ⅴ(2.5mg/mL,Sigma公司)在37℃消化10min,其后用HBSS洗消化物3遍;再采用胰酶(25μg/mL,Sigma公司)及DNase(4μg/mL,Sigma公司)混合液在37℃消化10min,用HBSS洗4遍;最后将获得的细胞沉淀悬浮于高糖DMEM-F12培养液(含10%胎牛血清,Gibco公司)中,用500μm滤网过滤,接种于培养皿内,置于37℃、5%CO2培养箱中培养3d。
1.3 光学显微镜及电子显微镜下观察Sertoli细胞
将多聚赖氨酸处理过的玻片置于6孔板底,消化下的浓缩Sertoli细胞悬液吹打混匀后滴在玻片上,2h后再追加完全培养液。细胞培养过夜后,取出长有单层Sertoli细胞的玻片,37℃下以4%多聚甲醛固定10min,磷酸盐缓冲液(PBS)洗3遍,苏木精溶液染色15min,自来水冲洗终止反应,伊红溶液染色30s,自来水冲洗后用中性树胶封片。光学显微镜下观察。用胰酶将细胞消化下来后,将细胞悬液800r/min离心10min浓缩,然后将浓缩细胞悬液置于1.5mL Ependorf管中,1 500r/min离心10min,获得管底细胞沉淀;沿管壁缓慢加入2.5%戊二醛固定,用PBS洗3遍;然后加入1%锇酸后固定1h,PBS冲洗3遍;至室温下用梯度浓度丙酮脱水;包埋剂渗透、包埋后,制作超薄切片。切片用柠檬酸铅染色10min,去二氧化碳双蒸水洗3遍,再用醋酸铀染色30min,双蒸水洗3遍,干燥后,于透射电镜下观察。
1.4 T淋巴细胞分离
无菌条件下切取C57BL/6小鼠脾脏,用HBSS液清洗,去除结缔组织和脂肪组织,将脾脏置于100目细胞筛中,轻压脾脏使脾细胞分散,筛滤后落入装有RPMI-1640培养液的离心管中,用PBS洗2遍,离心后获得脾细胞悬液。采用CD4+T细胞分离试剂盒(美天旎公司),磁珠分选获得CD4+T细胞,纯度>95%。从获得的CD4+T细胞中,采用磁珠分选法(美天旎公司)分选获得 Naïve CD4+T 细胞(CD4+CD62L+CD25-)。
1.5 骨髓来源的DC细胞分离与培养
无菌条件下分离C57BL/6小鼠腿骨,剪断获取股骨和胫骨,浸泡于4℃RPMI-1640培养液中,去除肌肉组织,用注射器吸取RPMI-1640培养液将骨髓冲出,离心后用含有粒细胞-巨噬细胞集落刺激因子(GM-CSF,150ng/mL)和IL-4(800U/mL)的RPMI-1640培养液培养细胞,3d后,半量更换培养液,第7天收获DC细胞。
1.6 混合细胞培养
1.6.1 Sertoli细胞与同种异体T细胞混合培养 将Sertoli细胞(4×103个/孔)接种于96孔培养板中,高糖DMEM-F12培养过夜,再加入新分选出的Naïve CD4+T细胞(2×104个/孔)共同培养(培养液中含1.5μg/mL ConA,Sigma公司)。收集培养上清。
1.6.2 DC细胞与同种异体T细胞混合培养 将DC细胞(4×103个/孔)接种于96孔培养板中,RPMI-1640培养过夜,再与新分选出的 Naïve CD4+T细胞(2×104个/孔)混合[2],分别采用高糖 DMEMF12培养液或Sertoli细胞/T细胞混合培养4d的上清液,共同培养DC细胞/T细胞4d。
1.7 Western blot检测
移去Sertoli细胞培养液,用RIPA缓冲液(Santa Cruz公司)裂解培养板底部贴壁的Sertoli细胞,提取总蛋白。蛋白浓度用二喹啉甲酸(BCA)法测定。20μg蛋白加样,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜后用5%脱脂奶粉-TBST缓冲液封闭。再用抗小鼠人类主要组织相容性复合体(MHC)-Ⅱ、抗小鼠B7-H1、抗小鼠β-肌动蛋白(β-actin)等抗体(Santa Cruz公司),4℃孵育过夜,洗3遍后用辣根过氧化物酶标记的二抗室温孵育1h,洗3遍后以增强型化学发光试剂(ECL)法检测蛋白表达相对量。
1.8 分泌细胞因子检测
Sertoli细胞培养上清内的转化生长因子(TGF)-β1、白细胞介素(IL)-17A 等细胞因子采用eBioscience公司的酶联免疫吸附试验(ELISA)试剂盒检测,检测方法参照说明书。
1.9 流式细胞术检测
收集悬浮的T细胞,用含1%BSA的冷PBS液洗3遍后,采用荧光标记的抗CD25、Foxp3、IL-17A等抗体(BD公司)4℃孵育30min,洗2遍后行流式细胞分析术检测。数据应用FlowJo软件分析。
1.10 统计学分析
应用SPSS 12.0统计软件分析,组间数据比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠Sertoli细胞的形态学观察
Sertoli细胞在爬片中形成单层贴壁分布,光学显微镜下苏木精-伊红(HE)染色可见,胞体呈不规则的长多边形,胞体上多有3个或3个以上的突起,细胞核不规则,较大,双核细胞较常见,核染色质染色浅,核内清晰可见深染的核仁,高倍镜下可见胞质中含有多个脂质小体空泡(图1)。透射电镜下观察Sertoli细胞,可见其胞质中含有大量线粒体、高尔基复合体、内质网和脂质小体,细胞核形状不规则,核大而淡染,核膜有多个皱褶或小凹,核仁大而明显,其两侧各有1个卫星核小体,与核仁共同组成直线或三角形排列的核仁三联复合体,此为Sertoli细胞的典型结构(图2)。
2.2 Sertoli细胞中B7-H1、MHC-Ⅱ的表达
Western blot结 果 显 示,与同种 异 体 Naïve CD4+T细胞共培养后,Sertoli细胞高表达B7-H1分子和MHC-Ⅱ类分子(图3)。
2.3 Sertoli与同种异体Naïve CD4+T细胞体外混合培养促进TGF-β1 的分泌
小鼠Sertoli细胞体外培养72h,培养上清中的细胞因子浓度用酶联免疫吸附实验(ELISA)法检测,结果显示单独Sertoli细胞体外培养即能够分泌TGF-β1,浓度随培养时长而增加,TGF-β1浓度从2 h的(77.31±21.99)pg/mL逐渐增加至72h的(174.89±23.51)pg/mL。与同种异体Naïve CD4+T细胞混合培养,上清液中的TGF-β1浓度显著提高,72h达到(823.10±59.07)pg/mL,较单纯Sertoli培养组显著升高(P<0.01,图4)。
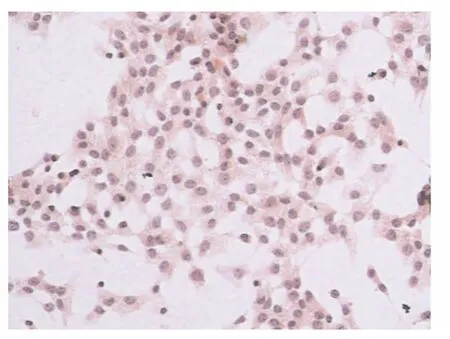
图1 小鼠Sertoli细胞苏木精-伊红染色(×200)Fig.1 Hematoxylin eosin staining of mouse Sertoli cells(×200)
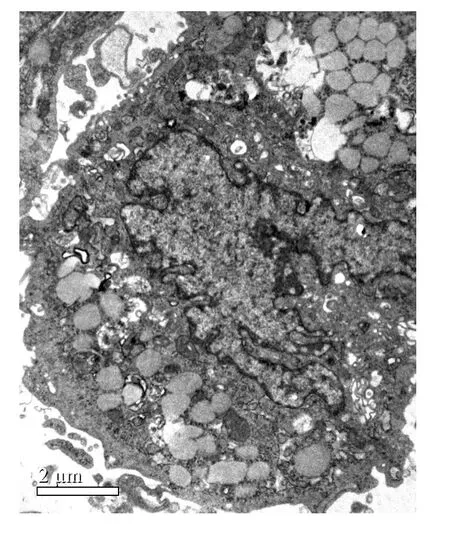
图2 小鼠Sertoli细胞透射电镜成像Fig.2 Image of mouse Sertoli cells under transmission electron microscope
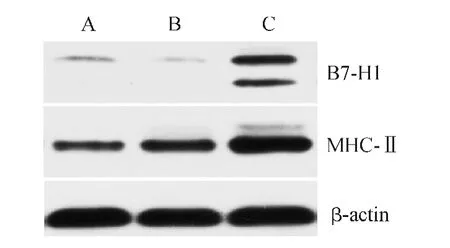
图3 Western blot法检测各组细胞中B7-H1、MHC-Ⅱ分子的表达Fig.3 Expression of B7-H1,MHC-Ⅱcells in each cells by Western blot
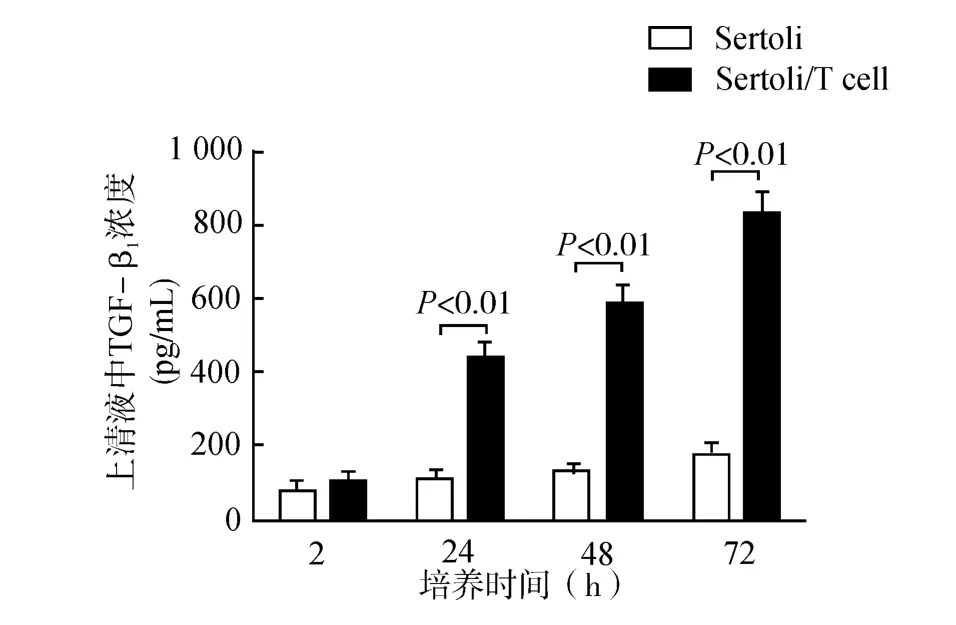
图4 ELISA法检测Sertoli细胞培养上清中的TGF-β1浓度Fig.4 Concentration of TGF-β1in Sertoli cell culture supernatant determined by ELISA
2.4 Sertoli细胞体外诱导Naïve CD4+ T细胞分化为CD25+Foxp3+Treg细胞
CD25和Foxp3是目前公认的特异性Treg标记,前者表达于细胞表面,后者位于细胞内。流式细胞术检测结果显示,与同种异体Sertoli细胞共同培养的体系内,Naïve CD4+T 细胞(CD4+CD62L+CD25-)被诱导分化为CD25+Foxp3+Treg细胞的比例显著增加,从<1%增长至27.6%(图5)。

图5 Sertoli细胞体外诱导Naïve CD4+T细胞分化为CD25+Foxp3+Treg细胞Fig.5 Sertoli cells induced Naïve CD4+ T cells to differentiate into CD25+Foxp3+Treg cells in vitro detected by FACS
2.5 Sertoli/Treg细胞混合培养上清液抑制DC细胞诱导Naïve CD4+ T细胞分化为Th17
本研究中,已证实Sertoli细胞可诱导同种异体Naïve CD4+T细胞分化为CD25+Foxp3+Treg细胞,混 合 培 养 的 上 清 液 中 (Sertoli/Treg supernatant,STS)含有高浓度的 TGF-β1,用此上清液孵育DC细胞/Naïve CD4+T细胞,可明显减少培养液中IL-17A的浓度,使其从(361.58±80.27)pg/mL降低至(137.54±52.19)pg/mL(P<0.05,图6);同时IL-17A+T细胞亚群百分比也显著降低(27.2%降至17.9%,图7)。

图6 ELISA法检测DC细胞/Naïve CD4+T细胞培养上清液中的IL-17A水平Fig.6 Concentration of IL-17Ain Sertoli cells culture supernatant detected by ELISA

图7 STS抑制DC细胞诱导Naïve CD4+T细胞分化为IL-17A+T细胞Fig.7 STS inhibited the differentiation of naïve CD4+T cells into IL-17A+ T cells induced by DC
3 讨论
血睾屏障(BTB)是睾丸中血管和曲精细管之间的屏障。这一屏障是由曲精细管的支持细胞——Sertoli细胞之间的紧密连接形成[3]。它为精原细胞提供营养,并防止细胞毒性物质进入曲精细管干扰精子发生和损害已形成的精子。有研究证实,Sertoli细胞形成的睾丸免疫特惠区,能够为同种异体或异种的组织(如皮肤皮片、胰腺或甲状旁腺等)提供免疫保护作用,使移植到睾丸间质的外源组织的存活时间明显延长[4]。将同种异体或异种胰岛移植入睾丸间质内,与肾脏和肝脏等移植部位相比,胰岛移植物的存活率显著增加,而且在小鼠及恒河猴糖尿病动物模型中,受体的血糖水平均得到了显著改善[4-5]。目前认为,血睾屏障的主要形成细胞——Sertoli细胞形成的微环境能够为自身生殖细胞提供免疫保护作用,它能够阻止抗体和免疫细胞通过血睾屏障进入睾丸内。Sertoli细胞产生的抗炎细胞因子和免疫抑制细胞因子能够调控免疫反应[6-7]。将Sertoli细胞移植到机体的其他部位,能够有效存活并保护共移植的异体和异种细胞[8],这说明Sertoli细胞能够在异位创造免疫特惠的微环境,这种保护作用不是来自于解剖学上的细胞间紧密连接,而是通过Sertoli细胞在局部表达或分泌免疫调节细胞因子而发挥免疫调节作用[9-10]。
辅助性T细胞17(Th17)和调节性T细胞(Treg)是近年来发现的不同于辅助性T细胞1(Th1)和辅助性T细胞2(Th2)的两类CD4+T细胞亚群[11]。Th17可介导慢性炎性反应,肾[12]、肺[13]、肝[14]等多种实体器官移植患者体内均可检测到高水平的白细胞介素(IL)-17,其作为Th17细胞分泌的一种细胞因子,在急、慢性排斥反应中扮演了重要的角色[15]。而CD4+Foxp3+Treg被认为是参与移植免疫耐受的最主要的T细胞亚型,它不但能够抑制Th1、Th2细胞的免疫功能[16],对Th17介导的炎性反应和排斥反应也具有调节作用[17]。移植物排斥或耐受的发生和进展是体内Th17/Treg平衡相互作用和制约的结果,幼稚T细胞在不同的细胞因子微环境内能够分别分化为Th17或Treg亚群,前者引发效应性T细胞反应,促进移植物排斥,后者则诱导移植物耐受[18]。已有报道,供者特异性Treg可通过B7-H1途径诱导产生[19],因此我们研究了Sertoli细胞是否能够在体外诱导CD4+CD25+Foxp3+Treg的产生。
TGF-β1是诱导供者特异性CD4+T细胞分化为Foxp3+Treg的关键细胞因子[20],在 TGF-β1环境中,T细胞表达Treg的转录因子叉状头/翅膀状螺旋转录因子(Foxp3),后者结合到Th17相关转录因子孤儿核受体(RORC/RORA)上,抑制细胞向Th17亚型分化[21]。Sertoli细胞在炎症环境下高表达 TGF-β、IL-6等基因[22]。其产生的FasL、吲哚胺2,3-双加氧酶(IDO)以及 TGF-β对延长移植物存活时间具有重要作用[23]。DC细胞能够在体外诱导CD4+CD25-Naïve T细胞分化为 Th17样细胞(可分泌IL-17A)[24]。TGF-β1是 维 持 T 细 胞 Treg/Th17分化平衡的关键细胞因子,在以TGF-β1为主导的细胞因子环境中,由APC细胞激活的CD4+T细胞向Foxp+Treg表型分化,而IL-6、IL-21等细胞因子则促进Th17细胞分化,诱导炎症及排斥反应发生[25-26]。
我们在本研究中观察了Sertoli细胞对同种异体免疫反应过程中Th17/Treg平衡的影响。成功在体外培养并分化了Sertoli细胞、T淋巴细胞及骨髓来源的DC细胞,并分别将Sertoli、DC细胞与同种异体T细胞混合培养,Western blot检测结果显示,Sertoli细胞与 同 种 异 体 Naïve CD4+T 细 胞(CD4+CD62L+CD25-)在体外混合培养时,其表面的MHC-Ⅱ类分子和B7-H1分子的表达量增加;ELISA结果显示,Sertoli细胞体外培养会分泌TGF-β1,且浓度随培养时间的延长而增加。与同种异体Naïve CD4+T细胞混合培养72h后,培养上清液中的TGF-β1浓度显著升高,差异有统计学意义。流式细胞术检测结果显示,与同种异体Sertoli细胞共同培养的体系内,Naïve CD4+T细胞(CD4+CD62L+CD25-)被诱导分化为 CD25+Foxp3+Treg细胞的比例显著增加,差异有统计学意义,这表明Sertoli细胞体外诱导Naïve CD4+T细胞分化为CD25+Foxp3+Treg细胞。Sertoli细胞可诱导同种 异 体 Naïve CD4+T 细 胞 分 化 为 CD25+Foxp3+Treg细胞,混合培养的上清液中含有高浓度的TGF-β1,本研究用此上清液孵育DC细胞/Naïve CD4+T细胞,可明显减少培养液中IL-17A的浓度,同时IL-17A+T细胞亚群百分比也显著降低,差异均有统计学意义,我们推测Sertoli细胞与Treg细胞混合培养的上清液可抑制DC细胞诱导Naïve CD4+T细胞分化为Th17。
本研究结果表明,Sertoli细胞体外培养产生的抗炎细胞因子和免疫抑制细胞因子能够调控免疫反应,并 诱 导 Naïve CD4+T 细 胞 分 化 为 CD25+Foxp3+Treg细胞,Sertoli细胞可能通过调节同种异体Treg/Th17分化平衡,诱导免疫耐受,发挥免疫调节作用。
[1] Setchell B P.The functional significance of the blood-testis barrier[J].J Androl,1980,1(1):3-10.
[2] Ouabed A,Hubert F X,Chabannes D,et al.Differential control of T regulatory cell proliferation and suppressive activity by mature plasmacytoid versus conventional spleen dendritic cells[J].J Immunol,2008,180(9):5862-5870.
[3] Howards S S,Jessee S J,Johnson A L.Micropuncture studies of the bloodseminiferous tubule barrier[J].Biol Reprod,1976,14(3):264-269.
[4] Selawry H P.Islet Transplantation to immunoprivileged sites[M]//Lanza R P,Chick W L.Pancreatic islet transplantation,vol 2,immunomodulation of pancreatic islets.Austin,TX:Landes/CRC Press,1994:75-86.
[5] Dufour J M,Rajotte R V,Korbutt G S,et al.Harnessing the immunomodulatory properties of Sertoli cells to enable xenotransplantation in typeⅠ diabetes[J].Immunol Invest,2003,32(4):275-297.
[6] Fijak M,Meinhardt A.The testis in immune privilege[J].Immunol Rev,2006,213:66-81.
[7] Meinhardt A,Hedger M P.Immunological,paracrine and endocrine aspects of testicular immune privilege[J].Mol Cell Endocrinol,2011,335(1):60-68.
[8] Mital P,Kaur G,Dufour J M.Immunoprotective sertoli cells:making allogeneic and xenogeneic transplantation feasible[J].Reproduction,2010,139(3):495-504.
[9] Dufour J M,Lord S J,Kin T,et al.Comparison of successful and unsuccessful islet/Sertoli cell co-transplant grafts in streptozotocin induced diabetic mice[J].Cell Transplant,2008,16(10):1029-1038.
[10] Dufour J M,Dass B,Halley K,et al.Sertoli cell line lacks the immunoprotective properties associated with primary Sertoli cells[J].Cell Transplant,2008,17(5):525-534.
[11] 万勇,张念,李剑平,等.调节性T细胞与Th17细胞的失衡及其对大鼠肺纤维化的影响[J].华中科技大学学报:医学版,2013,42(2):161-166.
[12] Van Kooten C,Boonstra J G,Paape M E,et al.Interleukin-17 activates human renal epithelial cells in vitroand is expressed during renal allograft rejection[J].J Am Soc Nephrol,1998,9(8):1526-1534.
[13] Snell G I,Levvey B J,Zheng L,et al.Interleukin-17and airway inflammation:a longitudinal airway biopsy study after lung transplantation[J].J Heart Lung Transplant,2007,26(7):669-674.
[14] Fabrega E,Lopez-Hoyos M,San Segundo D,et al.Changes in the serum levels of interleukin-17/interleukin-23during acute rejection in liver transplantation[J].Liver Transpl,2009,15(6):629-633.
[15] Liu Z,Fan H,Jiang S.CD4(+)T-cell subsets in transplantation[J].Immunol Rev,2013,252(1):183-191.
[16] Wood K J,Bushell A,Hester J.Regulatory immune cells in transplantation[J].Nat Rev Immunol,2012,12(6):417-430.
[17] Littman D R,Rudensky A Y.Th17and regulatory T cells in mediating and restraining inflammation[J].Cell,2010,140(6):845-858.
[18] Hanidziar D,Koulmanda M.Inflammation and the balance of Treg and Th17cells in transplant rejection and tolerance[J].Curr Opin Organ Transplant,2010,15(4):411-415.
[19] Krupnick A S,Gelman A E,Barchet W,et al.Murine vascular endothelium activates and induces the generation of allogeneic CD4+25+Foxp3+regulatory T cells[J].J Immunol,2005,175(10):6265-6270.
[20] Bettelli E,Carrier Y,Gao W,et al.Reciprocal developmental pathways for the generation of pathogenic effector TH17and regulatory T cells[J].Nature,2006,441(7090):235-238.
[21] Weaver C T,Hatton R D.Interplay between the TH17and TReg cell lineages:a(co-)evolutionary perspective[J].Nat Rev Immunol,2009,9(12):883-889.
[22] Li R,Xi Y,Liu X,et al.Expression of IL-1alpha,IL-6,TGF-beta,FasL and ZNF265during sertoli cell infection by ureaplasma urealyticum[J].Cell Mol Immunol,2009,6(3):215-221.
[23] Fallarino F,Luca G,Calvitti M,et al.Therapy of experimental type 1diabetes by isolated Sertoli cell xenografts alone[J].J Exp Med,2009,206(11):2511-2526.
[24] Gautreau L,Chabannes D,Heslan M,et al.Modulation of regulatory T cell-Th17balance by plasmacytoid dendritic cells[J].J Leukoc Biol,2011,90(3):521-527.
[25] Korn T,Bettelli E,Gao W,et al.IL-21initiates an alternative pathway to induce proinflammatory T(H)17cells[J].Nature,2007,448(7152):484-487.
[26] 丁然,王庆,蔡贤华.转化生长因子-β不同亚型对前软骨干细胞增殖分化的影响[J].华中科技大学学报:医学版,2013,42(6):659-664.
