COX-2选择性抑制剂塞来昔布联合PPAR-γ配体罗格列酮治疗子宫内膜癌的实验研究*
2014-01-01冯振中武世伍蔡兆根吕秀红陈嘉薇
冯振中, 武世伍, 李 楠, 蔡兆根, 吕秀红, 陈嘉薇
1蚌埠医学院第一附属医院病理科,蚌埠医学院病理学教研室,安徽省感染与免疫重点实验室,蚌埠 233004
2上海交通大学附属上海市第一人民医院病理科,上海 200080
环氧化酶-2(cyclooxygenase-2,COX-2)是催化花生四烯酸转化为前列腺素物质过程中的限速酶,在胃癌、肝细胞癌、非小细胞性肺癌、乳腺癌、子宫颈癌等多种恶性肿瘤中异常增高[1-4],其过度表达与肿瘤细胞生长增殖、新生血管形成、侵袭转移等恶性生物学行为密切相关[5]。COX-2是一种重要的原癌基因,COX-2抑制剂能够成为肿瘤治疗的有效药物。过氧化物酶体增殖物激活受体-γ(peroxisome proliferator-activated receptor-γ,PPAR-γ )是核激素受体超家族成员之一,属于配体依赖的核转录因子。近年来的研究发现,PPAR-γ具有多重生物学效应[6],参与了细胞增殖、凋亡和分化过程,与肿瘤的发生、发展关系密切,而PPAR-γ配体具有明显的抗肿瘤作用,已成为新的肿瘤治疗靶点[7-9]。
迄今为止,COX-2和PPAR-γ在子宫内膜癌中的表达与临床意义少见相关报道。本研究采用免疫组化方法,结合组织芯片技术,检测124例子宫内膜样腺癌和35例正常子宫内膜组织中COX-2、PPAR-γ的表达,分析其相关性;并以2种基因为共同靶点进行药物干预,使用COX-2选择性抑制剂塞来昔布和PPAR-γ合成配体罗格列酮,联合处理子宫内膜癌细胞,观察对肿瘤细胞增殖、侵袭和转移等行为的影响,以期为临床子宫内膜癌的预防和治疗提供新的理论和实验依据。
1 材料与方法
1.1 临床病例及资料
标本取自上海交通大学附属上海市第一人民医院病理科2005年1月至2009年9月手术切除的子宫内膜癌,所有标本均经4%多聚甲醛固定,常规石蜡包埋、连续切片、苏木精-伊红(HE)染色,经病理组织学明确诊断。共124例患者,年龄27~81岁,平均年龄57岁。根据2000年FIGO标准,临床病理分期为Ⅰ~Ⅱ期101例,Ⅲ~Ⅳ期23例。根据2003年WHO标准,病理分级为高分化57例,中分化41例,低分化26例。肌层浸润>50%者40例,≤50%者84例。有淋巴结转移者31例,无转移者93例。所有患者术前均未接受放疗、化疗,具有完整临床资料,所有肿瘤标本均为子宫内膜样腺癌。正常子宫内膜35例(增生期16例,分泌期19例),分别取自妇科活检和子宫平滑肌瘤等良性病变的内膜组织。
1.2 实验试剂
兔抗人多克隆COX-2抗体(Abcam公司,工作浓度1∶200),兔抗人单克隆PPAR-γ抗体(Cell Signaling公司,工作浓度1∶120),Ultra-Sensitive试剂盒和DAB显色液(福州迈新公司)。塞来昔布(Celecoxib)购自Sigma公司,罗格列酮(Rosiglitazone)购自Cayman公司,CCK-8试剂盒购自碧云天生物公司,Transwell小室购自Corning公司,细胞培养液及胎牛血清均购自Gibco公司。
1.3 构建组织芯片
选择所需病例存档蜡块,根据HE切片仔细进行形态学观察,确定具有代表性的病变部位并标记,由上海芯超生物有限公司技术支持。
1.4 免疫组化染色及结果判定
采用SP两步免疫组化染色法,实验步骤严格按照说明书进行。PBS代替一抗为阴性对照,已知阳性切片为阳性对照。由2位经验丰富的病理科医生采用双盲法观察切片。PPAR-γ蛋白主要定位于细胞核,部分伴有胞质着色,COX-2蛋白定位于细胞质,以子宫内膜腺上皮细胞内出现定位明确、染色明显的样本为阳性,根据相关文献[10-11],采用半定量积分法判断结果,根据染色范围和染色强度评分。将阳性细胞数<6%,6%~,26%~,51%~,>75%分别计为0、1、2、3、4分。细胞无显色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。依两评分的乘积对染色结果进行评判:<2分为阴性(-),2~4分为弱阳性(+),5~8分为阳性(⧺),9~12分为强阳性(⧻),若2位专家评定结果相差3分则重新判定。
1.5 肿瘤细胞株及常规细胞培养
人子宫内膜癌细胞株RL95-2具有较高含量COX-2和基础量的PPAR-γ[12],符合本课题实验需要。该细胞株由上海交通大学附属上海市第一人民医院妇产科研究所保存、惠赠。细胞培养在含10%胎牛血清、100U/mL青霉素和100μg/mL链霉素的DMEM高糖培养液内,置于37℃、5%CO2饱和湿度培养箱中,至70%~80%融合时,吸去培养液,PBS漂洗,加入胰蛋白酶常温下消化3min,显微镜下观察细胞分散脱落,加入培养液终止消化,按1∶3传代培养,常规取第4代肿瘤细胞用于实验。
1.6 细胞学实验分组
无菌条件超净工作台环境下,取适量塞来昔布和罗格列酮,用DMSO使其溶解,配制成10.0 mmol/L的储备液。再次紫外线无菌处理,分装,-20℃保存备用。临用前配制成实验所需浓度,所有实验中DMSO终浓度<0.1%。
首先,分别使用不同浓度的塞来昔布(0、10、20、30、40、50μmol/L)和罗格列酮(0、5、10、20、30、40 μmol/L)处理RL95-2肿瘤细胞,筛选2种药物对于肿瘤细胞的合适作用浓度和时间点,为联合应用塞来昔布和罗格列酮寻找适宜实验条件。根据预实验结果,选择塞来昔布30μmol/L和罗格列酮20 μmol/L作为进一步联合应用时的药物浓度。依下列分组处理细胞:空白对照组、塞来昔布(30μmol/L)组、罗格列酮(20μmol/L)组、联合用药组。
1.7 CCK-8检测
取对数生长期肿瘤细胞,调整细胞密度为5×104/mL,加于96孔培养板,每孔100mL,设5个复孔,孵育12h后,各组更换含单独和联合药物的培养液,继续培养。分别于培养24、48、72h时取1块细胞培养板,小心吸去原培养液,PBS冲洗2遍,每孔分别加入200μL新鲜培养液及15μL CCK-8试剂,继续孵育1.5 h,酶标仪测定在450nm处的吸光度(A)值,按公式:细胞抑制率(%)=(1-实验孔A值/对照孔A值)×100%,计算出RL95-2肿瘤细胞的增殖抑制率,得出剂量反应曲线。以上实验重复3次。
1.8 平板克隆形成实验
取状态良好的对数生长期RL95-2肿瘤细胞,细胞计数仪计数,稀释至细胞密度为1 000个/mL。取500μL的单细胞悬液加入35mm直径细胞培养皿中,孵育12h。按照分组加入相应药物,处理48 h。撤除含有药物的培养液,加入常规细胞培养液,7d后开始持续观察形成的细胞集落情况,持续至12d,弃去培养液,PBS洗2遍,冰冷的甲醇-20℃固定30min,吉姆萨染液染色10min,洗去染液,常温晾干。计数标准:细胞集落直径大于1mm记为阳性。数码相机拍照。以上实验重复3次。
1.9 细胞侵袭实验
将Matrigel Matrix原液置于冰上,于4℃冰箱保存过夜,使其融化,用预冷的枪头混匀,和无血清培养液DMEM按1∶3稀释,每孔加50μL,放于细胞培养箱中风干过夜。实验时每孔加入适量无血清DMEM培养液,以水化基质胶,放置60min,取生长状态良好的对数生长期RL95-2肿瘤细胞,调整细胞数至2×105/mL,取细胞悬液200μL(细胞数4×104)加入Transwell上层小室,分别加入各组药物处理48h,下层小室加入500μL含20%胎牛血清的培养液。取出小室,4%甲醛固定20min,苏木精染色10min,PBS漂洗1min。在倒置显微镜下计数细胞并拍照,每个样本计数5个高倍视野,取其均值。以上实验重复3次。
1.10 细胞迁移实验
基本步骤同上述侵袭实验,但省略Transwell小室Matrigel基质胶的制备,即不需要在小室中加入Matrigel胶和水化。细胞悬液200μL(细胞数4×104)加入上层小室,各组药物干预48h。以上实验重复3次。
1.11 Western blot实验
取生长状态良好的对数生长期细胞,加入各组药物处理48h,收集细胞备用。根据抗体说明书和预实验情况,一抗孵育浓度分别为兔抗人β-actin多克隆抗体1∶2 000,兔抗人COX-2多克隆抗体1∶1 000,兔抗人PPAR-γ单克隆抗体1∶3 000,其他实验步骤同参考文献[13]。以上实验重复3次。
1.12 统计学分析
采用SPSS 13.0统计软件。计数资料率的比较采用卡方检验或Fisher精确概率法检验,相关关系采用Spearman等级相关分析,计量资料以±s表示,单因素方差分析(one-way ANOVA)比较各实验组均数间的差异,以P<0.05为差异有统计学意义。
2 结果
2.1 COX-2和PPAR-γ蛋白在子宫内膜组织中的表达及其相关性
COX-2蛋白在子宫内膜样腺癌中的表达率为66.9%(83/124),明显高于正常内膜组织的5.7%(2/35,P<0.01)。PPAR-γ蛋白的表达呈相反趋势,在子宫内膜样腺癌和正常子宫内膜组织中的阳性率分别为:39.5%(49/124)、62.9%(22/35)(P<0.05)。见图1。
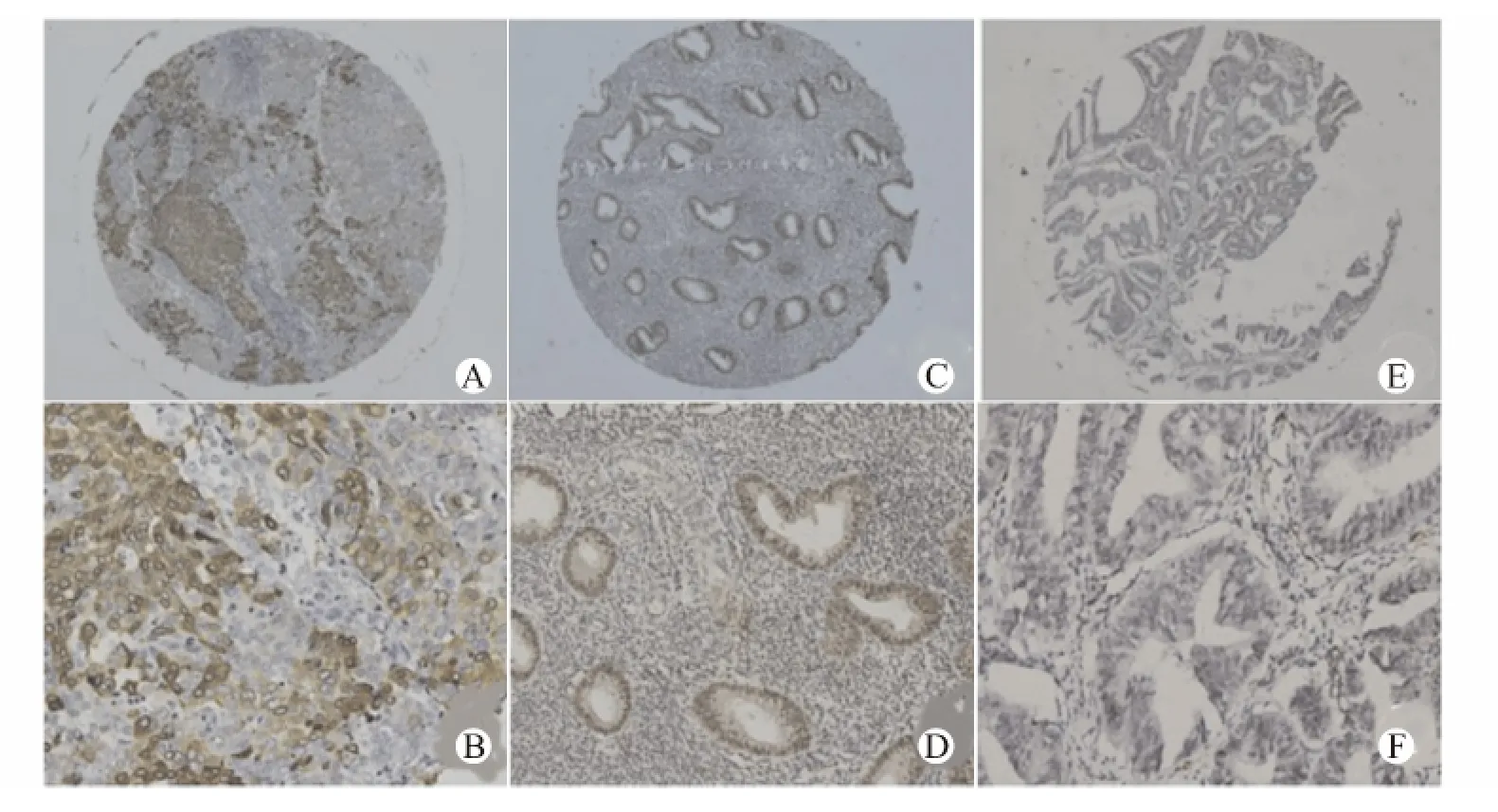
图1 COX-2、PPAR-γ在子宫内膜组织中的表达(SP法;A、C、E×40,B、D、F×200)Fig.1 Expression of COX-2and PPAR-γin different endometrial tissues(SP method;A,C,E ×40;B,D,F ×200)
41例COX-2阴性的肿瘤组织中,有21例(51.2%,21/41)PPAR-γ阳性表达,而83例 COX-2阳性标本,仅有28例(34.6%,28/83)PPAR-γ阳性表达,Spearman相关分析发现两者呈负相关(rs=-0.192,P<0.05)。
2.2 COX-2和PPAR-γ表达与子宫内膜样腺癌临床病理因素的关系
子宫内膜样腺癌中COX-2的表达在低分化肿瘤细胞、肿瘤临床晚期、淋巴结转移患者中明显升高(P<0.05)。PPAR-γ蛋白与病理分级负性相关(P<0.05)。见表1。
2.3 塞来昔布和罗格列酮联合应用抑制RL95-2肿瘤细胞的增殖
CCK-8比色实验结果表明:塞来昔布30μmol/L和罗格列酮20μmol/L处理RL95-2子宫内膜癌细胞后,能够明显抑制肿瘤细胞的增殖(P<0.05),与药物单独干预比较,联合应用产生的抑制效应更加显著(P<0.01)(图2)。
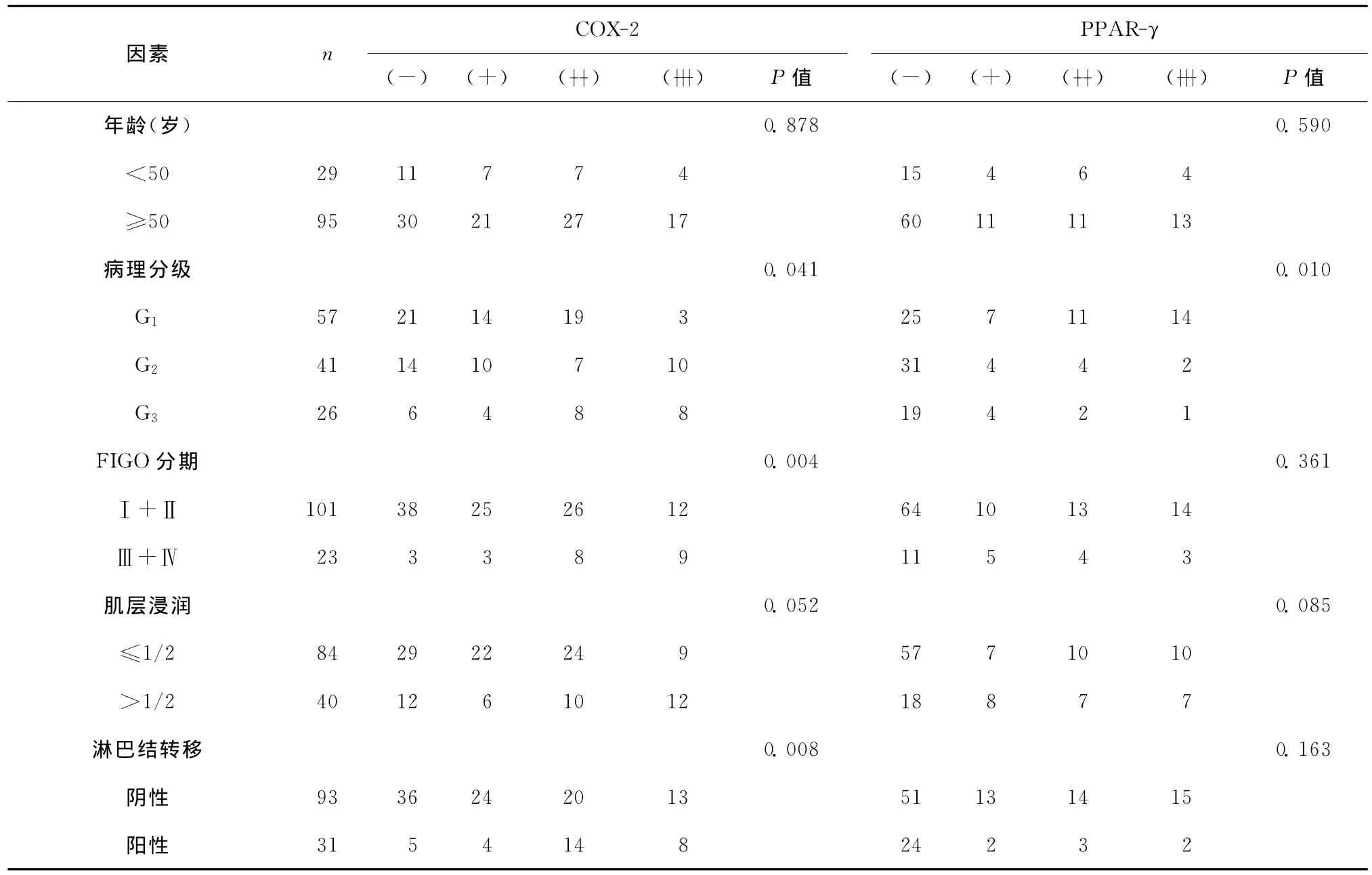
表1 COX-2和PPAR-γ蛋白表达与子宫内膜样腺癌临床病理因素的关系Table 1 Association of COX-2and PPAR-γprotein expression with clinicopathological parameters in endometrial carcinoma
2.4 塞来昔布和罗格列酮联合应用抑制RL95-2肿瘤细胞克隆团形成

图2 塞来昔布和罗格列酮联合应用抑制RL95-2子宫内膜癌细胞增殖的作用Fig.2 Effects of Celecoxib combined with Rosiglitazone on proliferation of RL95-2endometrial carcinoma
细胞集落形成实验是反映细胞增殖和独立生长能力的良好指标,本实验采用平板克隆形成实验,观察塞来昔布和罗格列酮联合应用对于RL95-2细胞的影响。结果显示,对照组肿瘤细胞形成的克隆团数目为135.33,30μmol/L塞来昔布和20μmol/L罗格列酮分别及联合干预48h后,阳性克隆团数目分别为52.67、62.00、21.33,与对照组比较,用药组能够抑制RL95-2细胞克隆团形成(P<0.05),与单独干预比较,联合应用产生的抑制效应更加显著(P<0.01)(图3)。
2.5 塞来昔布和罗格列酮联合应用抑制RL95-2肿瘤细胞的侵袭能力
塞来昔布和罗格列酮处理RL95-2肿瘤细胞48 h,与对照组比较,肿瘤细胞穿越Matrigel基底膜的数量明显减少(P<0.05),与单独药物比较,联合处理后侵袭细胞的数量更少(P<0.01)(图4)。
2.6 塞来昔布和罗格列酮联合应用抑制RL95-2肿瘤细胞的迁移能力
塞来昔布和罗格列酮处理RL95-2肿瘤细胞48 h,与对照组比较,肿瘤细胞穿越滤膜的数量均明显减少(均P<0.05),与单独药物比较,联合处理后迁移细胞的数量更少(图5)。

图3 塞来昔布和罗格列酮联合应用抑制RL95-2细胞克隆团的形成Fig.3 Inhibitory effect of Celecoxib combined with Rosiglitazone on colony formation of RL95-2cells

图4 塞来昔布和罗格列酮抑制RL95-2细胞侵袭能力Fig.4 Inhibitory effects of Celecoxib and Rosiglitazone on the invasion ability of RL95-2cells

图5 塞来昔布和罗格列酮抑制RL95-2细胞迁移能力Fig.5 Inhibitory effects of Celecoxib and Rosiglitazone on the migration ability of RL95-2cells
2.7 塞来昔布和罗格列酮联合应用对COX-2、PPAR-γ蛋白表达的影响
塞来昔布和罗格列酮作用于RL95-2子宫内膜癌细胞48h后,Western blot检测显示,COX-2蛋白条带减弱,与内参组β-actin吸光度值之比,对照组、塞来昔布组、罗格列酮组、联合药物组分别为0.757、0.395、0.421、0.226;PPAR-γ的条带表达增粗,与内参组β-actin吸光度值之比,各组分别为0.683、0.959、1.132、1.461。吸光度扫描半定量测定发现,用药组能够下调COX-2蛋白表达,上调PPAR-γ的表达(均P<0.05),与单独干预比较,联合应用产生的调节效应更加显著(P<0.05,图6)。
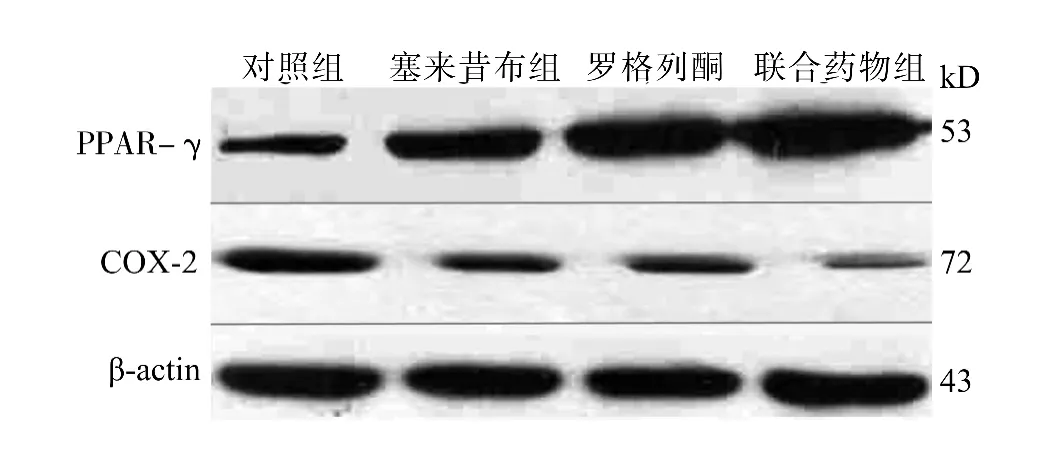
图6 塞来昔布和罗格列酮对RL95-2细胞COX-2和PPAR-γ蛋白表达的影响Fig.6 Expression of COX-2and PPAR-γin RL95-2cells treated with Celecoxib and Rosiglitazone
3 讨论
子宫内膜癌是最常见的女性生殖系统恶性肿瘤之一,约占女性癌症总数的7%,占女性生殖道恶性肿瘤的30%,严重威胁女性健康[14]。近年来,子宫内膜癌的发病率和致死率呈逐渐上升趋势,而且年轻患者的比例逐渐升高,40岁以下的育龄期子宫内膜癌患者约占8%~14%,其中多数为未生育者[15]。对子宫内膜癌进行保守治疗引起了广泛的关注,目前传统的保守疗法是孕激素治疗,但是约25%左右的患者不敏感,长期服用也会出现激素耐药性和较高的复发率,并容易产生各种副反应[16-17]。探索新的药物作用靶点和疗效明显、副反应较小的有效药物,将对子宫内膜癌的预防和临床治疗产生积极作用,已成为妇科肿瘤研究领域的新热点。
迄今为止,关于COX-2和PPAR-γ在肿瘤中相互关系的研究报道较少,调控机制尚不十分明确。Badawi等[18]收集乳腺正常组织和良性病变、原位癌、浸润癌和淋巴结转移标本,定量PCR检测发现COX-2mRNA水平随着乳腺恶性转变过程而逐渐递增,PPAR-γmRNA的表达则逐渐递减,两者呈负性相关。本研究发现,COX-2的表达从正常内膜组织到子宫内膜癌的演变过程中不断递增,在低分化肿瘤细胞、临床晚期、淋巴结转移患者中,阳性表达率明显增加,而PPAR-γ蛋白的表达在子宫内膜癌变过程中逐渐减少,在高分化肿瘤细胞中阳性表达明显,与COX-2的表达呈相反趋势,二者在子宫内膜样腺癌中呈负相关(rs=-0.192,P<0.05)。结果提示,COX-2蛋白表达明显升高,PPAR-γ蛋白表达相对降低,两者可能共同参与了子宫内膜癌的发生、发展过程。
由于COX-2本身并不具有信号传导激酶的作用,其在肿瘤细胞中的信号传导途径是通过催化下游的各种前列腺素产物,结合相应的受体来完成调节功能。PPAR-γ具有结合内源性前列腺素特性,所以PPAR-γ可能是COX-2基因重要的下游调控靶点,而PPAR-γ也可通过反馈机制影响COX-2的表达,其配体可以抑制前列腺素的合成和功能,发挥抑制肿瘤作用,说明COX-2和PPAR-γ之间存在复杂的网络调控机制[19]。Wick等[20]报道非甾体类抗炎药(NSAIDs)舒林酸能够有效抑制肺非小细胞肺癌的增殖和荷瘤小鼠的肿瘤生长,荧光素酶报告基因检测发现舒林酸和环格列酮(一种PPAR-γ配体)都可以明显促进PPAR-γ反应元件的表达,而对于不表达COX-2的肺非小细胞肺癌,舒林酸和环格列酮也可以抑制肿瘤细胞的增殖,说明NSAIDS存在着不依赖COX-2的肿瘤抑制途径,而PPAR-γ可能是NSAIDS的直接效应靶点,在抑瘤过程中发挥作用。本实验结果发现,塞来昔布和罗格列酮分别处理RL95-2肿瘤细胞48h后,两者均上调了PPAR-γ的表达 (P<0.05),同时COX-2蛋白表达明显降低(P<0.05),提示塞来昔布和罗格列酮的直接作用靶点包括COX-2和PPAR-γ两种基因。
目前,联合应用COX-2抑制剂和PPAR-γ配体对肿瘤进行干预的研究报道少见。Sun等[21]使用COX-2选择性抑制剂NS-398和罗格列酮共同处理人胰腺癌细胞株SW1990,发现2种药物明显降低肿瘤细胞的生长速度和增殖能力,用药联合指数在12、24、48h分别为0.89、0.74、0.70,提示 NS-398和罗格列酮的共同使用产生了协同抑瘤作用。本研究通过CCK-8比色实验和细胞集落形成实验发现,COX-2选择性抑制剂塞来昔布和PPAR-γ配体罗格列酮能够有效抑制RL95-2子宫内膜癌细胞的增殖能力,通过Transwell小室实验发现,2种药物可以降低肿瘤的侵袭、转移能力,联合应用时的抑瘤效果明显高于单独药物组,Western blot检测结果发现,两种药物可以明显降低COX-2蛋白的表达,增加PPAR-γ蛋白的表达。
结合以上研究可以合理推测,COX-2和PPAR-γ参与子宫内膜样腺癌的发生、发展过程,使用COX-2选择性抑制剂和PPAR-γ配体联合干预肿瘤,可能成为拮抗子宫内膜癌的重要手段和新的有效途径,为临床肿瘤的预防和治疗提供新的思路和理论依据。
[1] Gou H F,Chen X C,Zhu J,et al.Expressions of COX-2and VEGF-C in gastric cancer:correlations with lymphangiogenesis and prognostic implications[J].J Exp Clin Cancer Res,2011,30(1):14-21.
[2] He Y F,Jin J,Wei W,et al.Overexpression of cyclooxygenase-2in noncancerous liver tissue increases the postoperative recurrence of hepatocellular carcinoma in patients with hepatitis B virus-related cirrhosis[J].Can J Gastroenterol,2010,24(7):435-440.
[3] Zhang J,Luo J,Ni J,et al.MMP-7is upregulated by COX-2 and promotes proliferation and invasion of lung adenocarcinoma cells[J].Eur J Histochem,2014,58(1):2262-2262.
[4] Fukazawa E M,Baiocchi G,Soares F A,et al.COX-2,EGFR,and ERBB-2expression in cervical intraepithelial neoplasia and cervical cancer using an automated imaging system[J].Int J Gynecol Pathol,2014,33(3):225-234.
[5] Jana D,Sarkar D K,Ganguly S,et al.Role of Cyclooxygenase 2(COX-2)in prognosis of breast cancer[J].Indian J Surg Oncol,2014,5(1):59-65.
[6] Dicitore A,Caraglia M,Gaudenzi G,et al.Type I interferonmediated pathway interacts with peroxisome proliferator activated receptor-γ (PPAR-γ):at the cross-road of pancreatic cancer cell proliferation[J].Biochim Biophys Acta,2014,1845(1):42-52.
[7] Yokoyama Y,Mizunuma H.Peroxisome proliferator-activated receptor and epithelial ovarian cancer[J].Eur J Gynaecol Oncol,2010,31(6):612-615.
[8] Panza A,Votino C,Gentile A,et al.Peroxisome proliferatoractivated receptorγ-mediated induction of microRNA-145opposes tumor phenotype in colorectal cancer[J].Biochim Biophys Acta,2014,1843(6):1225-1236.
[9] Papi A,De Carolis S,Bertoni S,et al.PPARγand RXR ligands disrupt the inflammatory cross-talk in the hypoxic breast cancer stem cells niche[J].J Cell Physiol,2014,229(11):1595-1606.
[10] Marques A R,Espadinha C,Frias M J,et al.Underexpression of peroxisome proliferator-activated receptor(PPAR)gamma in PAX8/PPARgamma-negative thyroid tumours[J].Br J Cancer,2004,91(4):732-738.
[11] Ohno S,Ohno Y,Suzuki N,et al.Cyclooxygenase-2expression correlates with apoptosis and angiogenesis in endometrial cancer tissue[J].Anticancer Res,2007,27(6A):3765-3770.
[12] Ota K,Ito K,Suzuki T,et al.Peroxisome proliferator-activated receptor gamma and growth inhibition by its ligands in uterine endometrial carcinoma[J].Clin Cancer Res,2006,12(14Pt 1):4200-4208.
[13] Yu J,Hu S,Ma K,et al.Ribosomal protein S29regulates metabolic insecticide resistance through binding and degradation of CYP6N3[J].PLoS One,2014,9(4):e94611.
[14] Siegel R,Ma J,Zou Z,et al.Cancer statistics 2014[J].CA Cancer J Clin,2014,64(1):9-29.
[15] 王美清,张庆慧,郭玲玲,等.40岁以下妇女子宫内膜癌刮宫活检的病理诊断问题[J].中华病理学杂志,2005,34(5):262-265.
[16] Shim S H,Lee S J,Kim S N.Effects of hormone replacement therapy on the rate of recurrence in endometrial cancer survivors:A meta-analysis[J].Eur J Cancer,2014,50(9):1628-1637.
[17] 张萍,朱涛,王常玉,等.子宫内膜癌治疗的临床探讨[J].华中科技大学学报:医学版,2005,34(6):773-776.
[18] Badawi A F,Badr M Z.Expression of cyclooxygenase-2and peroxisome proliferator-activated receptor-gamma and levels of prostaglandin E2and 15-deoxy-delta12,14-prostaglandin J2 in human breast cancer and metastasis[J].Int J Cancer,2003,103(1):84-90.
[19] Yang L,Yuan J,Liu L,et al.α-linolenic acid inhibits human renal cell carcinoma cell proliferation through PPAR-γactivation and COX-2inhibition[J].Oncol Lett,2013,6(1):197-202.
[20] Wick M,Hurteau G,Dessev C,et al.Peroxisome proliferatoractivated receptor-gamma is a target of nonsteroidal anti-inflammatory drugs mediating cyclooxygenase-independent inhibition of lung cancer cell growth[J].Mol Pharmacol,2002,62(5):1207-1214.
[21] Sun W H,Chen G S,Ou X L,et al.Inhibition of COX-2and activation of peroxisome proliferator-activated receptor gamma synergistically inhibits proliferation and induces apoptosis of human pancreatic carcinoma cells[J].Cancer Lett,2009,275(2):247-255.
