布美他尼对大鼠脑微血管内皮细胞缺氧损伤后增殖的影响*
2014-01-01付佩彩喻志源李彩红唐荣华叶茂斌
付佩彩, 喻志源, 李彩红, 唐荣华, 叶茂斌, 王 伟
华中科技大学同济医学院附属同济医院神经内科,武汉 430030
神经血管单元(neurovascular unit,NVU)由神经元-胶质细胞-血管构成,三者之间相互联系,相互影响,共同参与脑缺血损伤后的再生修复[1]。其中脑微血管内皮细胞(brain microvascular endothelial cell,BMEC)是血脑屏障的主要组成成分,它能够限制可溶性物质和细胞等从血液进入大脑[2]。缺血性脑损伤后,微血管再生对神经元及神经胶质细胞功能以及组织恢复起到重要作用[3]。钠-钾-氯共转运体1(Na+-K+-2Cl-cotransporter,NKCC1)是新近发现的一类离子通道,其在维持细胞的离子平衡、细胞体积以及细胞凋亡方面具有重要作用[4]。目前研究发现,NKCC1主要表达在内皮细胞、神经胶质细胞和神经元中[5]。脑缺血后,NKCC1表达增加,产生组织毒性,但其对微血管再生以及细胞增殖的影响尚不清楚。
本研究采用NKCC1特异性抑制剂布美他尼(Bumetanide)对原代培养的大鼠BMEC进行干预,检测细胞活力及细胞周期的变化,探讨NKCC1通路对缺氧损伤后BMEC增殖的影响。
1 材料与方法
1.1 材料与试剂
SD大鼠乳鼠来自华中科技大学同济医学院实验动物学部。M199培养液、胎牛血清购自美国Hyclone公司;胰蛋白酶、无糖培养液购自美国Gibco公司;多聚赖氨酸、布美他尼和DAPI购自美国Sigma公司;兔抗VWF购自美国BD公司;兔抗NKCC1购自美国Millipore公司;Edu试剂盒购自上海锐博公司;FITC标记羊抗小鼠和CY3标记羊抗兔IgG购自美国Jackson公司。
1.2 大鼠BMEC原代培养及鉴定
12只出生1~3d的SD大鼠用75%乙醇浸泡消毒,取脑,放入预冷的D-Hanks液中清洗2次,小心剥离脑膜和血管,剪碎后用2mL研磨器研磨2、3次,过100目滤网,收集滤液。滤液过70μm一次性滤网,D-Hanks液多次冲洗,收集滤网上沉淀,沉淀多为微血管段,离心1 000r/min×10min,弃上清,加入0.1%的Ⅱ型胶原酶37℃振荡消化30min。离心1 000r/min×10min,沉淀用含15%FBS的M199培养液重悬,接种于3个T25培养瓶中。24 h后换液,之后每隔2~3d换液,待细胞长到85%以上重叠,消化传代后继续培养。VWF染色鉴定微血管内皮细胞。
1.3 实验分组
细胞分别接种于96孔板、放置多聚赖氨酸预包被玻片的24孔板和6孔板中,于37℃、5%CO2培养箱中进行培养。细胞长至70%左右融合后,分为对照组、氧糖剥夺/复氧(OGD/Reo)组及OGD/Reo+Bumetanide组。其中对照组在实验开始时换用新鲜培养液,OGD/Reo组换用无糖培养液,OGD/Reo+Bumetanide组换用含10μmol/L布美他尼的无糖培养液,后两组在1%O2、5%CO2、37℃条件下(OGD干预)培养4h。OGD干预后,各组换用相应的正常培养液,37℃、5%CO2条件下继续培养6、12、24h及48h后进行后续实验。
1.4 免疫荧光染色
24孔板细胞在复氧6、12、24h和48h时用4%多聚甲醛固定细胞,PBS清洗2次,每次5min,用含0.2%Triton-X100的PBS破膜,BSA封闭后,加入相应一抗(anti-VWF和anti-NKCC1)封闭过夜。PBS清洗,加入相应二抗(CY3标记羊抗兔IgG)室温孵育1h。DAPI染细胞核,50%甘油封片,荧光显微镜下观察。
1.5 MTT法测定细胞活力
将细胞按1×105/mL密度同时接种于96孔板,每孔接种200μL,每组各设8个平行孔,按实验分组进行,各时间点吸弃上清,加入50μL MTT继续培养,4h后弃 MTT,加入100μL/孔DMSO,振荡溶解紫色结晶10min,用自动酶标仪测定在570 nm波长处吸光度值,以反映细胞活力。
1.6 Edu检测细胞增殖
将细胞按5×105/mL密度同时接种于24孔板,每孔接种500μL,按实验分组进行,检测时间点前2h加入Edu溶液,在各时间点固定细胞。严格按试剂盒说明书进行染色。
1.7 流式细胞术分析细胞周期
细胞按5×105/mL接种于6孔板中,每孔2 mL,于干预后不同时间点6、12、24、48h收取细胞,用流式细胞仪检测细胞周期。细胞以0.25%胰酶消化,待细胞变圆后用全培养液终止,吹打脱壁,使其分散成单个细胞悬液;冷的PBS漂洗1次;加入预冷的80%乙醇固定细胞,-20℃冰箱保存;检测前用PBS漂洗2次除去乙醇,加入1mL含200 μmol/L RNAase和50μmol/L PI的 PBS重悬细胞,4℃避光染色过夜,用Becton-Dickinson荧光激活细胞分选器进行分析。
1.8 统计学处理
2 结果
2.1 BMEC的特异性鉴定及NKCC1表达情况
原代培养的BMEC细胞体积较大,呈旋涡状排列。将BMEC做VWF免疫荧光染色,证明原代培养的BMEC 98%表达内皮细胞特异性抗原VWF,且原代培养的BMEC 100%表达NKCC1(图1)。
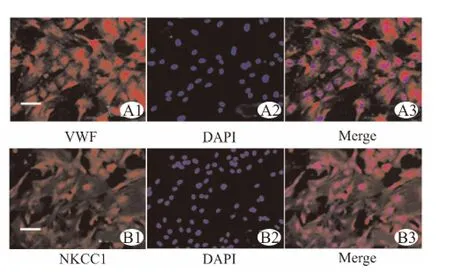
图1 BMEC特异性鉴定及NKCC1表达Fig.1 Specificity identification of BMEC and expression of NKCC1
2.2 MTT检测BMEC的活力
与对照组相比,OGD/Reo组在复氧6、12、24h和48h后细胞活力明显降低(P<0.05);而布美他尼干预后,在复氧6、12、24h可促使细胞活力增加(P<0.05)。见图2。

图2 MTT检测不同干预组BMEC活力Fig.2 BMEC viability of different groups detected by MTT
2.3 Edu检测BMEC增殖
OGD/Reo组干预后6、12、24h时Edu染色阳性率较对照组显著降低(P<0.05)。OGD/Reo+Bumetanide组布美他尼干预后,Edu阳性率较OGD/Reo组明显增加(P<0.05)。48h时各组间差异无统计学意义。见图3、4。
2.4 流式细胞术检测BMEC的细胞周期变化
用流式细胞术检测细胞周期的变化:OGD/Reo组在6、12、24h和48h时,处于S期细胞明显减少(P<0.05),与 OGD/Reo组相比,在6、12h和24h时,OGD/Reo+Bumetanide组S期细胞明显增加(P<0.05)(图5、6)。
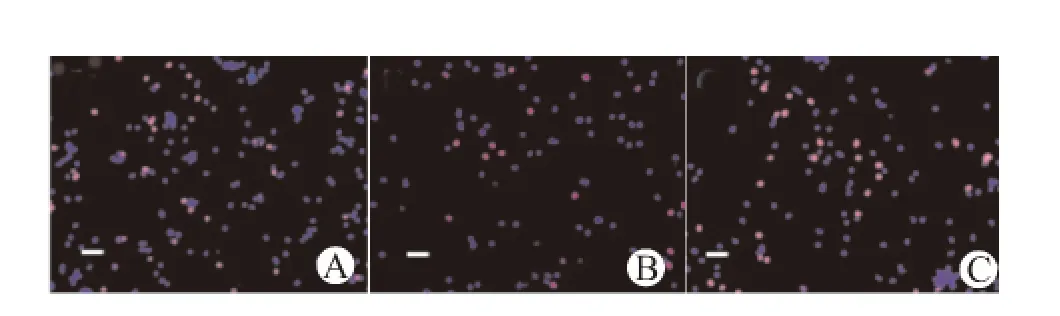
图3 干预6h时各组细胞的Edu染色图Fig.3 Edu dyeing images of different groups at 6h

图4 各组Edu染色阳性细胞率Fig.4 Edu positive rate of different groups
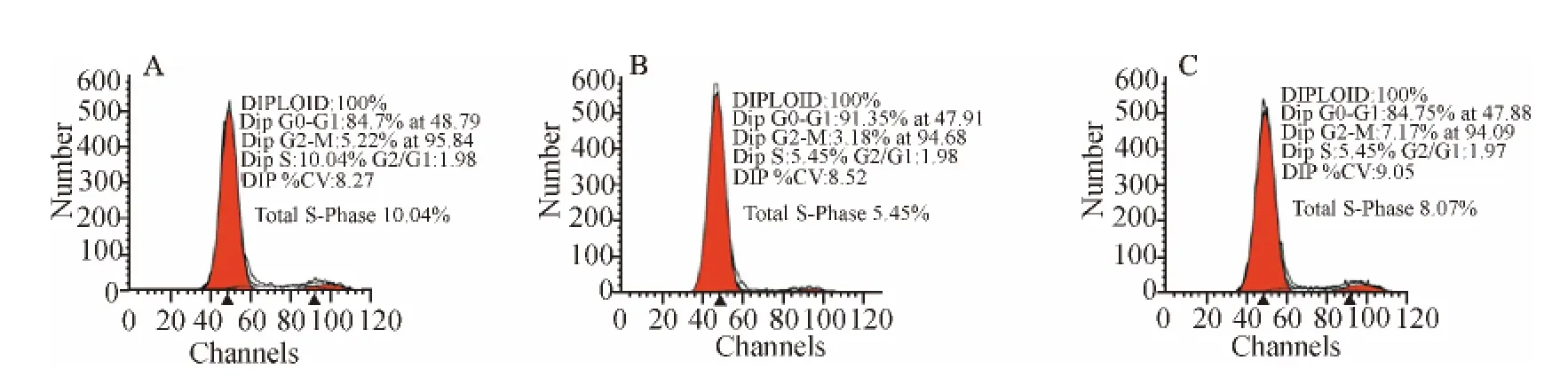
图5 干预6h时各组细胞的流式细胞检测结果图Fig.5 Flow cytometry results of different groups at 6h
3 讨论
脑微血管内皮细胞(BMEC)为血脑屏障的主要组成部分,能够限制可溶性物质和细胞等从血液进入大脑,并参与血管神经单元组成[6-7]。中枢神经系统(CNS)受损后,脑组织水肿,BMEC肿胀破裂,血脑屏障破坏,有害物质进入脑组织,加剧组织损伤[8-9]。同时,BMEC可分泌营养物质,促进少突胶质前体细胞迁移、分化。BMEC的增殖促进了微血管再生,对神经元、神经胶质细胞功能以及组织恢复起到重要作用[3]。

图6 各组细胞中S期细胞百分比Fig.6 Percentage of cells in S phase in different groups
NKCC1是新近发现的一类离子通道,其在维持细胞的离子平衡、细胞体积、细胞凋亡以及细胞增殖方面具有非常大的作用[4]。目前研究发现,NKCC1主要表达在内皮细胞、神经胶质细胞和神经元中[5]。生理条件下,NKCC1主要调节细胞中Na+-K+-2Cl-离子的平衡,从而维持适当的细胞体积[10]。NKCC1参与多种中枢神经系统疾病,研究证实,在大鼠线栓法大脑中动脉阻塞(MCAO)模型中,皮层神经元中NKCC1的转录水平和蛋白水平都会显著上调,抑制NKCC1的表达可以减轻脑梗死面积,减少神经元凋亡[11]。NKCC1表达过多促进早产儿癫痫发作,且抑制NKCC1可减轻脊髓损伤后疼痛[12-13]。脑缺血后 NKCC1对 BMEC增殖的影响目前尚不清楚。
本研究显示,OGD后,BMEC活力减低,增殖减弱。NKCC1的阻断剂布美他尼干预可减轻OGD对BMEC增殖的影响,与OGD/Reo组相比,BMEC活力增加,增殖增强。提示NKCC1抑制剂对BMEC具有保护作用。既往研究显示NKCC1通过与P38MAPK及ERK1/2信号通路相互作用,调节角膜上皮细胞增殖;通过影响细胞G0/G1周期调节人未分化细胞癌增殖[14-17]。因此我们推测 NKCC1可能影响MAPK信号通路,促进OGD后BMEC增殖,其机制还需要进一步研究。
综上所述,NKCC1在BMEC增殖中发挥了重要作用,抑制NKCC1进而促进BMEC增殖可能为其促进中枢神经系统损伤修复的原因之一。本研究结果为进一步了解CNS损伤后NKCC1作用、BMEC增殖机制及其调控方法提供了实验依据。
[1] Gerritsen M E.Functional heterogeneity of vascular endothelial cells[J].Biochem Pharmacol,1987,36(17):2701-2711.
[2] Engelhardt B,Sorokin L.The blood-brain and the blood-cerebrospinal fluid barriers:function and dysfunction[J].Semin Immunopathol,2009,31(4):497-511.
[3] Lee S R,Wang X,Tsuji K,et al.Extracellular proteolytic pathophysiology in the neurovascular unit after stroke[J].Neurol Res,2004,26(8):854-861.
[4] Jayakumar A R,Panickar K S,Curtis K M,et al.Na-K-Cl cotransporter-1in the mechanism of cell swelling in cultured astrocytes after fluid percussioninjury[J].J Neurochem,2011,117(3):437-448.
[5] Sun D,Lytle C,O’Donnell M E.Astroglial cell-induced expression of Na-K-Cl cotransporter in brain microvascular endothelial cells[J].Am J Physiol,1995,38(6):1506-1512.
[6] Hirooka T,Kaji T.The cytotoxicity of methylmercury in human microvascular endothelial cells and pericytes in culture[J].Biol Pharm Bull,2012,35(8):1201-1205.
[7] Ronaldson P T,Davis T P.Blood-brain barrier integrity and glial support:mechanisms that can be targeted for novel therapeutic approaches in stroke[J].Curr Pharm Des,2012,18(25):3624-3644.
[8] Pham L D,Hayakawa K.Crosstalk between oligodendrocytes and cerebral endothelium contributes to vascular remodeling after white matter injury[J].Glia,2012,60(6):875-881.
[9] Hayakawa K,Seo J H.Cerebral endothelial derived vascular endothelial growth factor promotes the migration but not the proliferation of oligodendrocyte precursor cells in vitro[J].Neurosci Lett,2012,513(1):42-46.
[10] Kahle K T,Staley K J,Nahed B V,et al.,Roles of the cationchloride cotransporters in neurological disease[J].Nat Clin Pract Neurol,2008,4(9):490-503.
[11] Chen H,Luo J,Kintner D B,et al.Na+-dependent chloride transporter(NKCC1)-null mice exhibit less gray and white matter damage after focal cerebral ischemia[J].J Cereb Blood Flow Metab,2005,25(1):54-66.
[12] Garzon-Muvdi T,Schiapparelli P,ap Rhys C,et al.Regulation of brain tumor dispersal by NKCC1through a novel role in focal adhesion regulation[J].PLoS Biology,2012,10(5):e1001320.
[13] Kahle K T,Simard J M,Staley K J,et al.Molecular mechanisms of ischemic cerebral edema:role of electroneutral ion transport[J].Physiology(Bethesda),2009,24(4):257-265.
[14] Wang Z,Bildin V N,Yang H,et al.,Dependence of corneal epithelial cell proliferation on modulation of interactions between ERK1/2and NKCC1[J].Cell Physiol Biochem,2011,28(4):703-714.
[15] Young S Z,Taylor M M,Wu S,et al.,NKCC1knockdown decreases neuron production through GABA(A)-regulated neural progenitor proliferation and delays dendrite development[J].J Neurosci,2012,32(39):13630-13638.
[16] Shiozaki A,Miyazaki H,Niisato N,et al.Furosemide,a blocker of Na+/K+/2Cl-cotransporter,diminishes proliferation of poorly differentiated human gastric cancer cells by affecting G0/G1state[J].J Physiol Sci,2006,56(6):401-406.
[17] 韩红,黎纬明,邹萍,等.JNK、P38-MAPK、IκB-α在异基因CD4+T细胞致人脐静脉内皮细胞损伤中的表达及与TF的关系[J].华中科技大学学报:医学版,2013,42(5):515-519.
