金菊解毒颗粒质量考察
2013-12-23丁志军罗美兰廖银根甘慧群江西省皮肤病专科医院药剂科江西南昌330001
丁志军,罗美兰,廖银根,甘慧群 (江西省皮肤病专科医院药剂科,江西 南昌330001)
金菊解毒颗粒(批准文号:赣药制字Z20110033)系江西省皮肤病专科医院中医科专家经十几年临床总结的经验方(专利号:ZL200410033920X),由金银花、菊花、连翘、黄柏、赤芍、大黄、黄芩、天花粉等8味中药组成,具有清热解毒,燥湿行瘀,消肿排脓之功效。临床上主要用于风热湿毒蕴结肌肤所致痤疮、脂溢性皮炎、湿疹、丹毒等皮肤病,疗效确切。为确保制剂的质量,笔者根据处方中所含药物化学成分及剂型的特点,研究制定了连翘、黄柏、赤芍的薄层色谱鉴别及制剂中绿原酸、芍药苷的含量测定方法,用于控制该药品质量。现报道如下。
1 材料
1.1 仪器 Agilent-1100 高效液相色谱仪(美国);CAMAG TLC SCANNER Ⅲ型 薄 层 扫 描 仪(瑞 士);CAMAG TLC SAMPLER4型自动点样仪(瑞士);PBQ-Ⅱ型薄层自动铺板器(重庆南岸实验电器厂);BP-211D Sartorius电子天平(德国)。
1.2 试药 绿原酸对照品(批号110753-200413,供含量测定用)、芍药苷对照品(批号110736-201035,供含量测定用)、连翘对照药材(批号120908-200915)、黄柏对照药材(批号121510-201105)、赤芍对照药材(批号121092-201003)均购自中国食品药品检定研究院;金菊解毒颗粒(江西省皮肤病专科医院,批号110801,110802,110803);甲醇为色谱纯,其他试剂均为分析纯。
2 方法与结果
2.1 定性鉴别
2.1.1 连翘的TLC鉴别
(1)供试品溶液的制备:取本品5 g,加稀乙醇20 mL,超声处理20 min,滤过,滤液蒸干,残渣加乙醇1 mL使溶解,作为供试品溶液。
(2)对照药材溶液的制备:取连翘对照药材0.5 g,按供试品溶液的制备方法制成对照药材溶液。
(3)阴性对照溶液的制备:按处方及制法,制成缺连翘的阴性样品,取相当于样品的量,按供试品溶液的制备方法制成阴性对照溶液。
照薄层色谱法(中国药典2010 年版一部附录ⅥB)试验,吸取上述溶液各10μL,分别点于同一硅胶G 薄层板上,使成条带状,以氯仿-甲醇(7∶1)为展开剂,展开,取出,晾干,喷以5%香草醛硫酸溶液,在105 ℃加热至斑点显色清晰。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点,阴性对照无干扰。连翘的TLC见图1。

图1 金菊解毒颗粒中连翘的薄层色谱图1~3.供试品;4.连翘药材;5.阴性对照Fig 1 TLC of Forsythia in Jinju Jiedu granules1-3.test sample;4.Forsythia;5.negative control
2.1.2 黄柏的TLC鉴别
(1)供试品溶液的制备:取本品5 g,加甲醇20 mL,超声处理20 min,滤过,滤液蒸干,残渣加甲醇2 mL使溶解,作为供试品溶液。
(2)对照药材溶液的制备:取黄柏对照药材0.1 g,按供试品溶液的制备方法制成对照药材溶液。
(3)对照品溶液的制备:取盐酸小檗碱对照品,加甲醇制成每1 mL含0.5 mg的溶液,作为对照品溶液。
(4)阴性对照溶液的制备:按处方及制法,制成缺黄柏的阴性样品,取相当于样品的量,按供试品溶液的制备方法制成阴性对照溶液。
照薄层色谱法(中国药典2010 年版一部附录ⅥB)试验,吸取上述溶液各2μL,分别点于同一硅胶G 薄层板上使成条带,以正丁醇-冰醋酸-水(7∶1∶2)为展开剂,展开,取出,晾干,置紫外光灯(365 nm)下检视。供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的荧光斑点,阴性对照无干扰。黄柏的TLC见图2。
2.1.3 赤芍的TLC鉴别
(1)供试品溶液的制备:取本品5 g,加水饱和正丁醇20 mL,超声处理20 min,滤过,滤液蒸干,残渣加甲醇2 mL 使溶解,作为供试品溶液。
(2)对照药材溶液的制备:取赤芍对照药材1 g,按供试品溶液的制备方法制成对照药材溶液。
(3)对照品溶液的制备:取芍药苷对照品,加甲醇制成每1 mL含2 mg的溶液,作为对照品溶液。
(4)阴性对照溶液的制备:按处方及制法,制成缺赤芍的阴性样品,取相当于样品的量,按供试品溶液的制备方法制成阴性对照溶液。

图2 金菊解毒颗粒中黄柏的薄层色谱图1~3.供试品;4.黄柏药材;5.盐酸小檗碱对照品;6.阴性对照Fig 2 TLC of Cortex Phellodendri in Jinju Jiedu granules1-3.test sample;4.Cortex Phellodendri;5.reference substance of Berberine hydrochloride;6.negative control
照薄层色谱法(中国药典2010 年版一部附录ⅥB)试验,吸取上述溶液各5μL,分别点于同一硅胶G 薄层板上,使成条带状,以氯仿-醋酸乙酯-甲醇-甲酸(40∶5∶10∶0.2)为展开剂,展开,取出,晾干,喷以5%香草醛硫酸溶液,在105℃加热至斑点显色清晰。供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点,阴性对照无干扰。赤芍的TLC见图3。

图3 金菊解毒颗粒中赤芍的薄层色谱图1~3.供试品;4.赤芍药材;5.芍药苷对照品;6.阴性对照Fig 3 TLC of Red Peony in Jinju Jiedu granules1-3.test sample;4.Red Peony;5.reference substance of Paeoniflorin;6.negative control
2.2 含量测定
2.2.1 色谱条件 色谱柱:Phenomenex C18柱(4.6 mm×250 mm,5μm);流动相:甲醇(A)-1%磷酸溶液(B)梯度洗脱,洗脱条件见表1;DAD检测器,检测波长327 nm(绿原酸),230 nm(芍药苷);流速:0.8 mL·min-1;柱温:40 ℃;进样量:5μL。

表1 流动相梯度洗脱Tab 1 The mobile phase gradient elution
2.2.2 溶液的制备
(1)对照品溶液的制备 取绿原酸对照品、芍药苷对照品适量,精密称定,置棕色量瓶中,加甲醇溶解制成每1 mL分别含0.34、0.11 mg的对照品溶液,即得(10 ℃以下保存)。
(2)供试品溶液的制备 取本品颗粒研细,取约1.0g,精密称定,置具塞锥形瓶中,精密加入50%甲醇溶液50 mL,称定,超声处理30 min,放冷,再称定,用50%甲醇溶液补足减失的质量,摇匀,滤过,即得。
(3)阴性对照液的制备 按处方工艺分别制备缺金银花、菊花和赤芍的金菊解毒颗粒阴性样品,按“2.2.3”项下方法制备阴性对照溶液。
2.2.3 专属性试验 按上述色谱条件,分别精密吸取对照品溶液、供试品溶液、阴性对照溶液各5μL 注入液相色谱仪,记录色谱图。结果,供试品在与对照品色谱图相应的位置上有相同的绿原酸峰、芍药苷峰,而阴性对照无干扰。色谱图见图4。

图4 金菊解毒颗粒高效液相色谱图A.绿原酸对照品;B.金菊解毒颗粒提取液;C.阴性(缺金银花、菊花);D.芍药苷对照品;E.金菊解毒颗粒提取液;F.阴性(缺赤芍)1-绿原酸;2-芍药苷Fig 4 HPLC chromatogram of Jinju jiedu granulesA.reference substance of chlorgenic acid;B.Jinju Jiedu granules extract;C.negative(lack chrysanthemun,Honeysuckle);D.reference substance of paeoniflorin;E.Jinju Jiedu granules extract;F.negative(lack of Radix Paeoniae Rubra)1-chlorogenic acid;2-paeoniflorin
2.2.4 线性范围的考察 精密吸取混合对照品溶液2.0、4.0、6.0、8.0、10.0μL分别注入高效液相色谱仪,按上述色谱条件测定峰面积,以峰面积为纵坐标,进样量(μg)为横坐标,进行线性回归,绿原酸的回归方程为:Y=119 381.86 X+0.47,线性范围为0.68~3.40μg(r2=0.999 8);芍药苷的回归方程为:Y=554 197.55 X+0.34,线性范围为0.22~1.10 μg(r2=0.999 6)。
2.2.5 精密度试验 取对照品溶液,注入液相色谱仪,连续进样6次,每次5μL,测得绿原酸、芍药苷平均峰面积值,RSD 分别为0.28%,0.17%,表明精密度良好。
2.2.6 稳定性试验 精密吸取对照品溶液,分别在0、2、4、6、8 h进样,进样量为5μL,测得绿原酸、芍药苷吸收平均峰面积值,RSD 分别为0.37%(n=5)和0.30%(n=5),结果表明绿原酸、芍药苷在8 h内稳定。
2.2.7 重复性试验 取同一批样品6 份,精密称定,按“2.2.2”项下方法制备供试品溶液,按上述色谱条件进样测定,进样量为5μL,测得峰面积值,计算绿原酸、芍药苷含量,RSD 分别为0.80%,0.49%,结果表明此法重复性良好。
2.2.8 回收率试验 取同一批已知含量的样品(批号110801)6份,分别精密加入一定量的绿原酸、芍药苷对照品,按“2.2.2”项下方法制备供试品溶液,按上述色谱条件进样测定,进样量为5μL。结果见表2。
2.2.9 样品测定 取本品3批,按“2.2.2”项下方法制备供试品溶液,按上述色谱条件进样测定,进样量为5μL。结果见表3。
由试验结果可知,仪器的精密度、指标成分的稳定性、方法的重复性和加样回收率等均较好,符合定量要求。根据测定结果,暂定每1 g金菊解毒颗粒中含金银花、菊花以绿原酸计,不得少于5.51 mg;含赤芍以芍药苷计,不得少于3.68 mg(取3批平均含量的80%为其下限)。
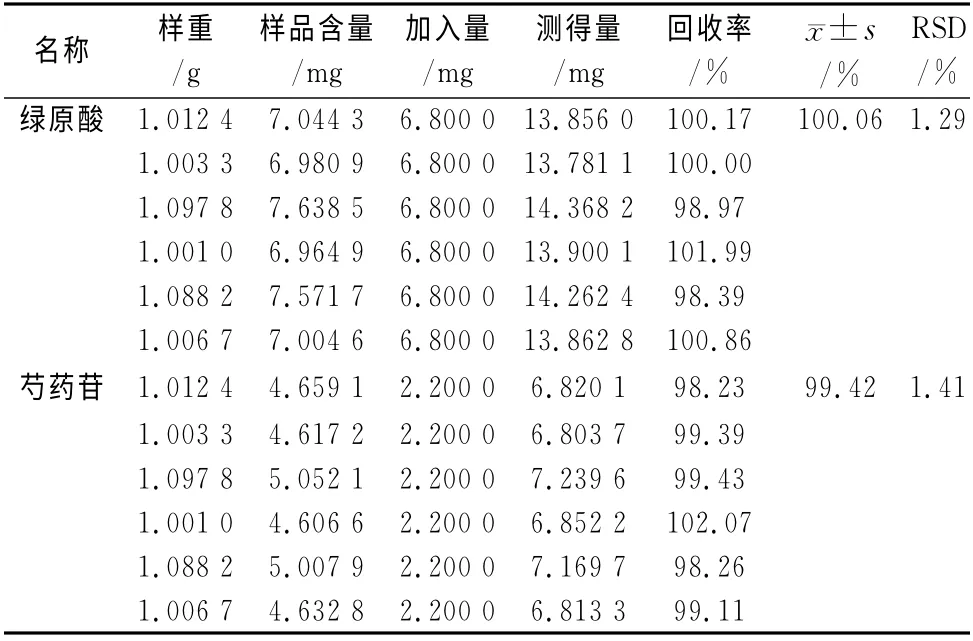
表2 金菊解毒颗粒加样回收率试验结果(n=6)Tab 2 Results of recovery test of Jinju Jiedu granules(n=6)

表3 金菊解毒颗粒样品含量测定结果(n=3)Tab 3 Results of content determination of Jinju Jiedu granules(n=3)
3 讨论
金菊解毒颗粒处方中的药味较多,成分复杂,薄层鉴别有较大困难。笔者对处方中每味药材都进行了TLC 鉴别方法实验条件摸索,经过反复试验,进行多因素实验条件的比较,制定出本制剂中连翘、黄柏和赤芍的薄层鉴别方法。在赤芍的薄层鉴别中,曾参考文献[1],用乙醇处理样品,展开后斑点分离不理想,后改用水饱和正丁醇提取,结果斑点显色清晰,分离效果好。
金银花作为金菊解毒颗粒中的君药,其主要活性成分绿原酸含量较高,且为臣药菊花所共有成分,故选其为制剂含量测定的指标成分之一;臣药赤芍投料量较大,因此选择其所含主要有效成分芍药苷作为含量测定的另一指标。在指标成分含量测定考察时,笔者曾参考文献[2-3]色谱条件以HPLC法同时测定金菊解毒颗粒中绿原酸、芍药苷含量,分离结果均不理想;改用甲醇-1%磷酸溶液梯度洗脱可将2个组分完全分离(分离度均大于1.5),且分析速度快,重现性好,供试品制备方法简单,可作为该制剂定量的指标。
综上所述,所建方法可用于金菊解毒颗粒的质量控制。
[1] 中国药典.一部[S].2010:147.
[2] 褚文静,张雪,王伟,等.HPLC法测定抗感胶囊中绿原酸、咖啡酸、芍药苷、木犀草苷和芦丁[J].中草药,2010,41(1):66-68.
[3] 刘元媛,卢静华,郭伟英,等.RP-HPLC法测定抗感颗粒中芍药苷和绿原酸的含量[J].中国药房,2011,22(40):3820-3821.
