SnSb金属间化合物的制备及其高硫原油脱硫性能研究
2013-12-23郑凯元邹京伦宋林花侯绪连
李 雯, 郑凯元, 邹京伦, 刘 东*, 宋林花, 娄 斌, 侯绪连
(1.中国石油大学(华东)化学工程学院重质油国家重点实验室,山东青岛266580;2.中国石油新疆油田公司,新疆克拉玛依834000;3.中国石油化工股份有限公司胜利油田分公司技术检测中心,山东东营257000;4.中国石油大学(华东)理学院,山东青岛266580)
各类原油中都含有不同浓度的硫化物,我国原油硫含量较低,但随着我国经济的高速发展,对轻质油品的需求量日益增大,国内原油开采量无法满足需求,所以我国进口部分原油保持国内需求[1]。国外原油硫含量较高,尤其是中东原油[2-3]。硫化物是影响炼油行业的重要因素之一,原油中的硫化物不仅会对设备产生腐蚀还会对石油产品性能造成巨大影响[4-7]。汽油、柴油及车用燃料的质量与汽车尾气的排放及空气污染有着直接的关系。随着国民经济和人类生活水平的高速发展,人们对环境的保护要求也越来越高,降低燃料油中的硫化物就是解决空气污染的方法之一。因此,生产清洁低硫燃料油是炼油行业的重 要 发展方向[8-9]。Lu S H 等[10]首 次报道一种新的吸附脱硫的方法,该方法可以在常温常压的条件下,利用新型的功能性材料SnSb金属间化合物表面特殊的晶体结构、电子能带和结构脱除原油中的硫。D Roger[11]指出,将SnSb压成过滤膜片装入磁管中,该磁管反应器可以直接降低原油中的硫含量,这种脱硫方法不仅成本低而且可以减缓设备的腐蚀。尽管利用SnSb金属间化合物脱硫在国内外取得了一定的研究进展[11-14],但是,SnSb金属间化合物的制备,表面形貌的表征、脱硫机理仍然需要进一步研究。
本文采用不同化学还原共沉淀法,分别是以SnCl2·H2O、SbCl3为金属前驱物,NaBH4为还原剂,在水溶剂中制备SnSb 金属间化合物,以及以SnCl2·H2O、SbCl3为金属前驱物,Zn为还原剂在水、乙二醇、丙三醇3种溶剂中制备SnSb金属间化合物。
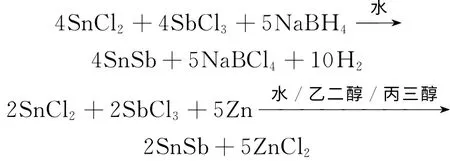
对比以上4种SnSb合金的形貌、相态、粒径以及脱硫性能,并考察了外加电压和反应时间对原油脱硫率的影响。
1 实验部分
1.1 SnSb金属间化合物的制备
采用化学还原共沉淀法合成SnSb金属间化合物,以NaBH4、Zn 为还原剂在水溶剂或有机溶剂(乙二醇、丙三醇)中还原SnCl2·H2O、SbCl3。将SnCl2·H2O、SbCl3以一定比例加入到反应溶剂中,搅拌溶解,作为氧化剂。将与SnCl2·H2O、SbCl3同等计量比的NaBH4或者Zn加入到反应溶剂中,作为还原剂。将氧化剂缓慢滴加至还原剂中,同时加速搅拌。反应直至无气泡产生,将反应得到的黑色沉淀抽滤、洗涤、真空干燥得到SnSb金属间化合物。具体的合成条件见表1,试验中所用药品为:SnCl2·H2O、SbCl3、Zn 粉、NaBH4、NaBH4、柠檬酸钠、乙二醇、丙三醇、Span-80、NaCl均为国药集团化学试剂有限公司生产;原油为沙特中质高硫原油。
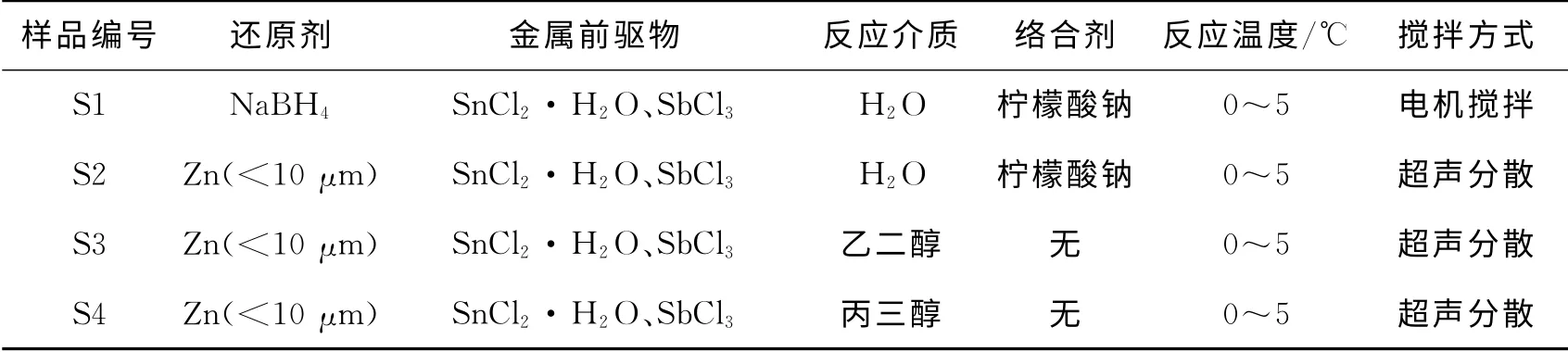
表1 SnSb金属间化合物的制备条件Table 1 Summary of synthesis conditions of SnSb intermetallics
1.2 SnSb金属间化合物的表征
采用荷兰帕纳科X'Pert Pro MPD 型多晶粉末X-射线衍射仪对SnSb金属间化合物进行了物相分析,Cu靶,Kα射线,工作电压和工作电流分别是40 kV 和40 mA,扫 描 速 度7(°)/s,2θ 扫 描 范 围5°~75°。将样品用无尘去离子水稀释至接近透明,采用OMEC公司生产的ZOF1-LS-POP(VI)型激光粒度分析仪测定粉末的粒径和粒径分布,实验温度为25℃。采用日本日立公司生产的S-4800的扫描电子显微镜分析粉末的表面相貌。采用法国生产的CILAS的BET 测定仪分析粉末的比表面积以及孔结构。
1.3 实验方法
实验在密闭的反应容器中进行,常温常压条件下,经直流恒压电源,一端接碳棒,作为负极,另一端接在铜片作为正极,两电极插入130g原油油包水乳状液中,将4gSnSb合金分散在原油油包水乳状液中,反应器底部是电磁搅拌,不断搅拌,加强原油乳状液与电极片的接触以及SnSb合金的分散。安培表测量反应体系是否通路,电压表测量反应电压。实验装置见图1。
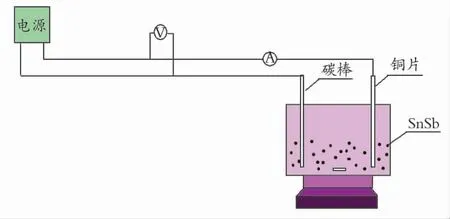
图1 实验装置示意图Fig.1 Apparatus of electric desulfurization
1.4 乳状液的配制
配制油水质量比为3∶1的原油乳状液,将原油和水总质量的0.15%~0.20%的乳化剂Span-80加入的原油中,以300r/min的速度搅拌20min,然后滴加去离子水,边滴加边搅拌,搅拌60min后,出现均匀体系,静置不分层,用胶头滴管取1滴滴入0 ℃冰水浴中,油滴长时间团聚未分散,既配置出稳定的油包水乳状液。
1.5 硫含量的测定
反应结束后,将原油乳状液加入离心管内,加NaCl破乳,取上层油相,测量硫含量。脱硫率计算公式为:
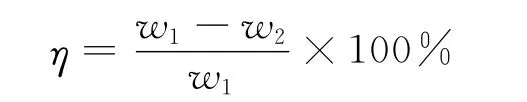
式中,η为脱硫率,%;w1为原油硫质量分数,%;w2为脱硫后原油硫质量分数,%。
2 结果与讨论
2.1 SnSb金属间化合物的表征
2.1.1 XRD 表征 以表1中4种不同的合成条件制备的SnSb金属间化合物的XRD 谱图见图2。
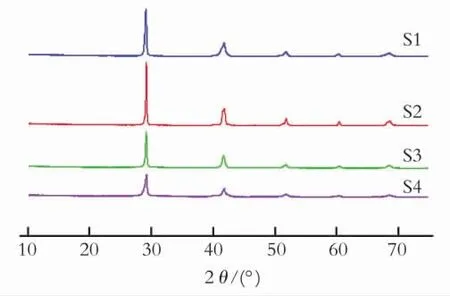
图2 不同化学还原条件下制备的SnSb金属间化合物的XRDFig.2 XRD spectra of SnSb intemetallic prepared under different chemical reduction condition
从图2可以看出,S1、S2、S3、S4的X 光衍射特征峰基本一致,在29°、41°、51°、61°、68°的衍射峰被检索属于晶格参数为a=0.432 55nm,b=0.432 55 nm,c=0.534 65nm 的斜方六面体β-SnSb的特征衍射峰,并且没有其他杂质的特征衍射峰[15]。说明S1、S2、S3、S4 4种样品均是SnSb金属间化合物,且组成纯净。对比4种条件下的XRD 衍射峰的半峰宽,可以看出,S4的半峰宽最窄,而以S2 的半峰宽最宽,说明S4 的粒径最小,而S2 的粒径最大。另外,尖锐的衍射峰表示出产物高“品位”的结晶度[16]。
2.1.2 粒径和BET 表征 SnSb合金颗粒的激光粒度分布图(见图3)表明,SnSb 合金的粒径从20 nm 到20μm 均有分布。表2 中列出了SnSb合金的比表面积(BET)以及平均粒径,对比4种还原条件制备的SnSb合金,可以看出,Zn在乙二醇中的还原产物的粒径分布较广,Zn在丙三醇中的还原产物的比表面积最大,粒径分布最窄,平均粒径最小为0.04μm,Zn在水中的还原产物的平均粒径最大。产生这种差别是因为反应溶剂的极性、黏度等物性对反应产生巨大影响。水的黏度最小,极性最大,对金属氯盐的溶解性好,丙三醇则黏度大,增大了离子传递的阻力,这阻止了产物颗粒的长大以及聚结。因此,S4的粒径最小,并且粒径分布也最窄,S2的粒径最大,粒径分布最宽。对比S2和S1可以看出,S1的粒径较小,粒径分布范围较窄,这是因为NaBH4作为还原剂发生的还原反应是均相反应,而Zn作为还原剂发生的还原反应是非均相反应,NaBH4且还原性较强(-1.24V 在碱性溶液中相对于标准氢电极),Zn的还原能力较弱(-0.76V 在中性溶液中相对于标准氢电极)[15],因此,NaBH4作为还原剂时,短时间内产生大量的晶核并同时生长,阻止了晶核的进一步聚沉、长大和偏析。
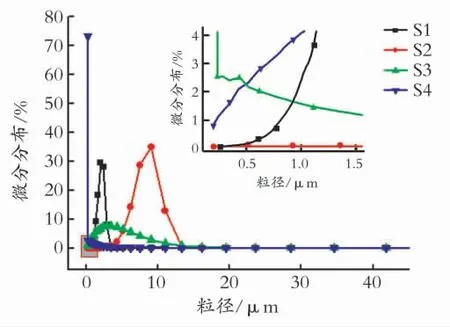
图3 SnSb金属间化合物的粒径分布Fig.3 Particle size distribution of SnSb intemetallic
2.1.3 SEM 分析 图4是不同反应条件下制备的SnSb合金的SEM 图。从图4可以看出,不同的反应条件得到SnSb合金的形貌差别巨大,NaBH4为还原剂在水中制备的产物是“立方块”型,Zn为还原剂在丙三醇中制备产物是“树枝”型,而Zn在乙二醇和水中还原得到的合金则是许多小“立方块”堆叠而成,彼此之间有小颗粒连接,接触面很小,这样就形成了一定的孔结构。
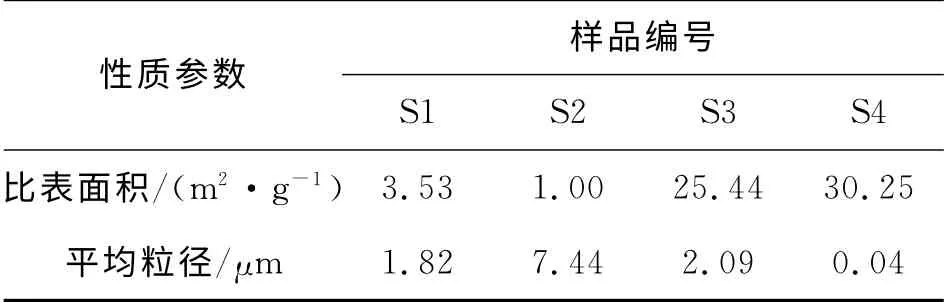
表2 BET 比表面及平均粒径分析Table 2 BET surface area and average diameter of SnSb intematallic

图4 SnSb金属间化合物的SEMFig.4 SEM of SnSb intermetallic
图5 是SnSb 金 属 间 化 合 物 的EDS,表3 为EDS元素的分析数据。
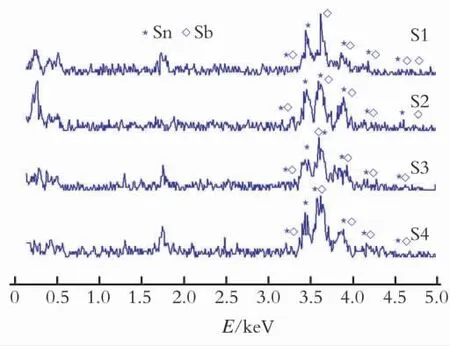
图5 SnSb金属间化合物的EDSFig.5 EDS spectra of SnSb intermetallics
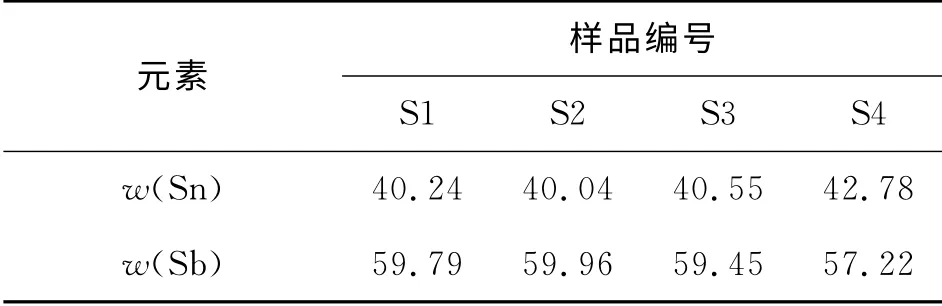
表3 EDS元素分析表Table 3 EDS analyse of 4 samples %
从图5和表3可以看出,以NaBH4、Zn为还原剂在水溶剂或有机溶剂(乙二醇、丙三醇)中还原SnCl2·H2O、SbCl3制备的4种样品颗粒表面均发现了Sn和Sb,并且Sb 质量分数是不一样的,这是由于SnSb合金在室温下的单晶区内是一种非定比化合物(Sb 质量分数为40%~60%)[17]。根据Sn、Sb的标准还原电势,从热力学的观点考虑,Sb应该先被还原成“核”,这样SnSb表面应该富Sn,但是,Sn成“核”的速度比Sb快,因此,SnSb合金表面富Sb,这也说明SnSb化学还原共沉淀法是动力学控制的。
2.2 SnSb金属间化合物对高硫原油脱硫性能
目前,SnSb金属间化合物脱硫的基本原理还不是很清楚,Lu S H 等[10]认为SnSb金属间化合物的脱硫机理是利用SnSb合金的导电性、表面离散的结晶区域、以及金属-金属键的缺陷位,在外加电场和旋转位移作用下与亲核性硫化物极性基团接触,使含硫化合物发生α或β键的断裂而脱除。
配制油水质量比为3∶1油包水型原油乳状液(原油硫质量分数为2.75%)130g,SnSb金属间化合物4g,考察不同工艺条件对原油脱硫影响。
2.2.1 电压 考察S1、S2、S3、S4 4种SnSb合金样品在不同的外加电压下对原油乳状液的脱硫率,反应时间为18h,反应结果如图6所示。从图6可以看出,4种SnSb样品对原油的脱硫率均随着电压的增大先增加后降低。通电的情况下,Sb转移电子给Sn,形成缺电子的P 极,而Sn则富集电子,形成N极,在合金内部形成在电子流,反应电压小,少数小分子、极性小的硫化物发生极化并被吸附,随着电压的增大,流过乳状液的电流增大,更多分子更大的硫化物发生极化,在电流的诱导下与SnSb合金表面发生破坏性吸附脱硫反应,但是当外加电压超过最佳值时,由于电极发热会使原油中的轻质组分受热逸出,原油乳状液稳定性下降,从而导致脱硫率下降。

图6 外加电压对原油乳状液脱硫率的影响Fig.6 Effect of loading voltage on desulfurization of crude oil emulsion
另外,从图6可以看出,同等反应条件下4种样品的脱硫率的关系为S4>S3>S1>S2,这是因为S4的平均粒径最小为0.04μm,而比表面积最大为30.25m2/g,反应过程与油水界面上硫化物的接触面积更大,所以脱硫最高,而S2的平均粒径最大为7.44μm,比表面积为1.00m2/g,脱硫率最低。
2.2.2 反应时间 考察S1、S2、S3、S4 4种SnSb合金样品在不同的脱硫时间下对原油乳状液的脱硫率,反应电压为20V,反应结果如图7所示。从图7可以看出,4种SnSb合金对原油对乳状液的脱硫率均随着脱硫时间的延长先增加后基本不变。反应时间较短时,仅有部分小分子的硫化物通过电流的作用吸附在SnSb合金表面,随着反应时间的延长,大部分的硫化物在电流的诱导作用下与吸附在SnSb合金表面与其发生反应,当反应时间超过18h,脱硫率基本不再变化。
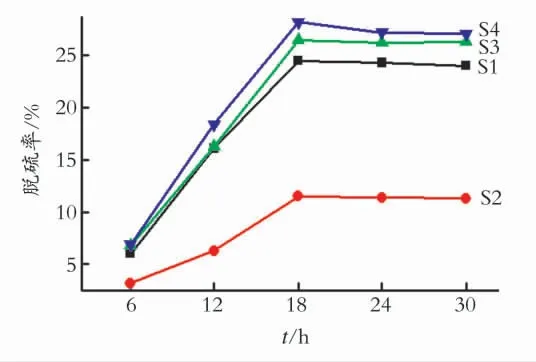
图7 脱硫时间对原油乳状液脱硫率的影响Fig.7 Effect of processing time on desulfurization rate of crude oil emulsion
3 结论
(1)由NaBH4和Zn在水溶液或者有机溶剂中还原Sn2+/Sb3+制备SnSb金属间化合物的形貌、结构、颗粒尺寸以及脱硫性能差异很大。
(2)由Zn在丙三醇中制备的SnSb金属间化合物的平均粒径为40nm,比表面积高,结晶度高,表观形貌为“树枝”型,对原油的脱硫率高。由NaBH4在水中制备的SnSb金属间化合物的平均粒径为1.82μm,比表面积低,结晶度低,表观形貌为“方砖”型,对原油的脱硫率低。
(3)实验范围内,SnSb金属间化合物颗粒粒径越小、外加电压越大,原油脱硫率越高。
[1] 钱伯章,朱建芳.世界原油质量趋势及我国面临的挑战[J].天然气与石油,2006,24(4):61-65.
[2] 宋昭峥,唐飞,蒋庆哲.含硫原油加工方案技术,经济和环境综合评价[J].现代化工,2010(8):83-86.[3] 廖家祺,王更新.加工中东含硫原油面临的问题和对策[J].炼油设计,2000,30(1):1-5.
[4] 刘东,孔学,李美玉,等.噻吩在硫化态Mo 基催化剂表面的吸附行为[J].石油学报(石油加工),2009,24(6):657-662.
[5] 崔文龙,邓文安,刘东,等.轮古高硫渣油中类型硫的分布[J].石油学报(石油加工),2010,26(S1):207-211.[6] 杨波,田松柏,赵杉林.不同形态硫化合物腐蚀行为的研究[J].腐蚀科学与防护技术,2004,16(6):385-388.
[7] 张会成,颜涌捷,孙万付,等.渣油加氢处理过程中硫的分布与脱除规律研究[J].燃料化学学报,2008,36(5):628-631.
[8] 李翠清,王洪学,李成岳,等.WP/γ-Al2O3催化剂负载方式对噻吩加氢脱硫性能的影响[J].燃料化学学报,2003,31(5):439-443.
[9] 王云芳,尹风利,史德清,等.车用燃料油吸附法深度脱硫技术进展[J].石油化工,2006,35(1):94-99.
[10] Lu S H,Yang I C,Mei H,et al.Sulfur filter by intermetallic media[J].Petroleum Science and Technology,2000,18(5-6):657-670.
[11] Roger D.Treatment of fluids:WO,99/04898[P].1999-04-02.
[12] Zhong W,Wenhuai T,Xing G L.Synthesis and electrochemistry properties of Sn-Sb ultrafine particles as anode of lithium-ion batteries[J].Journal of Alloys and Compounds,2007,439(1-2):350-354.
[13] 刘晓,云志,曹晶晶,等.新型脱硫材料SbSn金属间化合物的制备及其脱硫性能[J].燃料化学学报,2006,34(1):56-60.
[14] 王勇,谭娜,王菲,等.机械合金化制备金属间化合物SbSn及其在原油乳液脱硫中的应用[J].燃料化学学报,2008,36(4):494-498.
[15] Trifonova A,Wachtler M,Wagner M R,et al.Influence of the reductive preparation conditions on the morphology and on the electrochemical performance of Sn/SnSb[J].Solid State Ionics,2004,168(1):51-59.
[16] Balanl L,Schneider R,Billaud D,et al.A novel solution-phase and low-temperature synthesis of SnSb nano-alloys[J].Materials Letters,2005,59(23):2898-2902.
[17] Chen S W,Chen C C,Gierlotka W,et al.Phase equilibria of the Sn-Sb binary system[J].Journal of Electronic Materials,2008,37(7):992-1002.
