脱落酸不同处理时间对丹参毛状根有效成分积累的影响
2013-12-23盛东峰朱自学
盛东峰 ,朱自学
周口师范学院生命科学系,周口466000
丹参为唇形科植物丹参(Salvia miltiorrhiza Bge.)的干燥根及根茎,主要活性成分丹参酮类(包括丹参酮Ⅰ、ⅡA、隐丹参酮、二氢丹参酮Ⅰ等),是一类二萜醌化合物,常被用于微循环系统疾病的治疗。有研究表明,丹参酮类主要通过细胞质内甲羟戊酸途径(mevalonate,MVA)[1]和质体内非甲羟戊酸途径(2-C-methyl-d-erythritol-4-phosphate,MEP)[2]两条途径合成。
毛状根是发根农杆菌Ri 质粒的一段T-DNA 导入植物基因组中并表达的结果。丹参毛状根由于其培养过程中无需外源植物激素,生长速度快,合成次生代谢物的能力强而稳定。常被用于丹参酮生产及丹参酮合成机理的研究。干旱是影响作物生长发育的重要逆境因子,大量研究表明干旱能降低作物的最终产量。但也有资料显示干旱能诱导植物次生代谢产物(如萜类)成分的积累[3]。然而迄今为止,人们对干旱胁迫诱导丹参酮积累的机制尚不清楚。脱落酸(ABA)是一种植物激素,因其能抑制生长促使叶子脱落而得名,是干旱胁迫响应的重要信号物质。有研究显示ABA 能够诱导植物非甲羟戊酸途径相关代谢产物的合成[4]。本研究以丹参毛状根为试材,对ABA 不同处理时间条件下丹参酮类的积累规律进行了研究,以期揭示干旱胁迫对丹参酮类合成的调控机理。
1 材料与方法
1.1 实验材料
发根农杆菌菌株15834 购自中国林业科学院;无菌丹参苗叶。
1.2 试剂与仪器
SY-360 超声波提取仪(上海宁商超声仪器有限公司);360EP 电子天平(上海精科仪器有限公司);Waters 1525 二元高效液相色谱仪(美国Waters 公司);RO-MB-10D 高纯水机(杭州永洁达膜分离设备厂);smartcycler 荧光定量PCR(美国Cepheid 公司)。
脱酸酸(高纯级,美国Sigma 公司);磷甘霉素(美国Santa Cruz biotechnology 公司);乙腈(分析纯,山东齐鲁石化);钨酸钠(江苏姜堰贝斯特钼制品有限公司);洛伐他汀(美国Sigma 公司);丹参酮Ⅰ、隐丹参酮、二氢丹参酮Ⅰ和丹参酮ⅡA 等标准品(中国食品药品鉴定所);cDNA 合成试剂盒(美国Promega 公司);RNAisoTM Plus 试剂盒(大连宝生物工程有限公司);Brilliant III Ultra-Fast QPCR Master Mix 试剂盒(美国Agilent 公司)。
1.3 试验方法
1.3.1 毛状根培养及处理
在无硝酸铵的MS(Murashige and Skoog)培养基中,用发根农杆菌ATCC15834 诱导丹参无菌苗叶生产毛状根。然后取生长良好的丹参毛状根0.45 g置于含50 mL MS 液体培养基的三角瓶内,于25 ℃培养箱中黑暗下悬浮继代培养。
继代培养20 d 后,用浓度为210 μM 的ABA 处理,并分别于处理后1、3、6、9 d 收获毛状根,以研究ABA 处理不同时间对丹参毛状根生长和丹参酮类积累的影响。在ABA 处理毛状根第6 d 时,分别使用145 μM 磷甘霉素(FOS)、15 μM 洛伐他汀(MEV)和100 μM 的钨酸钠(TUN)处理毛状根,以研究抑制剂对丹参酮类积累的影响。同时用等试验组体积的无菌蒸馏水处理的毛状根作对照。每个处理组重复3 次,并分别于处理结束时立即收获毛状根,45 ℃烘干至恒重,称重,保存。
1.3.2 丹参酮的提取
取干燥至衡重的丹参毛状根适量研钵磨碎,过0.45 mm 筛,混匀后精密称取0.1000 g 细粉,加入2 mL 甲醇-水(7∶3)提取液,精密称重,超声处理45 min,10000 rpm 高速离心15 min,取上清液过0.45 μm 滤膜,即得。
1.3.3 丹参酮含量的HPLC 定量分析[5]采用RP-HPLC 色谱方法。色谱条件为:色谱柱Waters SunFire C18(250 mm ×4.6 mm,5 μm);柱温30 ℃,流速1.0 mL/min,上样体积20 μL,检测波长270 nm,流动相乙腈和水,线性梯度洗脱:0~5 min,40%乙腈;5~20 min;60%乙腈;20~23 min,60%乙腈;23~25 min,80%乙腈;25 min,100%乙腈。
1.3.4 RNA 分离、cDNA 合成及荧光RT-PCR 分析把处理24 h 的毛状根置于液氮中研磨成粉,采用购至大连宝生物工程有限公司RNAisoTMPlus 试剂盒提取总RNA。并以提取的RNA(500ng)为模板,采用美国Promega 公司生产的cDNA 试剂盒合成第一链cDNA。荧光RT-PCR 实时定量分析采用Brilliant III Ultra-Fast QPCR Master Mix 试剂盒(美国)。PCR 反应体积为25 μL,PCR 反应程序为:95℃~10 min,1 循环;95 ℃~30 s,60 ℃~1 min,72℃~30 s,40 循环。实验共设置3 个重复,内参基因为β-actin,3-羟基-3-甲基戊二酰辅酶A 还原酶(HMGR)和1-去氧木糖-5-磷酸还原酶(DXR)基因引物Oligo6 软件设计(表1)。

表1 RT-PCR 分析引物设计Table 1 The primers of genes used in RT-PCR
2 结果与讨论
2.1 不同ABA 处理时间对丹参毛状根生长的影响
不同ABA 处理时间对丹参毛状根的生长的影响见表2,由表2 可知,随着ABA 处理时间延长,毛状根的干重逐渐减少。和对照组相比,处理1、3、6、9 d 后,收获的毛状根分别减少为94.9%、88.5%、83.3%和80.8%。这说明,随着ABA 处理时间的增加,丹参毛状根生长受到抑制逐渐减弱,并在处理6 d 左右变的不显著。ABA 和三种丹参酮类合成抑制剂均对丹参毛状根的生长产生抑制效果,和FOS与MEV 相比,TUN +ABA 的抑制作为最弱,FOS +ABA 的抑制作用强于TUN + ABA,但弱于MEV +ABA。这说明MEV 能增强ABA 对丹参毛状根生长的抑制作用。

表2 不同ABA 处理时间对丹参毛状根生长的影响Table 2 Effects of ABAtreatment time on growth of S.miltiorrhiza hairy roots
2.2 不同ABA 处理时间对丹参酮类积累的影响
不同ABA 处理时间对丹参毛状根中丹参酮Ⅰ、隐丹参酮、二氢丹参酮Ⅰ和丹参酮ⅡA 产量和含量的影响见表3 和图1。从表3 和图1 可以看出,丹参毛状根在培养过程中经ABA 处理不同时间后,四种丹参酮的产量和含量均在ABA 处理6 d 左右达到稳定。其中丹参酮Ⅰ、隐丹参酮、二氢丹参酮Ⅰ和丹参酮Ⅱ的产量分别提高为空白对照组的4. 65、7.80、18.33 和2.11 倍。这表明ABA 是促进丹参酮积累的有效诱导因子。

表3 不同ABA 处理时间对毛状根四种丹参酮产量的影响Table 3 Yields of four tanshinone components in S.miltiorrhiza hairy roots with different ABA treatments time
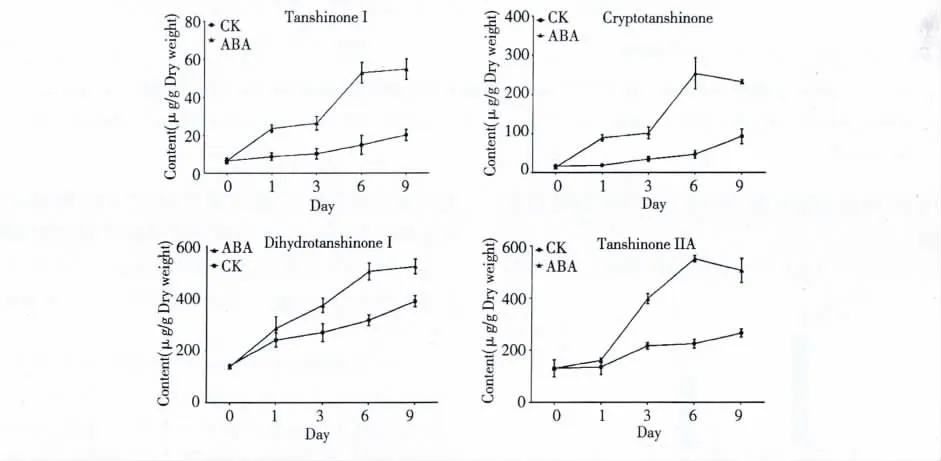
图1 不同ABA 处理时间对丹参酮含量的影响(CK 为空白对照)Fig.1 Effects of ABA treatment time on tanshinone production in S.miltiorrhiza hairy roots (CK was the blank control)
2.3 抑制剂和ABA 联合处理对丹参酮类积累的影响
磷甘霉素是丹参酮非甲羟戊酸途径合成过程中重要酶1-去氧木糖-5-磷酸还原酶(DXR)的专一性抑制剂;洛伐他汀是甲羟戊酸途径合成途径限速酶3-羟基-3-甲基戊二酰辅酶A 还原酶(HMGR)的专一性抑制剂;钨酸钠是植物内源脱落酸合成的抑制剂之一,能够抑制干旱胁迫条件下植物中脱落酸的积累。三种抑制剂均可不同程度抑制MEP 和MVA途径下游产物的积累和内源ABA 的合成。
本研究结果表明(见图2),FOS 与ABA 联合处理可显著抑制四种丹参酮含量的增加。其中,丹参酮Ⅰ、丹参酮ⅡA 和二氢丹参酮Ⅰ的含量降至接近对照组水平,隐丹参酮的含量降至对照组的37%;MEV 与ABA 联合处理对丹参酮Ⅰ和隐丹参酮的含量变化无显著影响,但能显著抑制丹参酮Ⅰ和丹参酮ⅡA 的积累,其抑制效果弱于FOS。这意味着ABA 可能主要通过诱导MEP 途径促进丹参酮的累积,但从结果也可以看出,MVA 途径对丹参酮类的积累可能也起着重要作用。
TUN 与ABA 联合处理对毛状根四种丹参酮含量均有显著的抑制作用,其中丹参酮Ⅰ含量降至接近对照组水平,丹参酮ⅡA 和二氢丹参酮Ⅰ含量低于对照组,隐丹参酮的含量则略高于对照组。本研究结果说明,外源ABA 对丹参酮类的诱导作用很可能与其内源ABA 有关。

图2 抑制剂FOS、MEV 和TUN 对ABA 处理条件下丹参酮积累的影响(CK 为空白对照)Fig.2 Effects of FOS (145μM),MEV (15μM)and TUN (100μM)on ABA (210 μM)-induced tanshinone production (CK was the control)
2.4 ABA 对丹参毛状根HMGR 和DXR 基因表达的影响
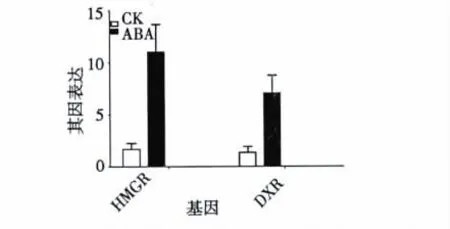
图3 ABA 对丹参毛状根HMGR 和DXR 基因表达的影响Fig.3 Effects of ABA (210 μM)on expression of HMGR and DXR.
图3 显示了ABA 对丹参毛状根HMGR 和DXR基因表达的影响,从图3 可以看出,ABA 够能显著诱导丹参毛状根MVA 中限速酶HMGR 基因和MEP中重要酶DXR 基因的表达,但笔者认为,这种诱导作用可能更多的依赖丹参毛状根内源ABA 的合成。
2.5 讨论
ABA 是植物重要的胁迫响应信号,植物会在胁迫响应敏感部位合成大量ABA[6]。有研究显示,ABA 能够诱导植物萜类成分的积累[7],但也有研究显示,ABA 会抑制植物萜类成分的积累[8]。本研究结果表明,随着ABA 处理时间的延长,丹参毛状根的生长被抑制,但其丹参酮类的含量和终产量增加,这说明,ABA 能够促进毛状根丹参酮类的积累。
FOS 和MEV 作为植物萜类成分重要合成途径(MVA 和MEP 途径)中关键酶的抑制剂,已经被广泛应用于植物萜类合成的调控研究[9]。尽管植物萜类主要通过MEP 途径合成,但两条途径之间的相互作用对萜类合成的影响也不能忽视[10]。本试验结果表明,FOS 和MEV 均能增大ABA 对丹参毛状根中丹参酮类积累的抑制作用。笔者认为,ABA 能促进毛状根中丹参酮类的积累,可能与其能诱导DXR 和HMGR 基因表达,激活毛状根MVA 和MEP途径,特别是MEP 途径有关。TUN 与ABA 联合处理毛状根的相关数据也表明,ABA 能够抑制毛状根内源ABA 的合成,进而影响外源ABA 对丹参毛状根的处理效果。
3 结论
本试验通过研究不同ABA 处理时间对丹参毛状根的产量、丹参酮类含量及其积累规律的影响,以及ABA 和相关萜类合成途径抑制剂对丹参毛状根的联合抑制效果,得到的结论是:①ABA 对丹参毛状根的生长抑制作用在处理6 d 左右减弱。ABA 能抑制毛状根的生长,但能诱导丹参酮类的积累和其主要合成途径中限速酶HMGR 与DXR 基因的表达;②磷甘霉素(FOS)几乎能完全抑制ABA 对四种丹参酮的积累作用,但洛伐他汀(MEV)仅能部分抑制丹参酮的积累;TUN 则能显著抑制内源ABA 的生成;③ABA 对两种丹参酮合成途径MVA 和MEP 都有激活作用,但可能主要通过激活MEP 途径诱导丹参酮的积累。
1 Lichtenthaler HK. Non-mevalonate isoprenoid biosynthesis:enzymes,genes and inhibitors.Biochem Soc Trans,2000,28:785-789.
2 Rohmer M.The discovery of a mevalonate-independent pathway for isoprenoid biosynthesis in bacteria,algae and higher plants.Nat Prod Rep,1999,16:565-574.
3 Wang JW,Wu JY.Tanshinone biosynthesis in Salvia miltiorrhiza and production in plant tissue cultures. Appl Microbiol Biotechnol,2010,88:437-449.
4 Mansouri H,Asrar Z,Szopa J.Effects of ABA on primary terpenoids and Δ9-tetrahydrocannabinol in Cannabis sativa L.at flowering stage.Plant Growth Regul,2009,58:269-277.
5 Gu J (顾娟),Luo HY(罗海燕),An LY(安连英),et al.The study on the extraction of the salvianolic acid by water.Nat Prod Res Dev(天然产物研究与开发),2005,17:781-783.
6 Zhang J,Jia W,Yang J,et al. Role of ABA in integrating plant responses to drought. Field Crops Res,2006,25:111-119.
7 Mansouri H,Asrar Z.Effects of abscisic acid on content and biosynthesis of terpenoids in Cannabis sativa at vegetative stage.Biologia Plantarum,2012,55:153-156.
8 Pan QF,Chen Y,Wang Q,et al.Effect of plant growth regulators on the biosynthesis of vinblastine,vindoline and catharanthine in Catharanthus roseus.Plant Growth Regul,2010a,60:133-141.
9 Skorupinska-Tudek K,Poznanski J,Wojcik J,et al.Contribution of the mevalonate and methylerythritol phosphate pathways to the biosynthesis of dolichols in plants.J Biol Chem,2008,283:21024-21035.
10 Ge XC,Wu JY.Tanshinone production and isoprenoid pathways in Salvia miltiorrhiza hairy roots induced by Ag+and yeast elicitor.Plant Sci,2005b,168:487-491.
