铜藻中β-丙氨酸的分离及结构鉴定
2013-12-23林祥志王龙梅苏永全
荣 辉,林祥志 ,王龙梅,苏永全
1厦门大学海洋与地球学院;2国家海洋局第三海洋研究所,厦门361005
非蛋白质氨基酸是指除组成蛋白质的20 种常见氨基酸以外的含有氨基和羧基的化合物。非蛋白质氨基酸多为蛋白氨基酸的类似物或取代衍生物,如甲基化、磷酸化、羟化、糖苷化、交联等等。除此之外,还包括β、γ、δ 氨基酸及D-氨基酸[1]。非蛋白质氨基酸多以游离或小肽的形式存在于生物的各种细胞或组织中。据统计,从动物、植物、微生物体内分离得到的非蛋白质氨基酸已达700 余种,其中已测定分子结构的有400 多种,在植物中发现的约240种,动物中发现的有50 多种,其余多存在于微生物中[2]。非蛋白质氨基酸可以作为合成其它含氮物质的前身,如激素、抗生素、生物碱、色素等,还可作为组成细菌细胞壁的成分。非蛋白质氨基酸还可参与储能,充当神经递质,参与跨膜离子通道的形成,并在抗癌、抗菌、抗结核、护肝、降血压、升血压等方面都发挥了极其重要的作用[3]。
铜藻Sargassum horneri (Turn.)C. Ag. 属于马尾藻属,是非食用海藻,主要分布于我国东海、南海沿岸,资源相当丰富,常用作饲料、藻胶、饮料的原料,部分地区作为中药海藻使用。目前已从马尾藻中发现多类具有生物活性的化合物,主要有甾类化合物、萜烯类化合物、甘油糖脂、间苯三酚衍生物及其聚合物等物质,铜藻的化学成分研究较少,仅报道含褐藻酸、甘露醇、多糖、甾醇等[4]。本论文主要开展了铜藻中游离非蛋白质氨基酸的检测分析、部分分离及结构鉴定研究。
1 材料和方法
1.1 实验材料
铜藻Sargassum horneri (Turn.)C.Ag.:采自中国福建沿海,由汕头大学丁兰平教授鉴定,保存在国家海洋局第三海洋研究所藻类种质资源库内。
1.2 试剂及仪器
氨基酸混合标准品(Sigma),PITC(异硫氰酸苯酯,Sigma),乙腈、正己烷、甲醇等均为色谱纯,HCl(优级纯),其他试剂均为分析纯。
主要仪器:高效液相色谱仪(日本岛津,LC-20A),半制备高效液相色谱仪(日本岛津,LC-8A),核磁共振仪(美国Bruker,Metcurty-400),红外光谱仪(美国Bruker,VERTEX 70),高分辨质谱仪(美国Waters,LCT Premier XE)。
1.3 铜藻游离氨基酸的分离
取一定量粉碎的铜藻藻粉用75%的乙醇(料液比为1∶5)浸泡24 h,然后40 ℃超声提取30 min,共三次。旋蒸浓缩至无乙醇(40 ℃下),将水相用乙酸乙酯(水相∶乙酸乙酯为1∶1~5)萃取三次,留水相。将水相浓缩至一定体积,过阳离子交换树脂,接3 mol/L 氨水洗脱液,浓缩至干,用0.1 mol/L 的HCl定容,待检测分析。
1.4 PITC-HPLC 柱前衍生反相高效液相色谱法检测[5]
1.4.1 色谱条件
色谱柱:Inertsil ODS-SP C18(5 μm,250 mm ×4.6 mm);柱温38 ℃;SPD-M20A 检测器,检测波长254 nm;进样量10 μL 。流动相A:0.1 mol/L 醋酸钠(用冰乙酸调pH 为6.5)-乙腈(体积比为97∶3)的溶液;流动相B:乙腈-水(体积比为4∶1)的溶液。线性洗脱程序:0.0 min,0%B;13 min,7%B;23 min,23%B;29 min,35%B;35 min,40%B;40 min,100%B;45 min,100%B;47 min,0%B。流速为1.0 mL/min。
A 的配制:3 g 醋酸钠溶解在370 mL 水中,用冰乙酸调pH 至6.5,加入28 mL 乙腈,用0.45 μm 的滤膜过滤。
1.4.2 对照品混合溶液和样品的衍生
取对照品混合溶液或样品200 μL 置于离心管中,加入0. 1 mol/L PITC -乙腈溶液100 μL,1. 0 mol/L 三乙胺-乙腈溶液100 μL,混匀,室温下放置1 h 后加入400 μL 正己烷,漩涡混合器振荡1 min,静置10 min。用移液器吸取下层溶液,经0.22 μm 滤膜过滤后进样进行色谱分析。
PITC-乙腈溶液:36 μL PITC 和2.164 mL 乙腈混合。
三乙胺-乙腈溶液:417 μL 三乙胺和2.583 mL乙腈混合。
1.5 未知组分的制备分离
为确定检测到的未知组分的结构,采用半制备型高效液相色谱仪对衍生后的游离氨基酸粗提物进行制备分离。收集到的目标产物浓缩后经不加醋酸钠的流动相再次分离除去盐后经旋蒸除去有机溶剂,再进行冷冻干燥,收集样品待结构鉴定。
色谱柱:Shim-Pack PRC-ODS(20 × 250 cm);SPD-20A 检测器,检测波长254 nm;进样量5 mL。流动相A:0.1 mol/L 醋酸钠(用冰乙酸调pH 值为6.5)-乙腈(97∶3,v/v)的溶液;流动相B:乙腈-水(4∶1,v/v)的溶液。线性洗脱程序:0.0 min,0%B;13 min,7% B;23 min,23% B;29 min,35% B;35 min,40%B;40 min,100%B;45 min,100%B;47 min,0%B。流速为18 mL/min。
1.6 未知组分的结构鉴定
将制备分离到的高纯化合物样品分别进行核磁共振波谱(400 M)、高分辨质谱、红外光谱分析以确定其结构。
2 结果与分析
2.1 铜藻游离氨基酸的分离
铜藻粉末先经乙醇超声提取,再经乙酸乙酯萃取,最后经阳离子交换树脂层析除去大量的蛋白质、脂质、多糖等,所收集的3 mol/L 氨水组分经茚三酮乙醇溶液显色反应后发现,其含有高浓度的氨基酸组分,随后并进行了PITC-HPLC 法检测分析。此分离方法运用有机溶剂和超生萃取相结合的方式,减少了提取时间,且增加了提取效果。
2.2 PITC-HPLC 法检测分析
2.2.1 线性关系分析
分别取100,50,25,10,5 μL 的对照品混合氨基酸标准溶液,使其按照上述方法进行衍生,以各种氨基酸峰面积Y 为纵坐标,氨基酸实际摩尔浓度X 为横坐标,进行线性回归分析。结果表明17 种氨基酸在0.078~1.25 mol/L 与峰面积比具有良好的线性关系。氨基酸混合标准品液相色谱图和得到的每种氨基酸的线性回归方程分别见图1 和表1。

图1 17 种混合氨基酸标准品液相色谱图Fig.1 Chromatogram of the mixed standard samples by PITC-HPLC
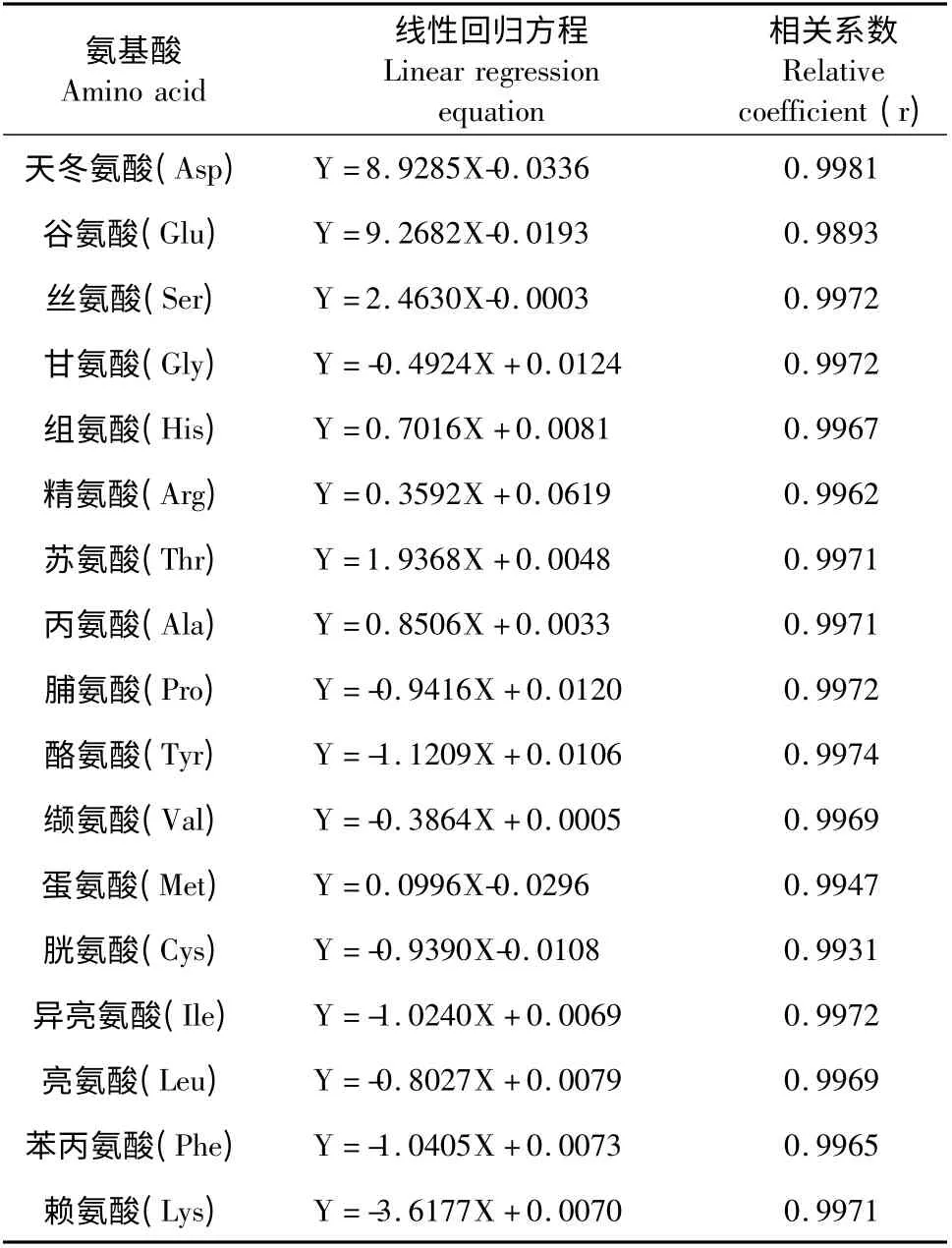
表1 17 种氨基酸的线性回归方程Table 1 The linear regression equations of 17 kinds of amino acids
2.2.2 方法的精密度、重复性及稳定性试验
取对照品溶液200 μL 按照上述方法衍生后连续进样5 次,以色谱峰峰面积为指标计算RSD,考察其精密度,17 种氨基酸标准溶液的精密度试验RSD在0.20%2.49% (n =5),均在允许范围内;取对照品溶液200 μL 按照上述方法衍生后分别在0、4、8、12、24、48、56 h 进样,以色谱峰峰面积为指标计算RSD,考察其稳定性,17 种氨基酸标准溶液的稳定性试验RSD 在0.28%~1.31%(n =7),均在允许范围内;取同一批铜藻样品5 份,按上述方法提取、衍生、测定,以色谱峰峰面积为指标分别计算RSD,考察方法的重复性,铜藻所含各种氨基酸峰面积的RSD 在0.70%~2.23%,同样均在允许范围内。
2.2.3 回收率试验
吸取已知含量的铜藻样品100 μL,准确加入氨基酸混标100 μL,按照上述方法分别衍生、进样,外标法定量,如此平行5 次,计算各氨基酸的回收率和相对标准偏差,平均回收率在78.50%~101.82%,相对标准偏差在0.51%~3.45%,均在允许范围内。
2.2.4 PITC-HPLC 检测结果
通过与17 种混合标准品液相色谱图比较分析发现铜藻样品中除了蛋氨酸、胱氨酸外包含15 种其他常见蛋白质氨基酸及3 种未知组分,且含量较高的常见蛋白质氨基酸为丙氨酸、脯氨酸、缬氨酸。3种未知组分的衍生物分别为MWZ1(6. 3 min)、MWZ2(12.9 min)、MWZ3(26.6 min),见图2。
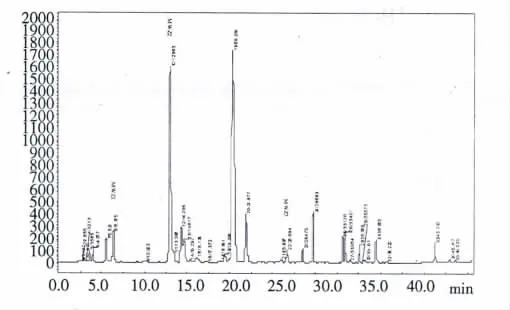
图2 铜藻样品液相色谱图Fig.2 Chromatogram of Sargassum horneri (Turn..)Ag. sample by PITC-HPLC
2.3 制备分离
由于3 种未知组分衍生物中MWZ1、MWZ3 的含量过低而未进行制备分离,最终采用半制备高效液相色谱系统制备分离到1 种未知衍生组分MWZ2,其制备分离HPLC 色谱图分别如图3,MWZ2 的出峰时间为10.6 min。收集未知组分经无盐流动相除盐后旋转蒸发除去有机溶剂,再经真空冷冻干燥后MWZ2 为略黄固体粉末。

图3 MWZ2(10.6 min)的HPLC 制备分离图Fig.3 Separation of MWZ2(10.6 min)by PITC-HPLC
2.4 结构鉴定
分离获得的MWZ2 是衍生剂异硫氰酸苯酯(PITC)与铜藻样品某一组分通过衍生反应生成的衍生物,其反应方程式如下。

MWZ2 为黄色固体粉末,IR (KBr)υ (cm-1):3436 (NH2),3292 (COOH),1564,1413,805 (Ph),1022 (C = S);TOF-MS-ESI m/z(%):226.2804[M+H]+;1H-NMR (400 MHz,MeOD)δ:7.48~6.96(m,5H),4.91 (m,1H),2.94 (m,2H);13C NMR(100 MHz,MeOD)δ:176.0,130.4,129.6,126.5,125.1,57.8,39.2。结合核磁共振波谱、高分辨质谱、红外光谱数据,最终推测MWZ 去掉已知取代基团PITC 后的成分为β-丙氨酸,它的分子式为C3H7NO2,分子量为89.09,其分子结构式如图4。

图4 β-丙氨酸Fig.4 β-Alanine
3 讨论
目前,用于氨基酸分离纯化的方法有沉淀法、膜分离法、萃取法以及离子交换法等,其中以离子交换法应用最为广泛。该法根据氨基酸是两性电解质这一特性,以及目的氨基酸与杂质氨基酸pK、pI 值的差异,利用离子交换树脂对各种氨基酸吸附能力的不同进行分离纯化[6]。本实验采用Dowex 50W-X8型阳离子交换树脂对铜藻游离氨基酸粗提样品进行分离,收集高浓度氨水洗脱液,经检测发现分离效果较好,含有多种氨基酸组分。
近些年来,随着氨基酸的广泛应用,用液相色谱法检测氨基酸的分析水平也不断提高,柱前衍生是先将氨基酸转化成衍生物,再进行色谱分离的一种衍生方法,操作简便、快速,灵敏度高,并在短时间内能分离20 多种氨基酸,针对各种衍生剂的研究与开发,目前应用广泛的方法有异硫氰酸苯酯(PITC)法,邻苯二甲醛-巯基乙醇(OPA)法,6-氨基喹啉基-N-羟基-琥珀酰亚胺基甲酸酯(AQC)法等[7]。PITCHPLC 法与其它柱前衍生法相比,其衍生过程简便,衍生物齐全,而衍生物的高灵敏度、高稳定性,使各种氨基酸含量的检测结果更加准确可靠,不失为一种快速、准确、经济的方法[8],可广泛应用于海洋藻类中非蛋白质氨基酸的检测分析研究。但由于本实验所用的氨基酸标准品(Sigma)仅为17 种常见蛋白氨基酸混合品,缺乏20 种常见氨基酸中的天冬酰胺、谷氨酰胺、色氨酸,并不能判定另外两种未知组分就一定是非蛋白质氨基酸,另还需考虑寡肽等的可能性,具体需进一步分离纯化来确定,但因含量过低而未进行。
本研究从铜藻中发现β-丙氨酸组分并鉴定了其结构,它是自然界中唯一存在的β 型氨基酸[9],其氨基位于碳链的β 位,与它常见的类似物左旋α-丙氨酸不同,它没有手性中心。β-丙氨酸是一种重要的非蛋白质氨基酸,在生物体内,β-丙氨酸并不参与蛋白质或酶的合成,通常它由二氢尿嘧啶和肌肽的降解产生。β-丙氨酸也是自发生成的缩氨酸肌肽和维生素B5 的重要组分,在正常状态下,β-丙氨酸被最终代谢为乙酸。β-丙氨酸是肌肽少有的几个前体物质之一。已经证实,补充β-丙氨酸有助于提升肌肉组织内肌肽的含量,从而消除运动员疲劳,提升肌肉活动能力,但如果β-丙氨酸摄入量(以溶液或胶囊服用)超过10 mg 每千克体重,将诱发机体感觉异常[10]。铜藻资源丰富,我们的研究为更好的利用此藻提供了新的方向。
1 Li Y(李英),Wang X(王霞),Yang F(杨帆). Studies on the function and application of non-protein amino acids. J Shanghai Institute of Technology(上海应用技术学院学报),2003,3:194-98.
2 Cao WG(曹稳根),Li WH(李卫华),Ye ZJ(叶子坚).非蛋白质氨基酸的生物合成及其生物学作用. Amino Acids& Biotic Resources(氨基酸和生物资源),1995,17(2):47-49.
3 Yan AX(闫爱新),Tian GL(田桂玲),Ye WH(叶蕴华).Progress in modification of bioactive peptides with non -protein amino acids and their application in the studies of structure -activity relationship.Chin J Chem(有机化学),2000,20:299-305.
4 Yuan QX(袁清香),Fu L(付玲). Study on the Chemical Constituents of Brown Alga Sargassu Horneri. Guangdong Chem Industry (广东化工),2007,33(5):42-43.
5 Liu LM(刘丽敏),Wang HM(王海敏),Yu HX(虞海霞),et al.柱前衍生反相高效液相色谱法测定西洋参中游离氨基酸.Chin Tradit Pat Med(中成药),2009,31:275-278.
6 Wu CL(武彩莲),Guo CJ(郭长江).Separation and purification of amino acids by ion exchange.Amino Acids & Biotic Resources(氨基酸和生物资源),2005,27(4):50-53.
7 Liang WQ(梁卫青),Wei QM(魏克民),Pu JB(浦锦宝),et al. Determination of amino acids in silkworm extract by high performance liquid chromatography with precolumn derivatization.J Med Res(医学研究杂志),2008,37(8):42-45.
8 Lv YG(吕莹果),Zhang H(张晖),Meng XY(孟祥勇),et al.Methods for amino acid analysis and derivatization. Cereals & Oils(粮食与油脂),2009,(7):35-38.
9 Huang XM(黄秀敏),Zhang ZB(张正波),Hong M(洪敏)et al.Study on isolation and purification of beta-alanine by biosythesis.Amino Acids & Biotic Resources(氨基酸和生物资源),2008,30(3):46-50.
10 Coxon M,Chakauya E,Ottenhofteal H. Pantothenate biosynthes is in higher plants.Coenzymology,2005,33:74-76.
