红景天苷生物、化学和生物催化合成的分子理论及应用
2013-12-23崔晋龙付少彬王梦亮
崔晋龙,付少彬,王梦亮*
1山西大学应用化学研究所,太原030006;2 遵义医学院药学院,遵义563003
红景天苷(Salidroside)是红景天植物主要的活性成分之一,具有良好的抗氧化、抗辐射、抗疲劳、免疫调节等多种药理活性[1],是20 世纪60 年代逐步被重视的新型适应原性植物药[2]。近年来,人们将红景天苷应用于癌症[3]、神经系统疾病[4]、细胞衰老[5]、脑与心脏等器官缺氧与缺血[6]、认知障碍[7]、皮肤斑[8]、代谢调节[9]等多方面的治疗,拓展了其使用范围,使得红景天苷在化妆品、食品、保健品、药品等工业生产中被广泛使用,导致市场供应紧张,急需加快红景天苷合成方面的研究。
从国内外报道看,红景天苷的来源主要包括生物合成(植物栽培、组织培养、细胞培养、毛状根培养等)、化学合成、生物催化(酶催化)合成等三个方面,近几年,相关理论和实践都取得了重要进步,对开发高效、污染小的合成方法,缓解市场供应紧张,保护红景天物种等方面都具有重要意义。
1 生物合成来源的研究现状
红景天苷作为红景天植物的次生代谢产物,含量介于0.10%~1.70%之间。为了提高植物含量,人们主要对其生物合成途径、关键酶及基因、栽培条件等进行了研究。
1.1 生物合成途径及关键酶基因的研究
合成途径和关键酶的研究是基础理论问题。红景天苷在植物体内是以酪醇和尿苷二磷酸葡萄糖(UDPG)为底物,由糖苷酶催化合成的。其中的关键问题之一是酪醇的合成,酪醇属于酚类化合物,在植物体中,它通过莽草酸途径合成[10]。在红景天植物中,对莽草酸合成酪醇已进行了深入的证明和探讨(见图1),人们根据化合物的变化规律及相关代谢关键酶基因表达的研究,生物合成机理获得了很多证据。Ma 等对高山红景天植物内源性苯丙氨酸解氨酶基因进行过量表达,使p-香豆素大量积累,但结果表明酪醇不能大量合成[11]。Zhang 等对酪氨酸脱羧酶过量表达,结果表明酪醇和红景天苷含量提高达274%和412%,说明酪氨酸脱羧酶(RsTyrDC)能够调控酪醇及红景天苷的合成[12]。以上研究表明,酪醇源于酪氨酸,否定了源于苯丙氨酸代谢途径的可能[13]。而高小东通过对高山红景天苯丙氨酸解氨酶基因的克隆及转化,证实了酪醇来源于苯丙氨酸的可能性[14]。Keski-Saaris 和Hu 分别证明2-氨基茚满-2-磷酸(2-Aminoindan-2-phosphonic acid,AIP)的存在能够抑制苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)的活性,而后者是苯丙素苷类代谢途径中的主要酶,结果导致酚类化合物、苯乙醇苷类物质的浓度降低,红景天苷积累严重受挫[15,16]。这证明了代谢途径的正确性及PAL 的重要性。因此,张祖荣认为,酪醇在生物体内的合成具有多种可能性,它是随着植物种类及组织、不同环境及时空条件下出现不同的表达差异[17]。
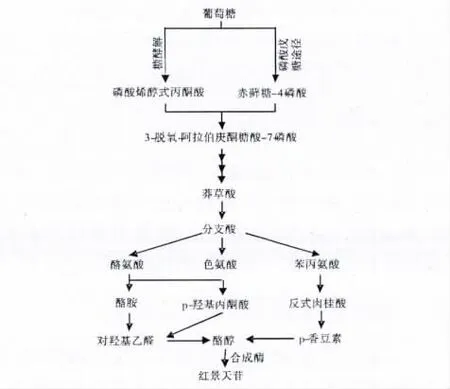
图1 红景天苷生物合成的可能途径Fig.1 The possible biosynthetic pathway for salidroside
由酪醇合成红景天苷,主要是UDP-葡萄糖基转移酶(UDP-glucosyltransferase,UDPGT,UGTS)和β-D-葡萄糖苷水解酶(UDP-glycosidase hydrolysis enzyme,UDPGH)二种酶起作用。Ma 等通过分子克隆法,过量表达UGTS,红景天苷的合成率得到明显提高[18]。Yu 等采用基因工程的方法对高山红景天的二个UGTS 基因进行研究,结果表明,含UGT72B14和UGT74R1 基因表达的细胞能够得到高于对照420%和50%的红景天苷,前者主要在根中大量表达,后者主要在愈伤组织细胞中大量表达,相比于后者,前者在体外和体内都表现出很高的活性[19]。这些研究表明,在不同组织、不同时空条件下,UDTS和UDPGH 都可表现出不同的催化能力,同一种酶在不同组织中具有表达的多基因性。
1.2 生物合成提高产量的实践现状
以生物合成途径和关键酶催化理论为基础,学者通过对植物的栽培与组织培养、毛状根培养、细胞培养等多种方式进行了提高红景天苷产量的研究。在研究手段上主要采用了改变环境条件、饲喂代谢中间物、生物诱导等。György 等证实通过在培养基中增加葡萄糖、蔗糖等物质,可以增加大花红景天组织培养中糖苷类物质的含量[20];Weglarz 等综合介绍了影响红景天苷积累的内外部因素,认为红景天苷含量与植物年龄无相关性、高海拔植物的红景天苷含量高于低海拔、红景天苷积累的最适温度是20℃,而50~60 ℃会使其含量降低等[21]。Zhou 等采用转基因高山红景天毛状根为材料,添加酪醇,酪氨酸和苯丙氨酸三种前体物质、黑曲霉(Aspergillus niger),彩绒革盖菌(Coriolus versicolor),紫灵芝(Ganoderma lucidum)三种诱导子来增加红景天苷的积累,发现优化条件下的前体和诱导子浓度分别是1 mmol/L 和0.05 mg/L[22]。李熙英等采用4 种丛枝菌根菌与1 年生高山红景天共培养,发现摩西球囊霉(Glomus mosscac)和根内球囊霉(Glomus intraradices)对红景天生长有明显促进作用[23]。总之,通过转基因、大规模细胞培养等手段进行红景天苷的生物合成,仍然是重要的研究方向。
2 化学方法的合成
化学方法成本低、速度快,是工业化生产红景天苷的良好方向。主要理论依据是Koenigs-Knorr法[24],这种方法是以酪醇类似物为底物,以重金属盐为主要催化剂进行糖苷化反应。它起始于1969年,但主要对近几年的研究情况进行总结。从文献报道看,近几年国外报道很少,表1 是我国学者进行化学合成的基本情况表。
3 生物催化(酶)法合成红景天苷
此法是基于酶催化理论,以酪醇和葡萄糖类似物为底物,采用生物酶或全细胞(微生物个体或细胞)催化合成红景天苷的方法。其基本原理见图2。

?
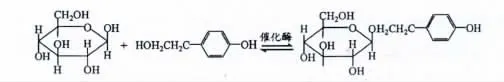
图2 D-葡萄糖与酪醇合成红景天苷的反应Fig.2 Glycosidase-catalysed synthesis of salidroside from Dglucose and tyrosol
3.1 糖苷酶催化理论
生物体内糖苷化合物多是由糖苷转移酶催化合成,它能特异性的催化糖基从活性中间体(如UDP 衍生物)转移到目标产物分子上。糖基转移酶只负责糖基的转移,不会导致底物和产物水解。按照糖基化反应中底物及产物立体化学结构的不同,糖基转移酶分为保持型和翻转型。保持型糖基转移酶的催化反应,需要完成两步取代反应,第一步是产生糖基-酶中间复合物,接着受体再完成第二步取代反应。翻转型酶催化的反应要通过一个氧络正碳离子-离子样的过渡状态,受体对供体C1进行亲核攻击完成简单取代反应,见图3-A[31]。部分学者认为[18],红景天苷以尿苷二磷酸葡萄糖为葡萄糖基供体,以酪醇为受体分子催化合成红景天苷。
也有学者认为,β-D-葡萄糖苷酶是红景天苷合成的关键酶。糖苷水解酶类具有水解酶和糖基转移酶双重活性[32],水解酶活性使红景天苷分解为酪醇和葡萄糖,转移酶活性使得糖基结合到苷元上去。毛多斌认为[33],糖苷酶发挥逆水解反应活性,是以葡萄糖为亲核底物(糖、醇),直接缩合成红景天苷,并产生水,见图3-B。以供糖基物质和亲核物质(糖、醇)为底物时,酶催化糖基转移反应(图3-C)是糖苷酶把糖基供体上的糖基转移到受体亲核物质上的过程,大多数糖苷酶都催化这种反应。在转糖基化反应过程中,糖基供体在转化的同时会发生水解,糖苷生成(b 途径)的同时也会发生水解(a 途径)。这两种活性在不同生物体及不同的时空条件下表现出不同的能力。在红景天苷合成中,是其中一种还是两种活性都发挥作用?还是在不同反应条件下,活性表现的强弱不同,现在尚不清楚[34]。
3.2 生物催化合成红景天苷的研究现状
近年来,人们主要从天然植物种子材料、真菌中提取酶或将全细胞用于催化合成试验,手段上采用了固体或液体发酵、工业反应转化等。Zhang 等从大量培养A.niger 中提取并纯化酶,催化1.5%的酪醇和6%的葡萄糖合成产率为10%的红景天苷[35]。贾艳萍等从犁头霉属(Absidia sp.)中提取粗酶液,得到了用酪醇和葡萄糖催化合成红景天苷的优化条件[36]。Yu 等用戊二醛交联苹果籽粉做成多孔网状固定化酶,以叔丁醇为介质,采用高效、环境友好的方法催化合成红景天苷,产率为1.9 g/L·d,产品纯度达99.3%[37]。高雪华采用固体和液体发酵法从A.niger H35 和H42 中提取合成红景天苷的合成酶系,通过酶促反应使红景天苷的含量提高了194.2%,并获得高产的最适反应条件[38]。Kurashima 等从杏仁粗粉中提取β-葡萄糖苷酶,以叔丁醇-水混合溶液为反应介质,合成了一系列红景天苷类似物,产率在11%~22%之间[39]。宋伟舟采用上述二株菌进行双株协调发酵,在最佳条件下,红景天苷产量能提高86. 28%,总有效成分含量提高94.68%,证明双株优于单株菌的转化效果[40]。王梦亮课题组在多方面进行了生物催化合成红景天苷的试验,发现以微生物全细胞、β-葡萄糖苷酶都能催化合成红景天苷,非水相、离子液体等介质中有利于发挥酶活性,将酶固定化后能够达到提高产量的目的[41-44]。总之,近几年,采用生物催化方法合成红景天苷已经成为科研工作者重视的研究方向。
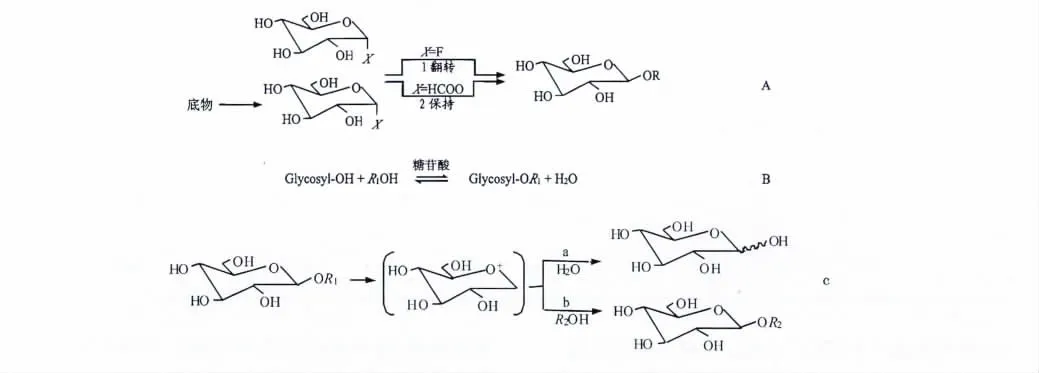
图3 生物催化合成红景天苷的关键酶催化机理Fig.3 Catalytic mechanism of key enzymes in biocatalytic synthesis of salidroside
4 展望
全球红景天植物共92 种,我国分布72 种,是主要的分布和生产国,也是我国藏族人民使用一千多年的传统药物,称为“高原人参”[45]。其主要活性成分红景天苷所拥有的良好适应原药性,受到高山作业、深海作业、运动员等特殊行业人员的青睐。近几年,随着科学不断发展,人们以红景天苷生物代谢途径和关键酶理论为基础,结合化学催化理论,进行了多方面的合成研究。三大类提高红景天苷产量的合成方法各具优缺点。生物合成是最基础的方法,对研究代谢途径、阐明合成关键酶等理论至关重要,但是,红景天苷作为植物次生代谢产物,提高幅度有限,生产周期长,土地浪费严重;化学合成法具有快速、经济的优点,但需要多步的保护与去保护步骤,其中的重金属催化剂具有污染环境、威胁健康等缺点;生物催化法是有前途的方法,具有反应条件温和、高效、污染小等优点,但目前仍没有获得廉价、稳定、高效的实用酶,还需要极其昂贵的UDPG 作为辅助底物,使成本过高[32]。
关于红景天苷的高效合成仍需进行理论和实践的进一步深入研究,开展代谢途径与关键酶的功能与调控、酶催化机理等多方面的广泛与精细化研究,结合化学材料、代谢组学、工程学等领域新出现的方法技术,实现这一天然产物的高效合成,具有重要意义。
1 Arora R,et al. Evaluation of radio protective activities of Rhodiola imbricata Edgew-A high altitude plant . Mol Cell Biochem,2005,273:209-223.
2 Khanum F,et al.Rhodiola rosea:a versatile adaptogen.Compr Rev Food Sci F,2005,4:55-62.
3 Hu XL,et al.Salidroside induces cell-cycle arrest and apoptosis in human breast cancer cells. Biochem Biophys Res Commun,2010,398:62-67.
4 Chen X,et al. Profective effects of salidroside on glutamate induced neurotoxicity in cultured hippocampal neurons. Cell Biol Int,2008,32:S1-S67.
5 Mao GX,et al. Salidroside protects human fibroblast cells from premature senescence induced by H2O2partly through modulating oxidative status. Mech Ageing Dev,2010,131:723-731.
6 Zhang JP,et al. Salidroside protects cardiomyocyte against hypoxia-induced death:A HIF-1α-activated and VEGF-mediated pathway.Eur J Pharmacol,2009,607:2-14.
7 Yang JH(杨江河),et al.Salidroside for hypobaric hypoxiainduced cognitive deficits in rats and its possible mechanism.Progr Moder Biomed(现代生物医学进展),2011,11:2026-2029.
8 Shen G(沈干),et al. Study of anti-skin photoaging by ginsenoside and salidroside. J Southeast Univ,Medical Sci Ed(东南大学学报:医学版),2010,29:336-339.
9 Zheng KYZ,et al.Salidroside stimulates the accumulation of HIF-1α protein resulted in the induction of EPO expression:A signaling via blocking the degradation pathway in kidney and liver cells.Eur J Pharmacol,2012,679:34-39.
10 Du LN(杜丽娜),et al.The synthetic way and biological significance of plant secondary metabolism. J Northwest Fore Univ(西北林学院学报),2005,20:150-155.
11 Ma LQ,et al. Effects of overexpression of endogenous phenylalanine ammonia-lyase(PALrs1)on accumulation of salidroside in Rhodiola sachalinensis.Plant Biol,2008,10:323-333.
12 Zhang JX,et al.A tyrosine decarboxylase catalyzes the initial reaction of the salidroside biosynthesis pathway in Rhodiola sachalinensis.Plant Cell Rep,2011,30:1443-1453.
13 Ma LQ(马兰青),et al.Salidroside biosynthesis pathway:the initial reaction and glycosylation of tyrosol. Chin J Biotecnol(生物工程学报),2012,28:282-294.
14 Gao XD(高小东). Cloning and genetic transformation of phenylalanine ammonia-lyase gene in Rhodiola Sachalinensis.Changchun:Jilin University(吉林大学),PhD.2006.
15 Keski-Saari S,et al. Phenolics during early development of Betula pubescens seedlings:inhibition of phenylalanine ammonia lyase.Tree,2007,21:263-272.
16 Hu GS,et al. Effects of 2-aminoindan-2-phosphonic acid treatment on the accumulation of salidroside and four phenylethanoid glycosides in suspension cell culture of Cistanche deserticola.Plant Cell Rep,2011,30:665-674.
17 Zhang ZR(张祖荣),Liao ZH(廖志华).Advances in studies on biosynthetic pathway and biotechnology of salidroside.Chin Tradit Herb Drugs(中草药),2012,41:1571-1574.
18 Ma LQ,et al.Molecular cloning and over expression of anovel UDP-glucosyltransferase elevating salidroside levelsin Rhodiolas achalinensis.Plant Cell Rep,2007,26:989-999.
19 Yu HS,et al.Characterization of glycosyltransferases responsible for salidroside biosynthesis in Rhodiola sachalinensis.Phytochemistry,2011,72:862-870.
20 György Z,et al. Enhanced biotransformation capacity of Rhodiola rosea callus cultures for glycoside production.Plant cell Tiss Org,2005,83:129-135.
21 Weglarz Z,et al. Roseroot(Rhodiola rosea L.):effect of internal and external factors on accumulation of biologically active compounds. Ramawat KG,Mérillon JM(eds.),In:Bioactive Molecules and Medicinal Plants,2008,297-315.
22 Zhou XF,et al.Salidroside production by hairy roots of Rhodiola sachalinensis obtained after transformation with Agrobacterium rhizogenes.Biol Pharm Bull,2007,30:439-442.
23 Li XY(李熙英),Huang SC(黄世臣). Effect of AM to growth of Annual Rholdiola sachalinensis.For Sci Techno(林业科技),2008,33(3):25-27.
24 Chen H(陈辉),et al..Synthesis of analogues of salidroside.J Third Mil Med Univ(第三军医大学学报),2012,34:1057-1061.
25 Xu DY(许大艳),Liu DY(刘大有). Synthesis of salidroside.J Changchun Univ Traditional Chin Med(长春中医药大学学报),2009,25:614-615.
26 Zhang SQ(张三奇),et al. A new approach to synthesis of salidroside.Chin J Med Chem(中国药物化学杂志),1997,7:256-273.
27 Zhang LJ(张莲姬),et al..Synthesis of salidroside.J Yanbian Univ(延边大学学报),2002,28:97-105.
28 Deng M(邓梅),et al..Synthesis of analogues of salidroside.J Fourth Mil Med Univ(第四军医大学学报),2007,28:1501-1502.
29 Li GQ(李国青),Li Z(李展). Study on a new synthesis of 2-(4-Hydroxyphenyl)ethyl β-D-glucopyranoside. Chin J Med Chem(中国药物化学杂志),1996,6(2):136-138.
30 Guo YB(郭益冰),et al.Synthesis of salidroside and its analogues.J Nantong Univ(南通大学学报),2009,8(4):29-35.
31 Mackenzie PI,et al.The UDP-glycosyltransferase gene superfamily:recommended nomenclature update based on evolutionary divergence.Pharmacogenetics,1997,7:255-69.
32 Yu HL(郁惠蕾),et al..Application of glycosidase to glycoside synthesis. Chin J Org Chem(有机化学),2006,26:1052-1058.
33 Mao DB(毛多斌),et al.Application of biocatalysis in glucoside synthesis.Chin Surf Deter & Cosme(日用化学工业),2007,37:321-326.
34 Shi LL(史玲玲),et al. Approaches on biosynthesis of salidroside and its key metabolic enzymes.Chin Bull Life Sci(生命科学),2008,20:287-290.
35 Zhang CZ,et al.Enzymic synthesis of salidroside:puri?cation and characterization of salidrosidase from Aspergillas niger.Process Biochem,2005,40:3143-3147.
36 Jia YP(贾艳萍),et al.Optimal condition of enzyme reaction for salidroside synthesis.J Dalian Institute Light Ind(大连轻工业学院学报),2004,23(2):97-99.
37 Yu HL,et al. Environmentally benign synthesis of natural glycosides using apple seed meal as green and robust biocatalyst.J Biotechnol,2008,133:469-477.
38 Gao XH(高雪华),et al..Research on increasing production of salidroside and tyrosol with microbial enzyme method.Lishizhen Med Mater Med Res(时珍国医国药),2011,22:2137-2140.
39 Kurashima K,et al.Simple synthesis of β-D-Glycopyranosides using β-Glycosidase from almonds.Chem Pharm Bull,2004,52:270-275.
40 Song WZ(宋伟舟),et al.Research on increasing production of salidroside and tyrosol by the coordination with two microbes.Lishizhen Med Mater Med Res(时珍国医国药),2010,21:156-159.
41 Wang ML(王梦亮),et al.Preliminary study on synthesis of salidroside through glucosylation of D-glucose and tyrosol catalyzed by microorganism. Chin J Catal(催化学报),2006,27:233-236.
42 Wang ML(王梦亮),et al.Study on the enzymatic synthesis of salidroside with β-Glucosidasen in nonaqueous medium. Nat Prod Res Dev(天然产物研究与开发),2008,20:1072-1074.
43 Wang ML(王梦亮),Li WL(李万利).Study on synthesis of salidroside using immobilization β-glucosidase.Biotechnology(生物技术),2009,19:68-70.
44 Wang ML(王梦亮),Guo CX(郭春侠).Biocatalytic synthesis of salidroside by β-glucosidase in ionic liquids. Chin J Catal(催化学报),2011,32:1051-1055.
45 Gu YL(谷燕莉),Chen YT(陈玉婷).Preliminary study of medicinal Rhodiola plant.Chin J Chin Mater Med(中国中药杂志),2004,29:929-930.
