罗格列酮对RAW 264.7 细胞源性泡沫细胞炎症反应及SOCS1 和SOCS3 表达的影响*
2013-12-23董吁钢董剑廷邓志华
李 飞, 袁 勇, 董吁钢, 董剑廷, 冯 力, 邓志华
(1中山市人民医院心血管内科,广东 中山528400;2中山大学附属第一医院心血管内科,广东 广州510080)
动脉粥样硬化(atherosclerosis,AS)是一种炎症性疾病[1]。其中促炎/抗炎细胞因子的平衡在AS 的形成以及粥样斑块的稳定中起着重要作用。细胞因子在动脉粥样硬化中的表达量高于在正常动脉中的表达,并且促炎细胞因子肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素6(interleukin-6,IL-6)含量高于抗炎细胞因子白细胞介素10(interleukin-10,IL-10)[2]。这些研究提示,促炎细胞因子信号的负向调控机制可能在抑制斑块的进展中起着重要作用。细胞因子信号抑制物(suppressors of cytokine signaling,SOCS)是一系列能够抑制细胞因子信号转导的蛋白。近来发现,SOCS 蛋白家族与AS有着密切关系。人的动脉粥样硬化斑块中巨噬细胞及血管平滑肌细胞中有SOCS1 及SOCS3 的高表达,且在斑块炎症活跃的肩部比纤维化区表达量要多。反义寡核苷酸技术靶向下调ApoE 基因敲除小鼠的SOCS3 基因表达,可通过增加斑块体积、白细胞募集及趋化因子表达,促进斑块的形成[3]。因此,以SOCS 蛋白为靶点,上调SOCS1 和SOCS3 的表达,减少促炎细胞因子的生成,可能成为防治AS 的新策略。过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPARs)属于核受体超家族转录因子。研究表明,PPARγ 的激活能够抑制动脉粥样硬化的形成[4]。然而PPARγ 活化对泡沫细胞SOCS 表达有何影响,尚缺乏充分研究,本研究旨在观察PPARγ 激动剂罗格列酮对RAW 264.7 细胞源性泡沫细胞促炎/抗炎反应以及SOCS1 和SOCS3表达的影响。
材 料 和 方 法
1 材料
小鼠单核-巨噬细胞株RAW 264.7 购自武汉大学中国典型培养物保藏中心。氧化型低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)购自中国医学科学院基础医学研究所生化所。罗格列酮购自Cayman。DMEM 培养基购自Gibco。新生小牛血清购自杭州四季青生物工程材料有限公司。脂多糖(lipopolysaccharide,LPS)购自广州威佳科技有限公司。TNF-α、IL-6 及IL-10 ELISA 试剂盒购自晶美生物工程有限公司(最低检测标准4 ng/L)。小鼠SOCS1 及SOCS3 单克隆抗体购自MBL。
2 细胞培养
RAW264. 7 细胞培养于含10% 小牛血清的DMEM 培养基中,培养条件为37 ℃、95%空气,5%CO2。每隔2 ~3 d 更换1 次培养液。取对数生长期细胞进行实验,实验前用倒置显微镜观察,形态良好,折光性强。细胞密度调至2 ×108/L,24 h 后换成含0.1%小牛血清的DMEM 培养基培养,次日更换1次培养液,加入ox-LDL(100 mg/L)培养24 h 后加入罗格列酮(20 μmol/L)。
3 RT-PCR 检测SOCS1 及SOCS3 mRNA 的表达
实验分组及分别在加入罗格列酮6 h、12 h、24 h后加入TRIzol Reagent 提取细胞总RNA,经紫外分光光度计检测纯度和浓度。符合要求的总RNA 用反转录试剂盒合成cDNA 第一链,以合成的cDNA 为模板,小鼠GAPDH 为内参照,小鼠SOCS1 及SOCS3上、下游引物行PCR 检测。引物由TaKaRa 公司合成,序列:SOCS1 正义链5’-AGTAGGATGGTAGCACGCAAC-3’,反义链5’-AAGGAACTCAGGTAGTCACGG-3’;SOCS3 正义链5’-ACTTCACGGCTGCCAACATC-3’,反义链5’-GGATGCGTAGGTTCTTGGTC-3’;GAPDH 正 义 链5’-TAGCCCAGGATGCCCTTTAGT-3’,反义链5’-CCCCCAATGTATCCGTTGTG-3’。反应体系为50 μL,反应条件:95 ℃5 min预变性,94 ℃30 s,退火(SOCS1:60 ℃;SOCS3:59℃;GAPDH:55 ℃)30 s,72 ℃1 min,40 个循环,72℃7 min。取PCR 扩增产物5 μL 行琼脂糖凝胶电泳分析,以GAPDH 作内参照,计算相对单位。
4 Western blotting 检测各组SOCS1 及SOCS3 蛋白质的水平
实验分组及分别在加入罗格列酮6 h、12 h、24 h后提取细胞总蛋白:弃去药物,用预泠的PBS 润洗细胞后,倒尽吸干PBS,加入RIPA 裂解液,冰上裂解30 min,刮下细胞,离心,取上清液于-80 ℃保存。提取细胞总蛋白后经Mini BCA 法定量。十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)和免疫印迹杂交:各取12 μL 提取液,100 ℃变性5 min,上样,电泳,转膜后封闭,加入Ⅰ抗(SOCS1 及SOCS3 抗体浓度1.5 mg/L)4 ℃过夜,洗膜,加入Ⅱ抗(0.5 g/L)于室温下作用2 h,洗膜后进行化学发光,显影。根据各条带密度的变化,判断SOCS1 及SOCS3 蛋白质的表达情况。
5 培养液中TNF-α、IL-6 及IL-10 浓度测定
实验分组及加入罗格列酮24 h 后,ELISA 法检测各组培养液中TNF-α、IL-6 及IL-10 的含量。操作步骤按试剂盒说明书进行测得各组的A 值。以标准品浓度和相应的A 值为参数,用SPSS 10.0 统计软件进行直线回归处理,得出相应的方程;把各标本的A值代入方程算出各标本中上述细胞因子的浓度。
6 统计学处理
结 果
1 罗格列酮对小鼠RAW 264.7 细胞源性泡沫细胞分泌TNF-α、IL-6 及IL-10 的影响
如表1 所示,ox-LDL(100 mg/L)组培养液中TNF-α、IL-6 及IL-10 的浓度均明显高于control 组(P <0.05)。而加入罗格列酮(20 μmol/L)24 h 后细胞培养液中TNF-α、IL-6 及IL-10 的浓度均明显低于ox-LDL 组(P <0.05)。
表1 各组培养液中TNF-α、IL-6 及IL-10 的浓度Table 1. The concentrations of TNF-α,IL-6 and IL-10 in supernatants in various groups (ng/L. ±s.n=6)

表1 各组培养液中TNF-α、IL-6 及IL-10 的浓度Table 1. The concentrations of TNF-α,IL-6 and IL-10 in supernatants in various groups (ng/L. ±s.n=6)
ROZ:rosiglitazone* P <0.05 vs control;#P <0.05 vs ox-LDL.
Group TNF-α IL-6 IL-10 Control 21.17±10.31 16.52±7.00 18.75±8.22 ox-LDL 152.22±49.20* 55.53±10.65* 48.63±10.37*ox-LDL+ROZ 38.32±17.98# 26.75±7.97# 30.16±8.71#
2 各组培养上清液TNF-α/IL-10 及IL-6/IL-10 比值变化
如表2 所示,ox-LDL 组TNF-α/IL-10 及IL-6/IL-10 的比值明显高于control 组。而加入罗格列酮24 h 后,TNF-α/IL-10 及IL-6/IL-10 的比值明显低于ox-LDL 组(P <0.05)。
表2 各组培养液中TNF-α/IL-10 和IL-6/IL-10 比值Table 2. TNF-α /IL-10 and IL-6/IL-10 ratios in supernatants in various groups (±s.n=6)

表2 各组培养液中TNF-α/IL-10 和IL-6/IL-10 比值Table 2. TNF-α /IL-10 and IL-6/IL-10 ratios in supernatants in various groups (±s.n=6)
ROZ:rosiglitazone. * P <0. 05 vs control;#P <0. 05 vs ox-LDL.
Group TNF-α/IL-10 IL-6/IL-10 Control 1.10 ±0.21 0.88 ±0.08 ox-LDL 3.07 ±0.40* 1.15 ±0.07*ox-LDL+ROZ 1.23 ±0.25# 0.89 ±0.06#
3 罗格列酮对RAW 264. 7 细胞源性泡沫细胞SOCS1 和SOCS3 mRNA 表达的影响
如图1、2 及表3 所示,control 组与ox-LDL 组只有少量SOCS1 和SOCS3 mRNA 的表达,且二者之间SOCS1 和SOCS3 mRNA 的表达无明显差别。而LPS(1 mg/L)作用于泡沫细胞6 h 及罗格列酮作用于泡沫细胞6 h、12 h 后SOCS1 和SOCS3 mRNA 表达均明显高于control 组与ox-LDL 组(P <0.05),24 h 后SOCS1 和SOCS3 mRNA 的表达与control 组及ox-LDL 组无明显差异(P >0.05)。
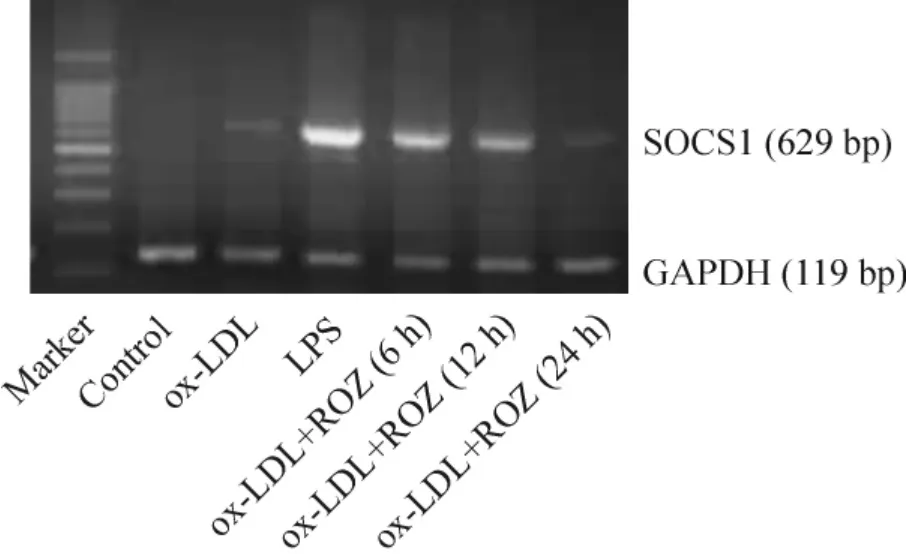
Figure 1. SOCS1 mRNA expression in foam cells in different groups detected by RT-PCR. Foam cells were treated with 100 mg/L ox-LDL or 1 mg/L LPS for 6 h,or 20 μmol/L rosiglitazone (ROZ)for 6 h,12 h or 24 h.图1 各组泡沫细胞SOCS1 mRNA 的表达

Figure 2. SOCS3 mRNA expressions in foam cells in different groups detected by RT-PCR. Foam cells were treated with 100 mg/L ox-LDL or 1 mg/L LPS for 6 h or 20 μmol/L rosiglitaqzone (ROZ)for 6 h,12 h or 24 h.图2 各组泡沫细胞SOCS3 mRNA 的表达
表3 各组泡沫细胞SOCS1 和SOCS3 mRNA 的表达Table 3. SOCS1 and SOCS3 mRNA expression in foam cells in different groups (±s.n=3)

表3 各组泡沫细胞SOCS1 和SOCS3 mRNA 的表达Table 3. SOCS1 and SOCS3 mRNA expression in foam cells in different groups (±s.n=3)
The levels of mRNA were expressed as ratios to GAPDH.ROZ:rosiglitazone. * P <0.05 vs control or ox-LDL.
Group SOCS1 SOCS3 Control 0.18 ±0.03 0.15 ±0.03 ox-LDL 0.30 ±0.04 0.34 ±0.06 LPS 2.95 ±0.34* 1.57 ±0.21*ox-LDL+ROZ(6 h) 2.41 ±0.25* 2.90 ±0.32*ox-LDL+ROZ(12 h) 1.60 ±0.27* 2.42 ±0.37*ox-LDL+ROZ(24 h)0.21 ±0.06 0.44 ±0.15
4 Western blotting 法观察RAW264.7 源性泡沫细胞SOCS1 和SOCS3 蛋白的表达
如图3、4 及表4 所示,control 组与ox-LDL 组只有少量SOCS1 和SOCS3 蛋白的表达,且两组之间无明显差别。LPS 作用于泡沫细胞6 h 及罗格列酮作用于泡沫细胞6 h、12 h、24 h 后SOCS1 和SOCS3 蛋白的表达均明显高于control 组与ox-LDL 组(P <0.05)。

Figure 3. SOCS1 protein expression in foam cells in different groups detected by Western blotting. Foam cells were treated with 1 mg/L LPS or 100 mg/L ox-LDL for 6 h,or 20 μmol/L rosiglitazone for 6 h,12 h or 24 h.1:control;2:LPS;3 ~5:ox-LDL+rosiglitazone for 6 h,12 h and 24 h;6:ox-LDL.图3 各组泡沫细胞SOCS1 蛋白的表达
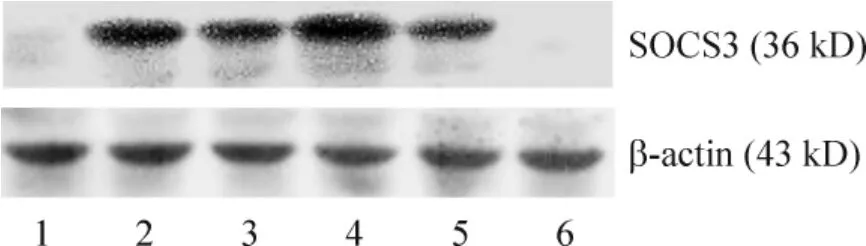
Figure 4. SOCS3 protein expressions in foam cells in different groups.1:control;2:LPS;3 ~5:ox-LDL+ rosiglitazone for 6 h,12 h and 24 h;6:ox-LDL.图4 各组泡沫细胞SOCS3 蛋白的表达
表4 各组泡沫细胞SOCS1 和SOCS3 蛋白的表达Table 4. SOCS1 and SOCS3 protein expression in foam cells in different groups (±s.n=3)

表4 各组泡沫细胞SOCS1 和SOCS3 蛋白的表达Table 4. SOCS1 and SOCS3 protein expression in foam cells in different groups (±s.n=3)
The levels of proteins were expressed as ratios to β-actin.ROZ:rosiglitazone. * P <0.05 vs control or ox-LDL.
Group SOCS1 SOCS3 Control 0.18 ±0.06 0.15 ±0.06 ox-LDL 0.18 ±0.04 0.09 ±0.05 LPS 1.39 ±0.20* 1.68 ±0.24*ox-LDL+ROZ(6 h) 0.63 ±0.11* 1.20 ±0.13*ox-LDL+ROZ(12 h) 1.40 ±0.18* 1.89 ±0.18*ox-LDL+ROZ(24 h) 0.56 ±0.12* 0.85 ±0.18*
讨 论
细胞因子在动脉粥样硬化的形成中起着重要的调节作用。动脉粥样硬化患者血清中TNF-α 的浓度比健康对照者明显增高[5]。血清IL-6 水平可以预测急性冠脉综合征病人30 天内甚至1 年内发生心血管事件的风险[6]。因此,TNF-α 与IL-6 是预测急性冠状动脉综合征的早期基础病变及严重并发症的指标。Sumiyoshi 等[7]的研究表明,冠状动脉粥样斑块内的IL-10 主要由巨噬细胞表达,随着斑块的进展,IL-10 阳性细胞的数量增加,且与oxLDL 的沉积呈正相关。在不稳定型心绞痛病人中,外源性加入IL-10明显抑制外周血单核细胞TNF-α 的释放,虽然IL-10的浓度在急性冠脉综合征患者中既可不变亦可下降,但其与促炎因子的比值总是下降的[8]。以上研究提示,促炎与抑炎间的失衡可能导致了急性冠脉综合征的发生。而IL-10 作为一个有效的抗炎细胞因子,在调节促炎/抗炎平衡、抑制AS 形成中可能起着重要作用。
PPARγ 激动剂对炎症反应的抑制作用已被大量研究证实。研究表明,PPARγ 配体吡格列酮减少了糖尿病大鼠循环中TNF-α 及IL-6 的生成[9]。本研究结果表明,小鼠RAW 264.7 细胞源性泡沫细胞在ox-LDL 刺激下分泌TNF-α、IL-6 及IL-10 明显增多,而罗格列酮抑制了ox-LDL 诱导的泡沫细胞TNF-α、IL-6 及IL-10 的分泌。这提示ox-LDL 诱导的泡沫细胞启动了促炎反应的同时,可能有抗炎反应负反馈机制的激活,导致抗炎细胞因子IL-10 的生成增多。而加入罗格列酮后因为有效抑制了泡沫细胞的促炎反应,其负反馈机制也相应减弱,导致IL-10 的生成减少。本研究同时观察到,小鼠ox-LDL 诱导的RAW 264.7 细胞源性泡沫细胞TNF-α/IL-10 及IL-6/IL-10比值也明显增高,而罗格列酮明显降低这2 个比值,提示罗格列酮可能通过负反馈机制调节了促炎/抗炎反应的平衡。
负向调控细胞因子信号的SOCS 蛋白家族与促炎/抗炎反应的平衡以及AS 的形成有着密切关系。Rastmanesh 等[10]的研究表明,终末期肾功能不全患者血中TNF-α、IL-6 及CRP 含量明显增高,同时伴随有单核细胞及淋巴细胞SOCS1 的表达增多。SOCS3能够抑制NF-κB 及MAPK 介导的TNF-α 信号转导途径及JAK-STAT 介导的IL-6 信号转导途径[11]。T淋巴细胞SOCS3 缺失促进了IL-10 及IL-17 的生成,促使巨噬细胞表现出抗炎症反应的表型,并以IL-17依赖的方式抑制了粥样斑块及血管炎症的进行[12]。Yu 等[13]研究大鼠胰腺炎模型发现,PPARγ 配体曲格列酮通过诱导SOCS3 表达,抑制JAK2/STAT3 信号转导途径,并进一步抑制IL-6 的表达。
罗格列酮调节以上促炎/抗炎反应平衡的机制与SOCS 蛋白的表达是否有关,尚不完全清楚。Park等[14]研究表明,PPARγ 激动剂通过非PPARγ 依赖的途径诱导了大鼠神经胶质细胞SOCS1 和SOCS3的表达,从而抑制了JAK-STAT 炎症信号途径。而与之相反,Lebrun 等[15]的研究表明,PPARγ 配体吡格列酮通过抑制肝脏SOCS3 的表达,抑制了肝脏的炎症反应及胰岛素抵抗。本研究发现,小鼠RAW 264.7 细胞源性泡沫细胞只有很少SOCS1 和SOCS3 表达,而罗格列酮明显上调RAW 264.7 细胞源性泡沫细胞SOCS1 和SOCS3 的表达。此结果与Park 等[14]的研究相似,提示罗格列酮可能通过PPARγ 依赖的途径同时上调SOCS1 及SOCS3 的表达,调节促炎/抗炎反应的平衡。
总之,本研究结果表明,罗格列酮上调泡沫细胞SOCS1 和SOCS3 表达的同时,抑制了泡沫细胞分泌TNF-α、IL-6 及IL-10,调节了泡沫细胞促炎/抗炎反应的平衡,但尚未揭示出罗格列酮是否直接通过上调SOCS1 和SOCS3 的表达调节了促炎/抗炎反应的平衡,需要通过基因敲除或RNA 干扰技术进一步去验证。
[1] Ross R. Atherosclerosis-an inflammatory disease[J]. N Engl J Med,1999,340(2):115-126.
[2] Hansson GK,Robertson AK,Söderberg-Nauclér C. Inflammation and atherosclerosis[J]. Annu Rev Pathol,2006,1:297-329.
[3] Ortiz-Munoz G,Martin-Ventura JL,Hernandez-Vargas P,et al. Suppressors of cytokine signaling modulate JAK/STAT-mediated cell responses during atherosclerosis[J].Arterioscler Thromb Vasc Biol,2009,29(4):525-531.
[4] Chen Z,Ishibashi S,Perrey S,et al. Troglitazone inhibits atherosclerosis in apolipoprotein E-knockout mice:pleiotropic effects on CD36 expression and HDL[J]. Arterioscler Thromb Vasc Biol,2001,21(3):372-377.
[5] 胡启程,孙文悦. 动脉粥样硬化患者血清肿瘤坏死因子的改变及氨氯地平对其影响[J]. 中国实用医药,2008,3(2):15-16.
[6] Lee KW,Lip GY,Tayebjee M,et al. Circulating endothelial cells,von Willebrand factor,interleukin-6,and prognosis in patients with acute coronary syndromes[J]. Blood,2005,105(2):526-532.
[7] Sumiyoshi S,Nakashima Y,Chen YX,et al.Interleukin-10 expression is positively correlated with oxidized LDL deposition and inversely with T-lymphocyte infiltration in atherosclerotic intimas of human coronary arteries[J].Pathol Res Pract,2006,202(3):141-150.
[8] Waehre T,Halvorsen B,Damas JK,et al. Inflammatory imbalance between IL-10 and TNFα in unstable angina potential plaque stabilizing effects of IL-10[J]. Eur J Clin Invest,2002,32(11):803-810.
[9] Collino M,Aragno M,Catiglia S,et al. Pioglitazone improves lipid and insulin levels in overweight rats on a high cholesterol and fructose diet by decreasing hepatic inflammation[J]. Br J Pharmacol,2010,160(8):1892-1902.
[10]Rastmanesh MM,Braam B,Joles JA,et al.SOCS expression in peripheral blood mononuclear cells of end stage renal disease patients is related to in.ammation and dialysis modality[J].Eur J Pharmacol,2009,602(1):163-167.
[11] Bruuna C,Hedinga PE,Rφnn SG,et al. Suppressor of cytokine signalling-3 inhibits tumor necrosis factor-alpha induced apoptosis and signalling in beta cells[J]. Mol Cell Endocrinol,2009,311(1-2):32-38.
[12] Taleb S,Romain M,Ramkhelawon B,et al. Loss of SOCS3 expression in T cells reveals a regulatory role for interleukin-17 in atherosclerosis[J]. J Exp Med,2009,206(10):2067-2077.
[13]Yu JH,Kim KH,Kim H. SOCS 3 and PPAR-γ ligands inhibit the expression of IL-6 and TGF-β1 by regulating JAK2/STAT3 signaling in pancreas[J]. Int J Biochem Cell Biol,2008,40(4):677-688.
[14]Park EJ,Park SY,Joe EH,et al. 15d-PGJ2and rosiglitazone suppress Janus kinase-STAT inflammatory signaling through induction of suppressor of cytokine signaling 1(SOCS1)and SOCS3 in glia[J]. J Biol Chem,2003,278(17):14747-14752.
[15]Lebrun P,Van Obberghen E. SOCS proteins causing trouble in insulin action[J]. Acta Physiol (Oxf),2008,192(1):29-36.
