槲皮素对ox-LDL 所致的小鼠巨噬细胞脂质蓄积和过氧化的影响*
2013-12-23李金国方永奇秦树存姚树桐
苗 成, 李金国, 苗 芳, 焦 鹏, 田 华, 方永奇, 秦树存△, 姚树桐,△
(泰山医学院1动脉粥样硬化研究所,山东省高校重点实验室,2基础医学院,山东 泰安271000)
心脑血管疾病位居人类疾病谱首位,动脉粥样硬化(atherosclerosis,AS)是其主要病理基础,而泡沫细胞尤其巨噬细胞源性泡沫细胞是AS 的重要标志,并在其发生发展中起着重要作用[1]。由清道夫受体介导的巨噬细胞对氧化低密度脂蛋白(oxidized lowdensity lipoprotein,ox-LDL)的无限制摄取是泡沫细胞形成的重要环节,其中CD36 是巨噬细胞表面主要识别、内吞ox-LDL 的清道夫受体,其结合和摄取的ox-LDL 占巨噬细胞结合和摄取修饰脂质的50%以上[2],因此调控CD36 表达可能对抑制泡沫细胞形成、阻止AS 进展具有重要意义。槲皮素(quercetin,QUE)是广泛存在于蜂胶、红酒、水果和茶叶中的小分子黄酮类化合物,具有抗氧化、抗炎、抗肿瘤、调血脂、降血压等药理作用[3-4]。本课题组既往研究证实,QUE 可抑制ox-LDL 所诱导的巨噬细胞内脂质蓄积[5],但其机制尚不清楚。本研究在ox-LDL 诱导的巨噬细胞源性泡沫细胞模型上,研究槲皮素对CD36表达及氧化应激反应的影响,以探讨其调控巨噬细胞泡沫化的机制。
材 料 和 方 法
1 材料与试剂
QUE、油红O 和2’,7’-二氯荧光素二乙酸脂(2’,7’-dichlorofluorescein diacetate,DCFH-DA)为Sigma 产品;DMEM 高糖培养基和RIPA 裂解液分别购自Gibco 和Solarbio;兔抗CD36 和β-actin 抗体购自Santa Cruz;辣根过氧化物酶标记山羊抗兔IgG 为北京中杉金桥产品;Trizol 试剂购自Invitrogen;cDNA合成试剂盒和Real Master Mix(SYBR Green)试剂盒为北京天根公司产品;增强化学发光(enhanced chemiluminescence,ECL)试剂盒和PVDF 膜分别为Pierce 和Millpore 产品;乳酸脱氢酶(lactate dehydrogenase,LDH)和丙二醛(malondialdehyde,MDA)测定试剂盒购自南京建成生物工程研究所,其余试剂均为分析纯产品。
2 方法
2.1 LDL 分离与氧化 按照文献[6]方法制备ox-LDL,即采用序列超速离心法分离健康人新鲜血浆LDL,用不含EDTA 的PBS 液透析48 h,随后在含10 μmol/L CuSO4的PBS 液(pH 7.2)中37 °C 温育透析18 h,最后在含100 μmol/L EDTA 的PBS 中4 ℃透析24 h。过滤除菌,BCA 试剂定量蛋白,用PBS 调蛋白浓度至1 g/L,4 ℃保存备用。测定硫代巴比妥酸反应物质MDA 的浓度(>30 μmol/g);且琼脂糖凝胶电泳显示ox-LDL 电泳迁移率增快,为LDL 的2.0 ~2.5 倍。
2.2 细胞培养与实验分组 鼠源RAW264.7 巨噬细胞由中国科学院上海生物化学与细胞生物学研究所细胞库提供,用DMEM 高糖培养基(含10%胎牛血清、青霉素1 ×105U/L 和链霉素100 mg/L)于37℃、5% CO2培养箱中培养。随机分为(1)正常对照(control)组:培养液中常规培养;(2)ox-LDL 组:培养液中加入100 mg/L ox-LDL;(3)QUE 预处理组:培养液中先加入QUE (20、40 和80 μmol/L)预处理30 min,再加入100 mg/L ox-LDL。除QUE 预处理组外,其它各组均加入体积分数为0.1%的二甲亚砜(dimethylsulfoxide,DMSO),培养24 h 收集细胞。
2.3 油红O 染色观察细胞内脂滴变化[6]将细胞培养于放有无菌盖玻片的6 孔培养板内,细胞经处理后,PBS 润洗,4%钙甲醛溶液固定,油红O 染色液染色15 min,苏木素复染。Olympus BX51 显微镜观察,细胞内脂质呈红色,细胞核呈蓝色。每张爬片随机选取5 个区域,采用Image-Pro Plus 6. 0 (Media Cybernetics)图像分析软件分析实验结果,细胞内脂滴含量以细胞平均积分吸光度(integrated absorbance,IA)值表示。
2.4 细胞培养液中LDH 活性和MDA 含量检测
将细胞培养于6 孔板中,经处理后收集细胞培养液,1 500 r/min 离心10 min,收集上清,按照试剂盒说明书比色法测定细胞培养液中LDH 活性和MDA 含量。
2.5 DCFH-DA 荧光探针检测细胞活性氧( reactive oxygen species,ROS) 水平 将细胞接种于96 孔板,经处理后,装载探针,使DCFH-DA 终浓度为10 μmol/L。37 ℃孵育30 min 后,无血清培养液洗细胞3 次。多功能酶标仪检测,激发波长为488 nm,发射波长为525 nm。以对照组ROS 水平为100%,其它各组ROS 水平以其荧光强度占对照组荧光强度的百分比表示。
2.6 Real-time PCR 检测CD36 mRNA 表达 按照Trizol 试剂说明提取各组细胞总RNA。按RNA 逆转录试剂盒说明书合成cDNA 产物。按real-time PCR试剂盒说明书准备20 μL PCR 扩增反应体系:SYBR Green 9 μL,上、下游引物各2 μL,cDNA 2 μL,双蒸水5 μL。在real-time PCR 仪(Rotor-Gene Q 型,上海Qiagen 公司)上反应,条件为94 ℃预变性10 min,94℃20 s,55℃30 s,70 ℃30 s,40 个循环。β-actin 作为内参照。CD36 上游引物5’-GAACCTATTGAAGGCTTACATCC-3’,下游引物5’-CCCAGTCACTTGTGTTTTGAAC-3’,扩增长度246 bp;β-actin 上游引物5’-CGGGGACCTGACTGACTACC-3’,下游引物5’-AGGAAGGCTGGAAGAGTGC -3’,扩增长度251 bp。
2.7 Western blotting 检测CD36 蛋白表达 按照RIPA 蛋白提取试剂盒说明书提取各组细胞蛋白,经定量、变性处理并进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(10%分离胶)后电转印至PVDF 膜,5%脱脂奶粉封闭后分别用兔抗CD36 (1∶300)和β-actin 抗体(1∶500)多克隆抗体室温孵育3 h,洗膜后用辣根过氧化物酶标记相应II 抗孵育2 h。免疫条带用ECL 法显示,暗室曝光,采用Image-Pro Plus 软件分析蛋白条带IA 值,以CD36 IA 值与β-actin IA 值的比值反映CD36 相对水平。
3 统计学处理
采用SPSS 13.0 统计软件分析,数据用均数±标准差(mean±SD)表示,多组间比较应用单因素方差分析,组间两两比较应用q 检验,以P <0.05 为差异有统计学意义。
结 果
1 QUE 抑制ox-LDL 所诱导的RAW264.7 巨噬细胞内脂质蓄积
正常对照组油红O 染色阳性细胞少或无;ox-LDL 组油红O 染色阳性细胞遍布;QUE (20、40 和80 μmol/L)预处理组油红O 染色阳性细胞明显减少,其平均IA 值分别为ox-LDL 组的80.6%、62.9%和51.8% (后两者P <0.01),见图1。
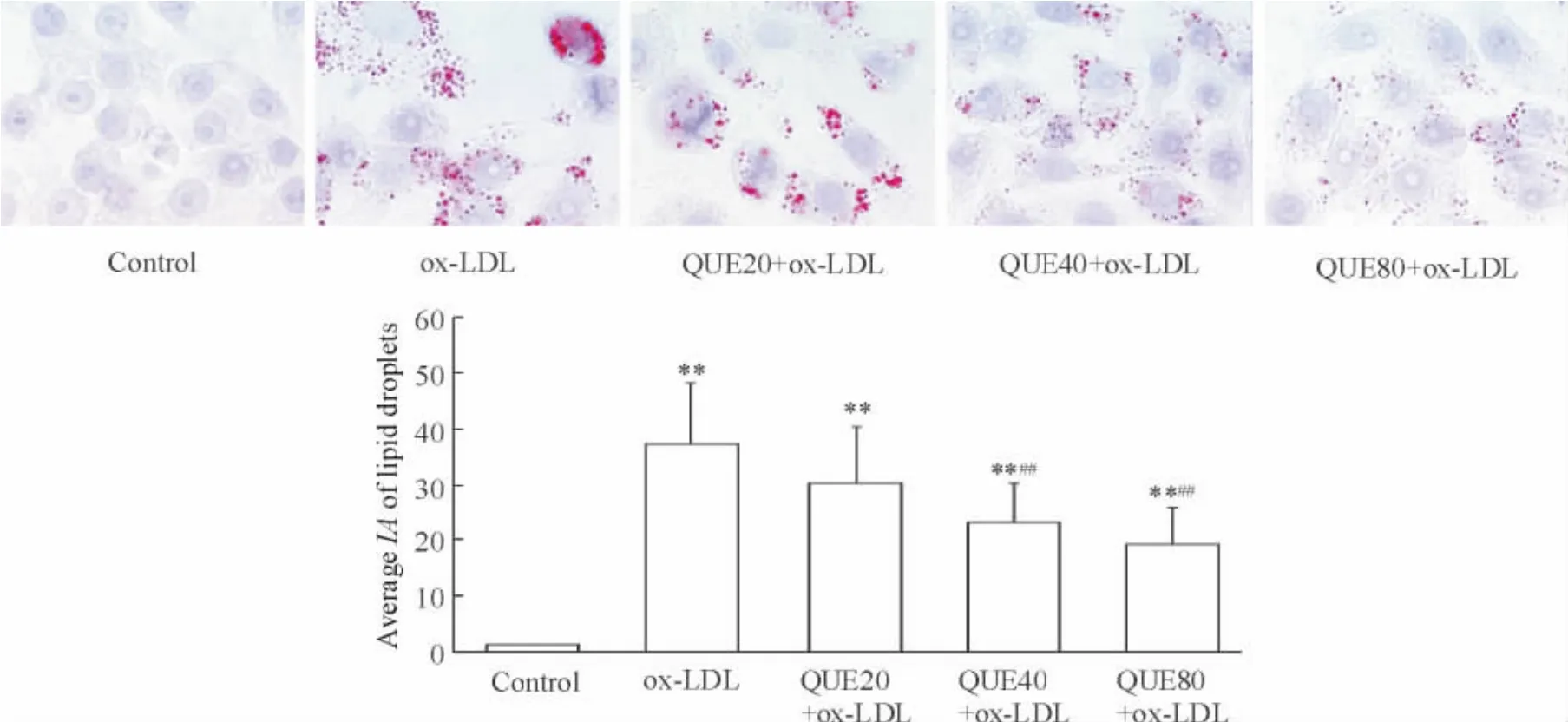
Figure 1. QUE reduced ox-LDL-induced intracellular lipid accumulation in RAW264.7 cells. Cells were pretreated with 20,40 and 80 μmol/L of QUE for 30 min and then treated with ox-LDL (100 mg/L)for 24 h. The intracellular lipid droplets were stained by oil red O (×1 000). Mean±SD. n=6. **P <0.01 vs control group;##P <0.01 vs ox-LDL group.图1 QUE 减轻ox-LDL 所诱导的RAW264.7 细胞内脂质蓄积
2 QUE 降低ox-LDL 所致的细胞LDH 释放
不同浓度的QUE 均可显著抑制ox-LDL 所致的LDH 释放,分别较ox-LDL 组降低25.4%、33.3%和42.1% (P <0.05 或P <0.01),见图2。
3 QUE 对细胞内ROS 和培养液MDA 水平的影响
ox-LDL 组细胞内ROS 和培养液中MDA 含量均明显升高,与正常对照组比较差异有统计学意义(P<0.01);而与ox-LDL 组比较,QUE 预处理组ROS和MDA 含量均显著降低,尤以80 μmol/L QUE 组更为明显(P <0.01),见图3。
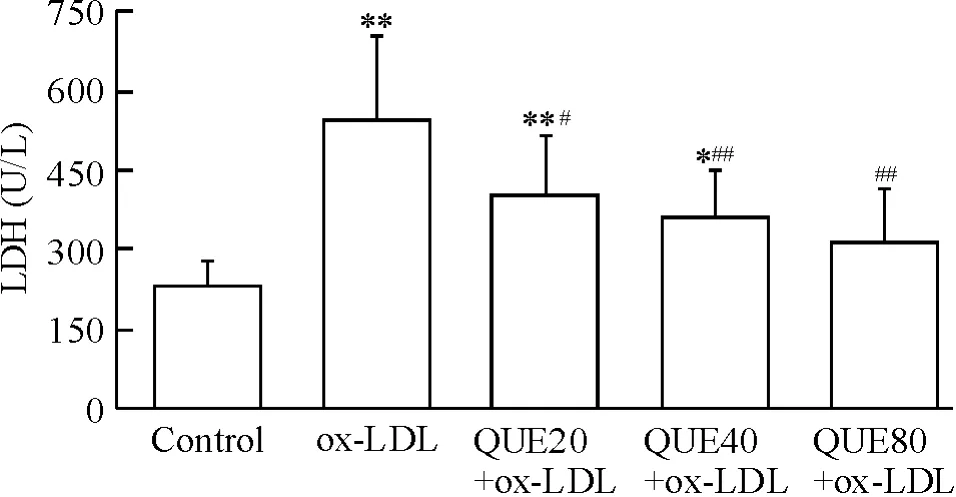
Figure 2. Suppressive effect of QUE on ox-LDL-induced LDH release in macrophages. Mean±SD. n=6. * P <0.05,**P <0.01 vs control group;#P <0.05,##P <0.01 vs ox-LDL group.图2 QUE 降低ox-LDL 所致的细胞LDH 释放
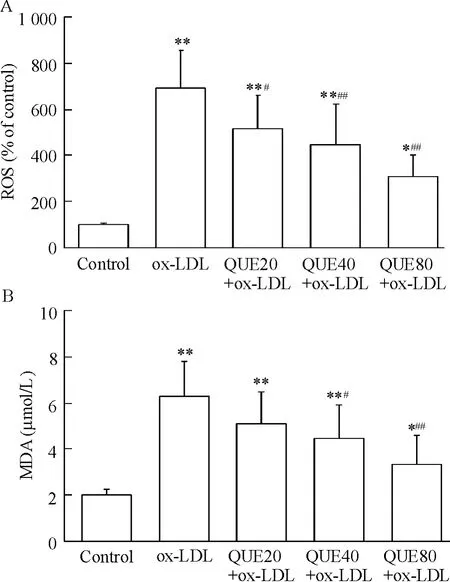
Figure 3. Effects of QUE on the levels of intracellular ROS (A)and MDA in culture medium (B). Cells were pretreated with 20,40 and 80 μmol/L of QUE for 30 min and then treated with ox-LDL (100 mg/L)for 24 h.Mean±SD. n=6. * P <0.05,**P <0.01 vs control group;#P <0.05,##P <0.01 vs ox-LDL group.图3 QUE 对细胞内ROS 和培养液MDA 水平的影响
4 QUE 抑制ox-LDL 诱导的CD36 mRNA 和蛋白表达上调
QUE 明显抑制ox-LDL 所诱导的CD36 mRNA 上调,且呈浓度依赖性(P <0.05 或P <0.01),见图4A。
免疫印迹结果显示,与对照组比较,ox-LDL 处理组CD36 蛋白水平明显增加;而给予20、40 和80 μmol/L QUE 预处理,CD36 较ox-LDL 处理组分别降低23. 1%、28. 5% 和45. 1% (P <0. 05 或P <0.01),见图4B。
讨 论
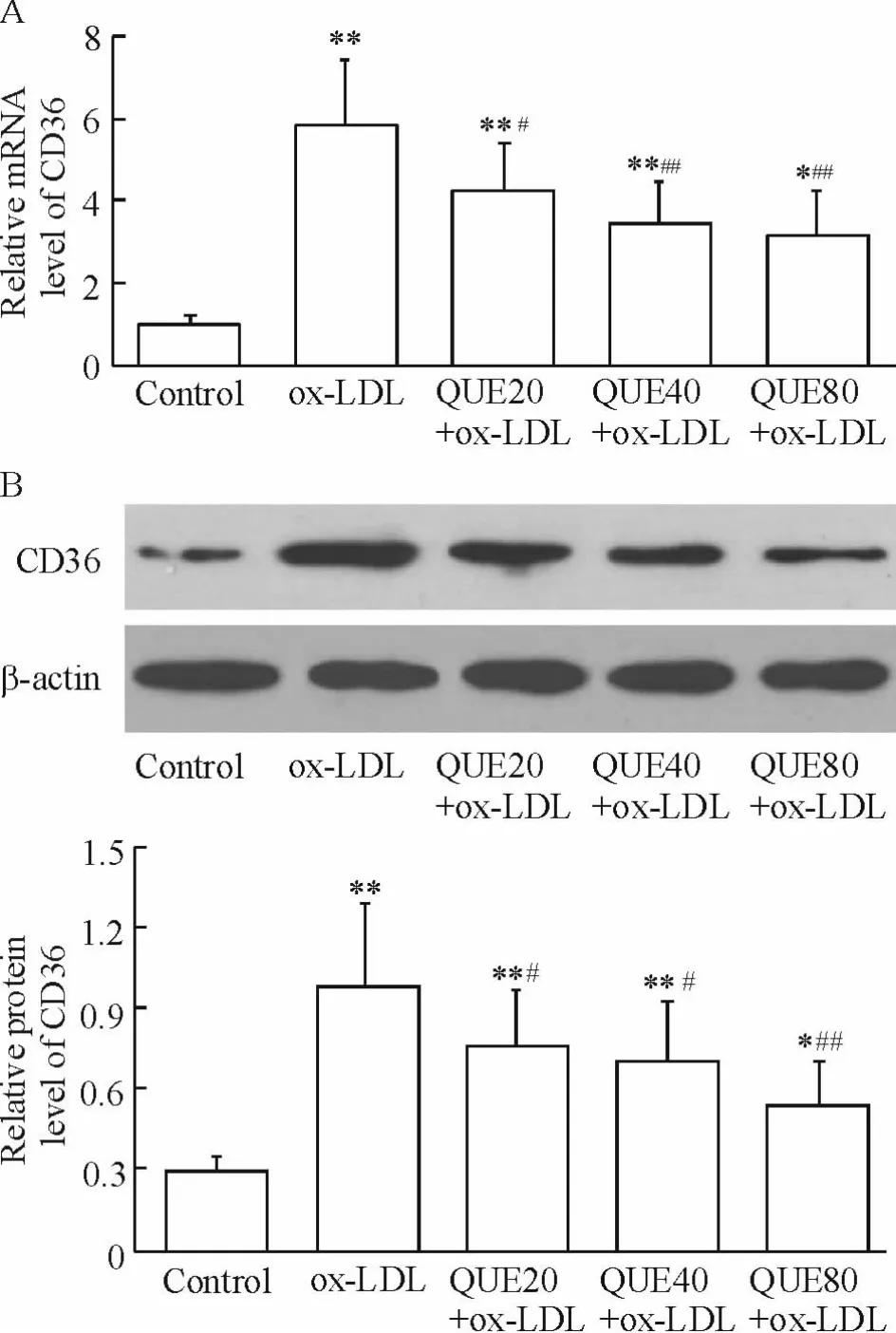
Figure 4. Effects of QUE on CD36 expression in RAW264.7 cells. Cells were pretreated with 20,40 and 80 μmol/L of QUE for 30 min and then treated with ox-LDL (100 mg/L)for 24 h. The mRNA (A)and protein (B)levels of CD36 were analyzed by realtime PCR and Western blotting,respectively. Mean±SD. n = 4. * P <0. 05,**P <0.01 vs control group;#P <0.05,##P <0.01 vs ox-LDL group.图4 QUE 对CD36 表达的影响
AS 是一种由内皮细胞、平滑肌细胞、单核/巨噬细胞等多种细胞参与的慢性炎症反应,而ox-LDL 是公认的诱导血管壁炎症反应的重要危险因素,在AS发生发展过程中起着重要作用。ox-LDL 与正常LDL主要区别在于其中的氧化成分,如氧化胆固醇组分等。单核细胞来源的巨噬细胞大量摄取ox-LDL 进而形成泡沫细胞,甚至死亡崩解,形成粥样斑块的脂质核心,其主要原因是由于ox-LDL 中的氧化成分对巨噬细胞的氧化损伤[7]。本实验结果显示,给予ox-LDL 处理细胞24 h,巨噬细胞内脂质蓄积显著,ROS水平和脂质过氧化产物MDA 明显增加,且反映细胞损伤的LDH 释放明显增多,表明巨噬细胞损伤与ox-LDL 引起的脂质过氧化有关。因此增强单核/巨噬细胞抗氧化损伤能力可能对AS 疾病的防治具有重要意义。
QUE 又名五羟黄酮、槲皮酮,在植物界分布广泛,具有抗氧化、降血脂、降血压、增加冠脉血流量、减少毛细血管脆性、抗菌消炎等多种生物活性[3-4]。Kawai 等[8]检测动脉壁中槲皮素代谢产物——槲皮素葡糖苷酸的分布,结果显示其主要分布于粥样病变处,且以巨噬细胞源性泡沫细胞中更甚,提示巨噬细胞可能作为槲皮素抗AS 的治疗靶点。文献报道[9]和我们既往研究[10]表明QUE 可增强小鼠巨噬细胞的抗氧化能力,抑制脂多糖所诱导的氧化应激反应,并减轻毒胡萝卜素所致巨噬细胞损伤。本实验结果显示,QUE 可抑制ox-LDL 所诱导的细胞LDH释放,并减少ROS 和脂质过氧化产物MDA 的生成,表明QUE 可减轻ox-LDL 所诱导的巨噬细胞脂质过氧化损伤。
由清道夫受体介导的对ox-LDL 无限制摄取是泡沫细胞形成和AS 发生发展的关键,其中B 类清道夫受体CD36 是巨噬细胞表面主要识别、内吞ox-LDL 的清道夫受体,其结合和摄取的ox-LDL 占巨噬细胞结合和摄取修饰脂质的50%以上[2]。研究表明由ox-LDL 启动的CD36 依赖性信号转导途径可能为泡沫细胞形成所必需[11-12]。本课题组既往研究证实,QUE 可通过上调三磷酸腺苷结合盒式转运体A1表达抑制泡沫细胞形成[13]。本实验进一步探讨了QUE 对CD36 表达的调控作用,结果显示QUE 可明显抑制巨噬源性泡沫细胞形成和细胞内脂质蓄积,并在mRNA 和蛋白水平均可抑制ox-LDL 所诱导的CD36 表达上调。
综上所述,本研究发现QUE 可减轻ox-LDL 所诱导的RAW264.7 巨噬细胞脂质蓄积和脂质过氧化损伤,其机制可能与下调CD36 表达有关,而关于QUE对CD36 表达调控的上游分子机制仍有待进一步研究。
[1] Tiwari RL,Singh V,Barthwal MK. Macrophages:an elusive yet emerging therapeutic target of atherosclerosis[J].Med Res Rev,2008,28(4):483-544.
[2] Nicholson AC,Han J,Febbraio M,et al. Role of CD36,the macrophage class B scavenger receptor,in atherosclerosis[J]. Ann N Y Acad Sci,2001,947:224-228.
[3] Perez-Vizcaino F,Duarte J. Flavonols and cardiovascular disease[J]. Mol Aspects Med,2010,31(6):478 -494.
[4] 矫 强,郭竹英,徐芒华,等. 槲皮素对LPS 诱导的体外培养肝细胞损伤的影响及机制[J]. 中国病理生理杂志,2009,25(6):1142 -1146.
[5] Yao S,Sang H,Song G,et al. Quercetin protects macrophages from oxidized low-density lipoprotein-induced apoptosis by inhibiting the endoplasmic reticulum stress-C/EBP homologous protein pathway[J]. Exp Biol Med,2012,237(7):822-831.
[6] Yao S,Zong C,Zhang Y,et al. Activating transcription factor 6 mediates oxidized LDL-induced cholesterol accumulation and apoptosis in macrophages by up-regulating CHOP expression[J]. J Atheroscler Thromb,2013,20(1):94-107.
[7] Seimon T,Tabas I. Mechanisms and consequences of macrophage apoptosis in atherosclerosis[J]. J Lipid Res,2009,50(Suppl):S382-S387.
[8] Kawai Y,Ishisaka A,Saito S,et al. Immunochemical detection of flavonoid glycosides:development,specificity,and application of novel monoclonal antibodies[J]. Arch Biochem Biophys,2008,476(2):124-132.
[9] 李云峰,郭长江,韦京豫,等. 槲皮素对小鼠腹腔巨噬细胞氧化应激反应与功能的影响[J]. 解放军预防医学杂志,2007,25(3):160-163.
[10]岳 雯,姚树桐,鲍 颖,等. 槲皮素对毒胡萝卜素诱导的巨噬细胞内质网应激凋亡途径的抑制作用及机制[J]. 中国病理生理杂志,2012,28(3):518-523.
[11]Rahaman SO,Lennon DJ,Febbraio M,et al. A CD36-dependent signaling cascade is necessary for macrophage foam cell formation[J]. Cell Metabolism,2006,4(3):211-221.
[12]姚树桐,桑 慧,杨娜娜,等. 氧化低密度脂蛋白诱导巨噬细胞内质网应激及CD36 的可能作用[J]. 生理学报,2010,62(5):433-440.
[13]桑 慧,姚树桐,杨娜娜,等. 槲皮素上调三磷酸腺苷结合盒式转运体A1 表达干预泡沫细胞的形成[J]. 营养学报,2010,32(6):536-539.
