慢病毒介导的降钙素基因相关肽转染对大鼠骨髓间充质干细胞内皮分化的影响*
2013-12-23龙仙萍赵然尊敖竹君
龙仙萍, 汪 松, 赵然尊, 石 蓓△, 敖竹君
(遵义医学院第一附属医院1心内科,2急诊科,贵州 遵义563003;3曼尼托巴大学,加拿大曼尼托巴省温尼伯市R3E 0J9)
急性心肌梗死(acute myocardial infarction,AMI)是心肌缺血性坏死,为在冠状动脉病变的基础上发生的冠脉血供急剧减少或中断,使相应心肌持久地急性缺血导致心肌坏死。经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)虽可以挽救部分频临坏死的心肌细胞,但对长期血供不足的心肌无明显的作用。尽早恢复梗死区血液供应是预防梗死后心功能衰竭,改善患者预后的关键。骨髓间充质干细胞(mesenchymal stem cells,MSCs)具有多向分化潜能,多项研究显示MSCs 移植后促进梗死交界区毛细血管形成,从而改善梗死后心功能[1-2]。我们前期研究也显示MSCs 移植于心肌梗死家兔可促进梗死交界区毛细血管密度形成,使梗死面积缩小,心功能得到改善[3]。为了进一步优化MSCs 的移植作用,本课题前期应用受体活性修饰蛋白1(receptor activity-modifying protein 1,RAMP1)修饰的MSCs 移植于心肌梗死后颈动脉球囊损伤兔模型后,观察到RAMP1 修饰的MSCs 移植较单纯MSCs 移植更能促进梗死交界区的毛细血管密度形成增加,更能改善梗死后心功能[4]。而RAMP1 是降钙素基因相关肽(calcitonin gene-related peptide,CGRP)的关键调节肽,RAMP1 移植使CGRP 效应增强,这说明CGRP 对心血管的修复具有一定的作用。CGRP 是人体内含量最丰富的神经肽,对心血管系统具有保护作用。研究发现CGRP 可促进内皮细胞增殖[5],还可以促进人脐静脉内皮细胞合成和分泌一氧化氮(nitric oxide,NO),改善内皮的功能。那么CGRP 对MSCs 有无作用呢?为了观察CGRP 的作用,本文利用慢病毒介导CGRP 基因转染MSCs,观察CGRP 对MSCs内皮分化方面的作用及意义,以探讨CGRP 是否促进心肌梗死后的血管再生。
材 料 和 方 法
1 材料
10 只大鼠作为种子细胞的来源,雌雄不限,体重(150.0 ±0.1)g,鼠龄2 ~3 月,购自遵义医学院实验动物中心。实验分为 CGRP 转染 MSCs 组(CGRP)、CGRP 转染MSCs + CGRP 受体拮抗剂组(CGRP+ CGRP8-37)及未经转染的对照组。前期实验应用空慢病毒载体和PBS 转染MSCs 后,观察到两者对细胞增殖活性及细胞生物学特征无明显影响,故本实验直接应用PBS 转染MSCs 作为对照。实验试剂:MaxGelTM细胞外基质(extracellular matrix,ECM)和CGRP 受体拮抗剂CGRP8-37(Sigma);抗体(武汉博士德);基础培养基:DMEM(Gibco);条件培养基:M199 含10%胎牛血清(PAA)、50 μg/L 血管内皮生长因子(vascular endothelial growth factor,VEGF)、5 μg/L 碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、2 μg/L 胰岛素样生长因子Ⅰ(insulin-like growth factor I,IGF-I)、1 × 104U/L 的肝素、0.2%牛脑提取物、1 ×105U/L 青霉素和100 mg/L 链霉素(Sigma)。
2 方法
2.1 大鼠MSCs 细胞的分离纯化和培养扩增 采用密度梯度离心法分离纯化大鼠MSCs[3-5]。48 h 后换液,约10 ~14 d 细胞接近融合时按1∶3 传代,标记为第1 代(P1),以后反复传代扩增。
2.2 携带CGRP 基因慢病毒载体的构建 重组慢病毒Lenti-GFP-CGRP 和Lenti-GFP 均由上海英为信生物公司构建,本实验用293 细胞扩增,-70 ℃保存备用。
2.3 ELISA 检测CGRP 表达 收集病毒转染后1 d、2 d 和3 d 的细胞上清液,加入含Ⅰ抗的96 孔板,每孔加入100 μL 酶标抗体工作液,封板,37 ℃孵育30 min,洗板后加底物工作液100 μL,置37 ℃避光反应15 min 后加入100 μL 终止液混匀,30 min 内用酶标仪测得450 nm 吸光度(A),以标准品2 000、1 000、500、250、125、62.5、31.25、0 ng/L A 值为纵坐标,根据样品A 值在该曲线图上查出CGRP 的含量。
2.4 大鼠MSCs 转染CGRP 对细胞内皮分化的影响
同源的P3 大鼠MSCs 用胰酶消化,按5 ×103cells/well 接种于预先放好细胞爬片的24 孔板,完全培养基过夜。12 h 后吸尽培养基,PBS 洗2 次,转染组加人400 particles/cell Lenti-CGRP,CGRP +CGRP8-37组在给予Lenti -CGRP 前30 min 加入0. 1 μmol/L CGRP 受体拮抗剂CGRP8-37,对照组用PBS 代替。转染后1 d、2 d、3 d 和4 d 在荧光显微镜下计数绿色荧光细胞并计算转染率。每3 d 换液1 次,7 d 后取出爬片,进行CD31 和Ⅷ因子相关抗原免疫细胞化学染色(SP 法)。
采用同源的P3 大鼠MSCs 用胰酶消化,按2 ×104cells/well 接种于24 孔板,完全培养基过夜12 h后吸尽培养基,实验分组和步骤如上,分别在诱导后第1 d、2 d、3 d、5 d、7 d 和9 d 取出爬片进行细胞计数,其余细胞每3 d 换液1 次。根据细胞计数结果评估细胞增殖情况。
2.5 转染CGRP 对大鼠MSCs 血管形成能力的影响
用4 ℃预冷的无血清基础培养基按1∶5 的比例稀释MaxGelTMECM,按50 μL/well 接种于96 孔板,置于37 ℃培养箱孵育过夜。分组转染细胞,12 h 后以1 ×104cells/well,按实验分组进行接种,实验分组和步骤如上,每组3 复孔。诱导培养14 d 后镜下观察其生长状态并拍照。
3 统计学处理
应用SPSS 16.0 软件包分析。数据用均数±标准差(mean ±SD)表示,组间差异采用单因素方差分析。以P <0.05 为差异有统计学意义。
结 果
1 大鼠骨髓MSCs 的分离、培养和转染
密度梯度离心获得比较均一的球形单个核细胞,培养2 ~3 d 后首次换液,约7 ~10 d 细胞融合成单层,铺满瓶底。消化传代后生长较快,3 d 可铺满瓶。各组细胞经诱导后增殖缓慢,有部分细胞死亡并脱落,而存活的细胞形态渐渐趋于均一,诱导后4 d 可见细胞由原来扁平多角形渐变为扁圆形、圆形或椭圆形,细胞状态比较稳定。经EGFP 标记的慢病毒转染MSCs 后,应用荧光显微镜观察可见细胞发出绿色荧光,细胞计数法所得细胞转染率达80%,说明Lenti-CGRP 成功地被转入MSCs,见图1。
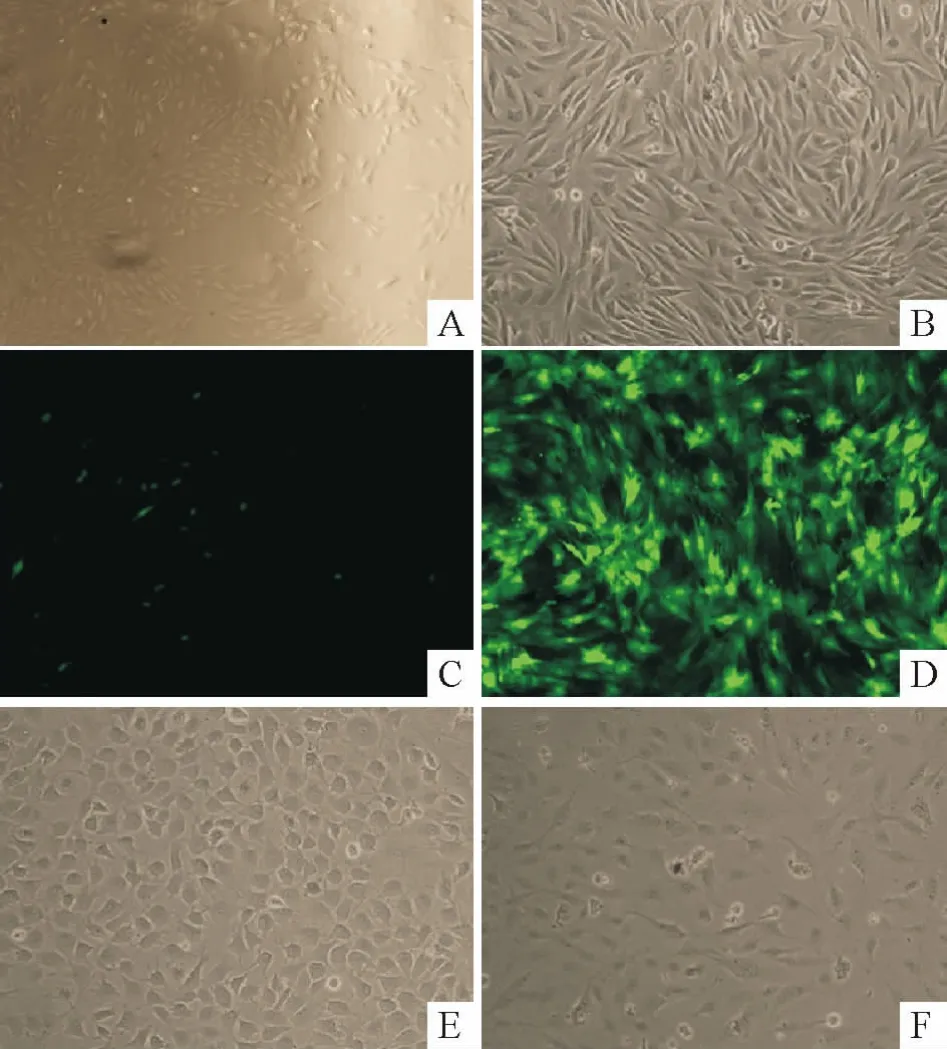
Figure 1. Mesenchymal stem cells were cultured and transfected.A:primary cells cultured for 7 d (×40);B:passage cells (×100);C:untransfected cells (×100);D:cells transfected with Lenti-CGRP for 3 d (×100);E:cells transfected with Lenti-CGRP for 14 d,showing a cobblestone-like appearance (×100);F:untransfected cells showing a fiber-like appearance (×100).图1 细胞培养及转染图片
2 ELISA 检测CGRP 表达
CGRP 转染MSCs 后1 d,培养基中有少量CGRP表达,CGRP 转染后3 d,CGRP 蛋白明显增加,与对照组比较有显著差异[(19.530 ± 0.498)ng/L vs(3.120 ±0.001)ng/L,P <0.05],说明CGRP 成功转染MSCs 后,MSCs 能分泌CGRP 蛋白,转染后3 d达高峰。
3 转染CGRP 对大鼠MSCs 内皮分化的影响
SP 染色评估细胞胞质出现咖啡色免疫复合物为阳性细胞,随机选取5 个视野,计数阳性细胞数后计算细胞阳性率,结果显示,转染Lenti-CGRP 的MSCs细胞爬片CD31 染色大部分细胞呈阳性表达(89.3%),而加入CGRP 受体拮抗剂后CD31 的表达率下降(52.3%),CGRP 组与CGRP +CGRP8-37及对照组比较差异显著(P <0.05);CGRP 组Ⅷ因子相关抗原染色阳性细胞率为65.2%,而加入CGRP 受体拮抗剂后Ⅷ因子相关抗原的表达率下降(35.3%),CGRP 组与CGRP +CGRP8-37及对照组比较差异显著(P <0.05),见图2。
4 转染CGRP 对MSCs 增殖的影响
转染CGRP 对诱导后MSCs 的增殖有影响,CGRP 组细胞数量增长很快,而对照组细胞增殖较慢,这种变化在细胞转染CGRP 3 d 后最明显(P <0.05),随着转染时间的延长,细胞增殖速度无明显增加。而加入CGRP 受体拮抗剂后上述细胞增殖现象明显减弱,在转染后3 d、5 d、7 d 和9 d 的细胞数量与CGRP 组相比有显著差异(P <0.05),见表1。这说明CGRP 能增强并保持MSCs 向内皮细胞分化后的干细胞增殖特性。
5 转染CGRP 对MSCs 血管形成能力的影响
细胞转染后14 d,镜下观察到对照组MSCs 在纤维胶表面仍呈单层细胞纤维状生长,转染Lenti-CGRP 后MSCs 呈环形及线性生长,可发现血管管腔样结构,而加入CGRP 受体拮抗剂后MSCs 的这种环形及线性结构减弱,见图3。
讨 论
血管再生治疗是当今缺血性疾病研究领域关注的热点,心肌梗死是临床常见的一种严重的缺血性疾病,尽管目前临床采用的冠状动脉介入治疗和搭桥手术在很大程度上改善了心肌缺血,但对于急性和慢性冠状动脉狭窄闭塞引起的严重而持久的缺血,尤其是在无法实施手术治疗时,其预后仍不理想。近年来,细胞移植治疗虽在心肌梗死治疗中取得了显著的效果,但针对梗死后新生血管再生等方面的作用仍有限。如何提高干细胞移植效率,最大化的增加干细胞血管再生治疗,有效恢复梗死后血流灌注是心肌梗死治疗的关键。
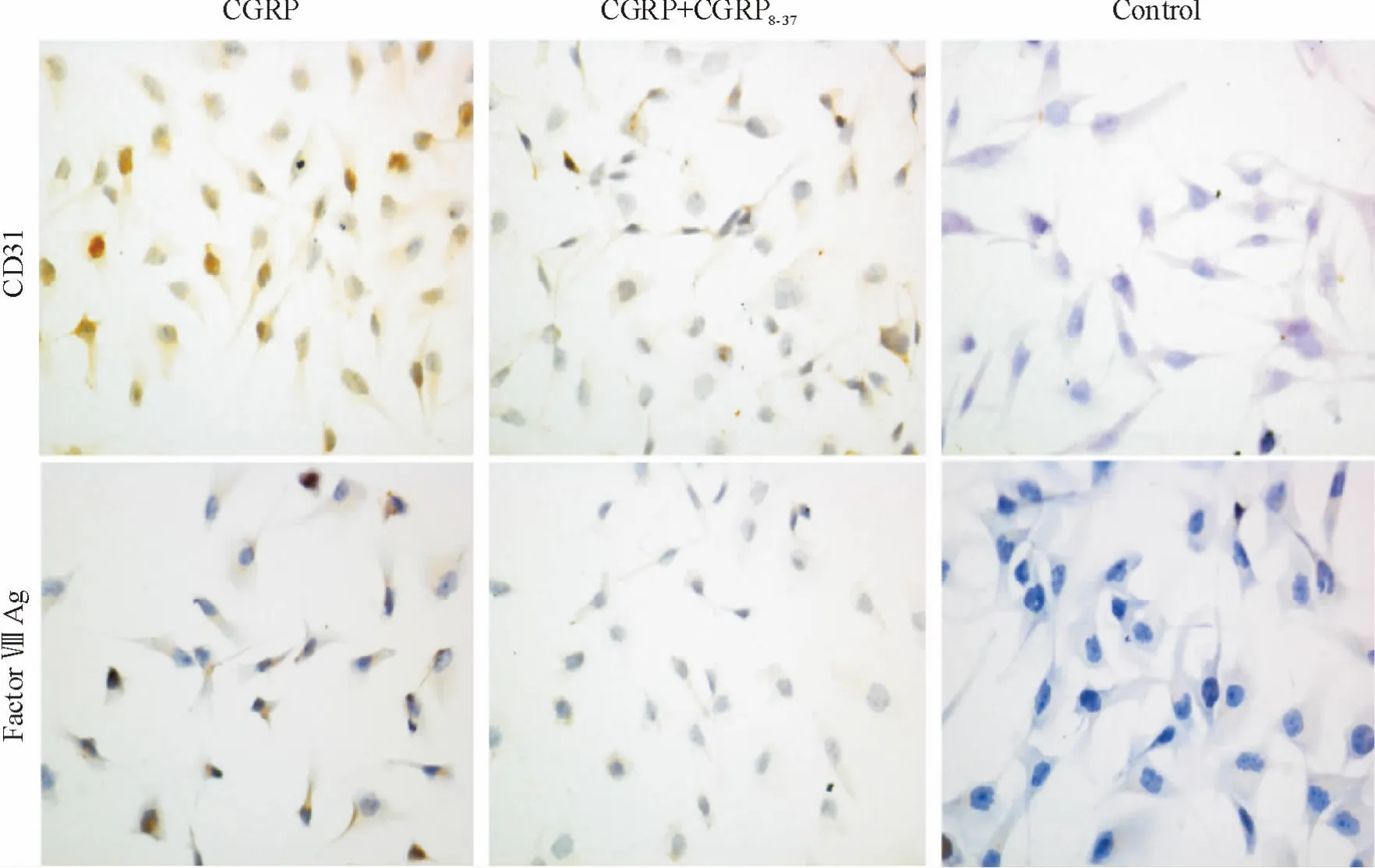
Figure 2. Immunocytochemical staining for CD31 and factor Ⅷ-related antigen in rat MSCsing for (×400).图2 大鼠MSCs CD31 及Ⅷ因子相关抗原的免疫细胞化学染色

表1 各组大鼠MSCs 增殖的比较Table 1. Comparison of the proliferation of rat MSCs in each group (×105.Mean±SD.n=3)
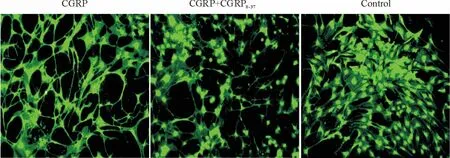
Figure 3. Angiogenesis of rat MSCs in different groups (×100).图3 各组大鼠MSCs 管腔样结构形成图片
CGRP 是人体内含量最丰富的神经肽,在心血管系统生理和病理调节中起了重要的作用。CGRP 注射大鼠缺血膝关节及缺血后肢,观察到内皮细胞增生明显,血管形成增加,CGRP 受体拮抗剂作用后上述的作用明显被抑制[6-7]。Zheng 等[8]的研究显示,CGRP 通过调节cAMP-PKA 途径促进内皮型一氧化氮合酶的合成。CGRP 还能促进人表皮静脉内皮细胞的增殖和迁移[9],而CGRP 转染内皮组细胞后,内皮组细胞分泌的CGRP 能抑制血管内皮细胞增殖[10]。本课题前期研究显示RAMP1 修饰的MSCs移植更能促进心肌梗死后梗死交界区毛细血管形成,有效恢复梗死后血流灌注,改善梗死后的心功能。而RAMP1 是CGRP 的关键调节肽,RAMP1 的作用结果与上调CGRP 的效应性有关。那么CGRP究竟对MSCs 的有无作用呢?
本实验应用携带CGRP 的慢病毒转染MSCs 后,观察到MSCs 在一定时间内能分泌CGRP,转染3 d后达高峰。对照组中随着培养时间的延长,MSCs 自然分化为成纤维细胞,而转染CGRP 后,细胞培养1周,发现细胞表现出内皮细胞样特征,细胞呈典型“铺路卵石样”生长,且CD31 和Ⅷ因子相关抗原染色呈阳性,说明MSCs 经诱导干预可以定向分化为内皮细胞。增殖实验也进一步体现了转染CGRP 可增加MSCs 内皮分化后的数量并保持干细胞的增殖能力;而转染CGRP 的MSCs 中加入CGRP 受体拮抗剂后,上述作用明显被抑制。在血管生成实验中,转染CGRP 的细胞培养后14 d 呈环形、线状生长,加入CGRP 受体拮抗剂后环形、线状结构生长不明显,而对照组细胞仍呈纤维样排列。这说明CGRP 作用MSCs 后可能更有利于调节微血管的发生。
[1] Otto Beitnes J,Øie E,Shahdadfar A,et al. Intramyocardial injections of human mesenchymal stem cells following acute myocardial infarction modulate scar formation and improve left ventricular function[J]. Cell Transplant,2012,21(8):1697-1709.
[2] Jin J,Zhao Y,Tan X,et al. An improved transplantation strategy for mouse mesenchymal stem cells in an acute myocardial infarction model[J]. PLoS One,2011,6(6):e21005.
[3] 石 蓓,刘志江,赵然尊,等. 骨髓间充质干细胞移植对心肌梗死后心脏功能及损伤血管再狭窄的影响[J].中华医学杂志,2011,91(32):2269-2273.
[4] 龙仙萍,赵然尊,石 蓓,等. hRAMP1 修饰的骨髓间充质干细胞移植对兔球囊损伤血管再狭窄及心功能的影响[J]. 中华医学杂志,2012,92(30):2134-2139.
[5] 龙仙萍,赵然尊,石 蓓,等. 人受体活性修饰蛋白1基因修饰的骨髓间充质干细胞对兔血管成形术后新生内膜的影响[J]. 中国病理生理杂志,2012,28(4):675-682.
[6] Mapp PI,McWilliams DF,Turley MJ,et al. A role for the sensory neuropeptide calcitonin gene-related peptide in endothelial cell proliferation in vivo[J]. Br J Pharmacol,2012,166(4):1261-1271.
[7] Mishima T,Ito Y,Hosono K,et al. Calcitonin gene-related peptide facilitates revascularization during hindlimb ischemia in mice[J]. Am J Physiol Heart Circ Physiol,2011,300(2):H431-H439.
[8] Zheng S,Li W,Xu M,et al. Calcitonin gene-related peptide promotes angiogenesis via AMP-activated protein kinase[J]. Am J Physiol Cell Physiol,2010,299(6):C1485-C1492.
[9] Tuo Y,Guo X,Zhang X,et al. Effect of calcitonin generelated peptide on proliferation and migration of human umbilical vein endothelial cells[J]. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi,2012,26(4):495-500.
[10]Fang L,Chen MF,Xiao ZL,et al. Calcitonin gene-related peptide released from endothelial progenitor cells inhibits the proliferation of rat vascular smooth muscle cells induced by angiotensin II[J]. Mol Cell Biochem,2011,355(1-2):99-108.
