竹叶菜的组织培养研究
2013-12-09张丽英张微思
张丽英,朱 萍,郭 相,何 容,张微思
(中华全国供销合作总社昆明食用菌研究所,云南昆明650223)
竹叶菜,又名高大鹿药、长柱鹿药草(Smilacina atropurpurea),为百合科(Liliaceae)鹿药属一种具根状茎的多年生草本植物。竹叶菜高30~60 cm;根状茎横走,粗1.0~1.5 cm,茎横折状,上部或中部以上被粗短毛[1]。叶似竹叶,所以称竹叶菜。
竹叶菜主产于四川东南部及云南西北部海拔2 100~4 000 m的高海拔地区。土壤为森林棕壤,酸性,pH 值 4.5 ~7.2[2]。在秋末果实成熟以后地上部分枯死,地下的根状茎处于休眠状态,在根状茎上形成1~3个休眠芽。来年春夏之交(5月中旬~6月下旬),当气温回升以后,地下的休眠芽开始萌动,休眠芽萌发后形成的幼芽采集后捆成把即在市场上销售。竹叶菜营养丰富,是理想的减肥保健食品[3-4],其药用价值也很高,全草供药用,性寒,具清热解毒,利尿消肿,润肺等功效。竹叶菜作为一种野生蔬菜,在产区得到了当地土著居民和城市居民的喜爱,但其繁殖系数低、生长慢、目前难以人工栽培,使其进一步的开发利用受到限制。
组织培养可以在短时间内通过少量的植株得到大量的可繁殖幼苗,很好的解决了资源有限、繁殖系数低、生长慢等问题,是竹叶菜资源可持续性利用的最好方法。本研究以带地下根状茎的芽做外植体,探索了竹叶菜的组织培养技术,建立其组培快繁体系,为今后进行竹叶菜规模化地栽培和生产提供种苗及技术贮备,为竹叶菜资源的可持续开发利用奠定基础。
1 材料和方法
1.1 材料
滇西高山竹叶菜(Smilacina atropurpurea),采自云南迪庆。见图1、2。

图1 竹叶菜

图2 竹叶菜地下根状茎
1.2 方法
1.2.1 培养基的配制
以MS为基本培养基,pH 值5.8~6.0,常规法配制。
1.2.2 外植体的消毒
取休眠地下茎上生长的顶芽为初始外植体,见图1、图2。用洗衣粉溶液洗去泥沙,然后加盖纱布在自来水下小水冲洗1 h左右。移到超净工作台上,用75%酒精表面灭菌1 min,0.2%升汞浸泡16~18 min,无菌水冲洗7~10次。
1.2.3 芽外植体的诱导培养
切下顶芽(适当带一小块地下根状茎,以保证芽能成活),接种在诱导培养基上,在温度20~24℃,光照时间13 h/d,相对湿度75% ~85%,光照强度2 000~4 000 lx的环境中进行培养。
1.2.4 诱导芽的继代培养
将丛生芽和新梢切下来,转入继代培养基上进行继代增殖培养。
1.2.5 幼苗的生根
外植体在增殖培养基上培养8~9周后,幼芽成为多分枝的丛生苗,取新梢接种到生根培养基上。
1.2.6 炼苗
先将移栽好的竹叶菜置于培养室中,待有一定适应能力后再完全移至室外,适应后即可移栽至田间进行栽培。
2 结果与分析
2.1 不同激素水平对芽诱导的影响
将顶芽接入诱导培养基,在前述培养条件下培养,芽的生长情况见图4和表1。

表1 芽外植体在不同培养基上的生长情况
从表1可以看出,适合竹叶菜芽外殖体诱导培养的培养基是 D5(MS+6-BA 1.5+NAA 0.05+0.6%琼脂+3%蔗糖)。在D5中,外植体的出芽速度快,有1~2个丛生芽,芽生长健壮(见图3)。
将D1和D4,D5相比,可以看出在竹叶菜芽诱导过程中6-BA配合NAA使用的效果比单独使用6-BA的效果要好,并且6-BA/NAA的比值对芽的诱导有重要影响。如D2中6-BA/NAA的比值为5,D2出芽速度稍慢,丛生芽少;D4中6-BA/NAA的比值为7.5,芽多但出芽速度慢,而且出现基部膨大,有形成愈伤组织的倾向(见图4);D5中6-BA/NAA的比值为30,出芽速度快,芽生长健壮,丛生芽多。说明6-BA/NAA的比值为30时较适合竹叶菜芽的诱导。李合生等[8-9]指出,当分裂素/生长素比值高时,有利于诱导芽的分化,抑制衰老,但比值过高或过低都有碍外植体的生长诱导,无法达到最适宜的程度。由于时间有限,实验未能继续尝试6-BA/NAA的比值高于30的激素配比。
D3中加了GA(赤霉素),芽生长不够健壮,说明在竹叶菜芽诱导培养不宜添加GA。

图3 萌动的小芽

图4 芽基部膨大
2.2 不同激素水平对芽的继代培养的影响
将诱导产生的小芽接入继代培养基,在前述培养条件下培养,促进芽的进一步分化(见图5)。

图5 在三种培养基中的继代情况
从表2可以看出,最适合竹叶菜芽继代培养的培养基是 D2(MS+6 - BA 1.2+NAA 0.05+0.6%琼脂 +3%蔗糖)。在D2中,芽的增殖倍数较高(3.43倍),且出芽速度快,芽生长健壮;幼苗的叶泛绿,幼苗长势好,生长快。D1为适合芽诱导培养基,但在进行继代培养时增殖倍数相对较低,幼苗生长较缓慢。

表2 芽在不同继代培养基上的生长情况
D3出现失绿现象。这可能是6-BA过高的缘故。有研究报道[10],过高的细胞分裂素6-BA会影响小苗的生长,所以在组织培养时要适当降低激素的浓度。D3中6-BA为1.5 mg/L,出现失绿;但D1中所加的6-BA也为1.5 mg/L,叶片却泛绿。这可能是GA增强了6-BA在D3中的实际效果。GA对生长素和细胞分裂素的活性有增效作用[8,9]。由实验可知6-BA浓度为1.2 mg/L~1.5 mg/L时可以保持竹叶菜组培幼苗叶片泛绿。
D3中还出现少量玻璃化现象。引起玻璃苗的可能原因主要集中在培养基水势、激素种类和浓度、离子水平、温度、光照等方面[11-14]。许多学者的研究报告指出,外源激素进入外植体,可能导致其激素含量过高,从而改变外植体内的激素平衡状况。生长素供应过量也会诱导玻璃化[11-15]。本实验中,D3较D1只多加了GA(赤霉素),结果D3中出现了明显的玻璃化,而D1中却没有。这可能是GA(赤霉素)与6-BA,NAA共同作用,增强了6-BA和NAA的效果,导致生长素供应过量。因为目前没有任何报道说GA(赤霉素)会引起玻璃化。
2.3 不同激素水平对幼苗生根的影响
将继代培养产生的,长势较一致的幼苗接入生根培养基,在前述培养条件下培养,诱导幼苗生根。
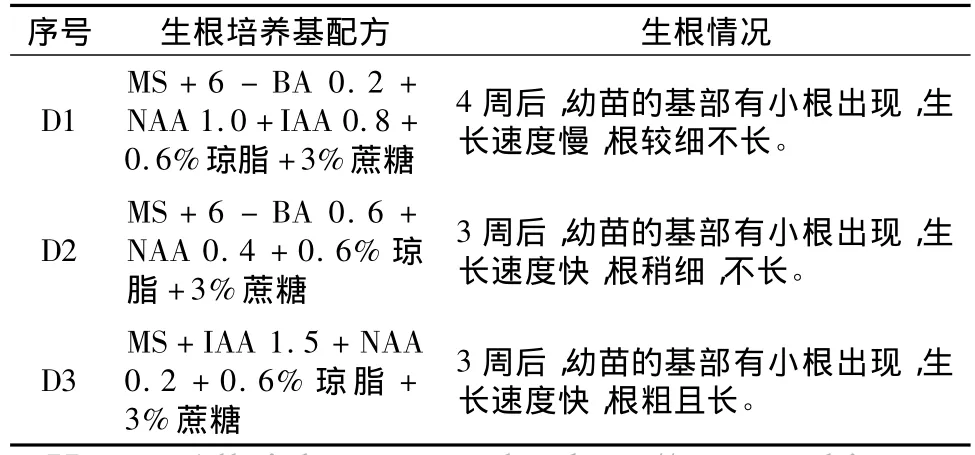
表3 幼苗在不同培养基上的生根情况
从表3还可以看出,NAA与IAA(主要促进细胞伸长,一般不促分裂)配合,比NAA与6-BA配合,以及NAA与IAA和6-BA同时配合,其生根效果要好(见图6)。适合竹叶菜无菌体小苗生根的培养基是 D3(MS+IAA 1.5+NAA 0.2+0.6%琼脂 +3%蔗糖)。在D3中,幼苗易生根,根粗且长,且生长速度快(见图7)。李合生等指出NAA可以促进细胞伸长和细胞分裂,有促进生根的作用[8,9]。NAA可配合6-BA使用,当6-BA/NAA比值低时,有利于根的分化。

图6 小苗在生根培养基中的生长情况

图7 小苗在D3培养基中的生根情况
3 讨论
在以竹叶菜的顶芽为外植体的组织培养过程中,适合竹叶菜芽诱导的培养基是:MS+6-BA 1.5+NAA 0.05+0.6%琼脂+3%蔗糖;继代培养基是:MS+6 -BA 1.2+NAA 0.05+0.6% 琼脂 +3%蔗糖;生根培养基是:MS+IAA 1.5+NAA 0.2+0.6%琼脂+3%蔗糖。
繁殖中间体的诱导一般可通过三条途径:器官发生途径、愈伤组织诱导及分化再生途径、胚状体发生途径[16-18]。考虑到竹叶菜叶的角质层较厚,叶较硬,不适合用于诱导愈伤组织,而且产生愈伤组织的周期较长,愈伤组织诱导及分化再生过程中易发生变异,近年来人们对由愈伤组织分化出苗会带来变异的担心在不断增加。所以本试验选用带地下根状茎的芽作为外植体进行组织培养,通过以芽生芽,形成丛生芽,从而建立繁殖中间体。一般来说,只要培养基适合,用腋芽或顶芽作外殖体比较容易成功[16,19]。
在外植体培养过程中污染较为严重,污染率达30% ~40%。分析其原因,可能是:竹叶菜的植株较大,地下茎上覆土较多且长有大量的须根,将须根除去才好彻底清洗和消毒。但这会使外植体上留下切口,细菌从切口侵入,造成污染;其外植体较大,在灭菌过程中易出现灭菌不彻底;外植体在培养过程中出现很多的内生细菌,使得灭菌更加困难。如果要得到很好的组织培养效果,就需要在外植体取材方面进行着手,尽量获得比较细嫩且健壮的外植体;在清洗时要尽量先清洗干净再除须根;提高升汞浓度,延长升汞处理时间,尽可能彻底地灭菌(经过不断摸索,发现用0.2%升汞浸泡16~18min的灭菌效果是最好的);接种时每瓶所接芽数不宜多,最好不超过3个,通过降低污染概率来降低污染率;发现瓶内有内生菌时,对尚未被污染的外植体要及时地转接;还要求操作人员操作正确、熟练,避免操作过程中造成污染。
竹叶菜的芽具有较强的休眠性,在实验过程中曾试图用GA(赤霉素)打破芽的休眠。但从实验结果来看,在竹叶菜组织培养过程中,不宜在培养基中添加GA(赤霉素),添加虽然可以在一定程度上提高出芽率和出芽速度,但会使芽生长不够健壮,幼苗出现失绿和玻璃化现象。
经过几次继代培养后,幼芽成为多分枝的丛生苗,再继代分化时分化速度和分化率都降低,增殖的速度减慢。这时应及时继代,以免组织老化[19]。同时将可以生根的幼苗转接到生根培养基。
炼苗时,要注意仔细洗去附着在幼苗根部上的培养基,将生根幼苗移植在采自竹叶菜生境地的土壤上,刚开始的时候周围温度与培养时温度的差值不能超过5℃。逐步降低周围的温度,直到移栽幼苗适应室温。管理过程中每隔两天要浇一次水,但每次浇水不能多,以免烂根。这是移栽成活的关键。通过试验和观察、统计,发现在组培过程中竹叶菜的生长周期长、生长比较缓慢;喜爱低温、高湿度、短光照的生长环境。
致谢:云南大学李宗菊老师和云南省农业科学院严家云老师对本实验给予了大力支持和帮助,在此表示感谢。
[1] 赵金光,韦旭斌,郭文场.中国野菜[M].吉林:吉林科学技术出版社,2004:329-332.
[2] 普迎冬,杨永平.滇西高山野蔬——竹叶菜[J].植物杂志,1998(6):25-26.
[3] 桂明英,李宗菊.竹叶菜不同处理样品营养成分比较[J].吉首大学学报,2000,21(2):55 -57.
[4] 桂明英,陈标.竹叶菜营养价值及其开发利用[J].广西植物,2000,20(1):71 -74.
[5] 朱建龙.山珍竹叶菜产品的开发加工[J].食品工业科技,2000(1):10-11.
[6] 王晓岚.铃兰的组织培养[J].牡丹江师范学院学报,2005(1):8-9.
[7] 许继红,马玉芳.药用植物组织培养技术[M].北京:中国农业科学技术出版社,2003:308-309.
[8] 李倩中.彩色马蹄莲组培技术[J].江苏农业科学,2003(6):86-87.
[9] 李瑶,王利华,叶鸣明,等.影响香石竹试管苗玻璃化的因素[J].植物生理学通讯,1997,33(4):256 -258.
[10] 程家胜,史永忠,张志云,等.苹果组织培养中的玻璃苗问题[J].植物生理学通讯,1990(1):33-35.
[11] 王家旺,罗鹏,廖衍慧.MS和B5培养基对油菜茎尖培养中玻璃化作用的影响[J].植物生理学通讯,1990(3):35-36.
[12] 周菊华,林证明,梁海曼.控制瑞香试管苗玻璃化的研究[J].园艺学报,1990,17(3):229 -232.
[13] 梁海曼,周菊华.试管苗玻璃化现象的生理生化和机理探讨[J].武汉植物研究,1994,12(3):281 -285.
[14] 吕复兵,朱根发,陈明莉.芦荟的组织培养与快繁技术[J].北方园艺,2000(4):32-33.
[15] 赵庆芳,曾小英,丁兰,等.晶体百合组织培养及快速繁殖的研究[J].甘肃科学学报,2003(1):39-42.
[16] 陈俊愉,程绪珂.中国花经[M].上海:上海文化出版社,1990:67.
[17] Meyer H J,Van staden J.Rapid in vitro propagation of Aloe barbadensis Mill.[J].Plant Cell,Tissue and Organ Culture,1991,26(3):167-171.
[18] Hirimburegama K,Gamage N.In vitro multiplication of Aloevera meristem tips for mass propagation[J].Horticultral Science,1995,27(3):15 -18.
[19] 冷肖荀,王青华.百合的组织培养[M].北方园艺,1999(6):59.
