蒽酮—硫酸法测定菊花多糖方法的研究
2013-12-09李文超王龙阁王保伟顾有方陈会良
李文超,王龙阁,王保伟,顾有方,陈会良
研究表明许多中药中的多糖类成分具有多种药理活性,如香菇多糖、灵芝多糖、猪苓多糖等具有抗肿瘤的作用,黄芪多糖和人参多糖等具有增强免疫的作用,因此,多糖的研究已引起国内外医药界的重视。多糖通常是由D-葡萄糖,D-半乳糖,L-阿拉伯糖,L-鼠李糖等聚合而成,由于糖类在强无机酸中为特有的脱水反应生成醛类,它们和各种酚类缩合产生特有的有色物质,因此常用硫酸-苯酚法和硫酸-蒽酮法作为多糖的含量测定方法,但由于不同植物多糖含量等不同,所以在测定多糖含量时,要对该方法各指标进行优化,以适应不同植物多糖测定的需要。
菊花为菊科多年生草本植物的头状花序。其味甘、性寒,历来就是中医临床上应用广泛的大宗中药材。具有清肝明目,清热解毒,散风降压的功效,可防治感冒、菌痢、肠炎、便秘、冠心病、高血压等多种疾病[1-3],具有极高的药用价值,又可广泛用于保健茶饮。目前,国内外对菊花研究多集中于菊花黄酮[4-5]、绿原酸[6]、挥发油[7]和微量元素[7]等有效成分的提取分离及应用研究,而对菊花中多糖的研究却较少,尤其是对菊花多糖含量的测定方法的研究尚未见报道。本文拟研究蒽酮 - 硫酸法[4-7]测定菊花多糖含量时各因素对结果的影响,并对这些因素进行优化,为菊花多糖含量测定的研究提供基础资料。
1 材料与方法
1.1 材料与试剂
菊花粗多糖,由本实验室提取后保存。葡萄糖(105℃恒温烘干至恒重)、苯酚、浓硫酸等试剂均为国产分析纯。
标准储备液的配制:精密称取105℃干燥至恒重的D-无水葡萄糖0.100 0 g置于100 mL容量瓶中,加水溶解并稀释至刻度摇匀,即配得1 mg/mL的的葡萄糖标准储备溶液备用。
标准使用液的配制:精密吸取葡萄糖标准储备液 0、0.5、1.0、2.0、3.0、4.0 和 5.0 mL,置于 50 mL容量瓶中,加水至刻度,摇匀。即得 0、10、20、40、60、80和100μg/mL的标准葡萄糖使用液备用。
供试样品溶液的配制:准确称取菊花粗多糖(0.01 g)放入250 mL三角瓶中加适量蒸馏水,然后在沸水浴上加热溶解,冷却后转入250 mL容量瓶定容至刻度摇匀,即得供试样品溶液。
1.2 仪器与设备
BS224S型电子天平(赛多利斯科学仪器有限公司),DK-B600型恒温水浴锅(上海三发科学仪器有限公司),微量移液器(上海求精生化试剂仪器有限公司),Uvmini1240紫外-可见光分光光度计(日本岛津)。
1.3 方法
1.3.1 测定波长的选择
分别量取标准使用液(40μg/mL)、供试样品溶液各1.0 mL,以标准曲线制备方法显色后,用 Uv mini1240紫外-可见分光光度计于500~700 nm波长范围内每隔4 nm扫描一次,以确定最佳测量波长
1.3.2 显色温度的选择
分别吸取标准使用液和供试样品溶液1.0 mL于试管中,依次加入蒽酮1.0 mL、浓硫酸4.0 mL,摇匀,分别在40、60、80和100℃下加热10 min,冰浴静置40 min,然后按照1.3.1确定的波长测定吸光度,确定最佳显色温度。
1.3.3 显色时间的选择
分别吸取标准使用液和供试样品溶液1.0 mL于试管中,依次加入蒽酮1.0 mL、浓硫酸4.0 mL,摇匀,在1.3.2 确定的温度下分别加热 0、5、10、15、20、25和30 min。取出冰浴静置40 min,然后取出按照1.3.1确定的波长测定吸光度,确定最佳显色时间。
1.3.4 标准曲线的制备
准确吸取1 mL 的10、20、40、60、80 和100 μg/mL的标准葡萄糖使用液分别置于6个干燥的试管中,依据1.3.1 -1.3.3 确定的测定条件,测其吸光值。
1.3.5 精密度实验
对样品和标准液(40μg/mL)1.0 mL各6份,按照标准曲线制备方法测定吸光度。
1.3.6 回收率实验[9]
分别吸取标准使用液(40μg/mL)0.50 mL于5个干燥的试管中,各加入同一样液 0.1、0.2、0.3、0.4、0.5 mL,补水至 1 mL,按标准曲线制备方法测定其吸光度。

1.3.7 稳定性实验
精密量取标准使用液和供试样品溶液各1 mL,按照标准曲线制备方法每隔20 min测定其吸光度。
2 结果与分析
2.1 测定波长的选择
标准使用液与供试样品溶液比色后用紫外可见分光光度计500~700 nm波长范围内扫描,结果见图1。标准使用液和供试样品溶液在644 nm处均有最大吸收,所以选择644 nm为测定波长。
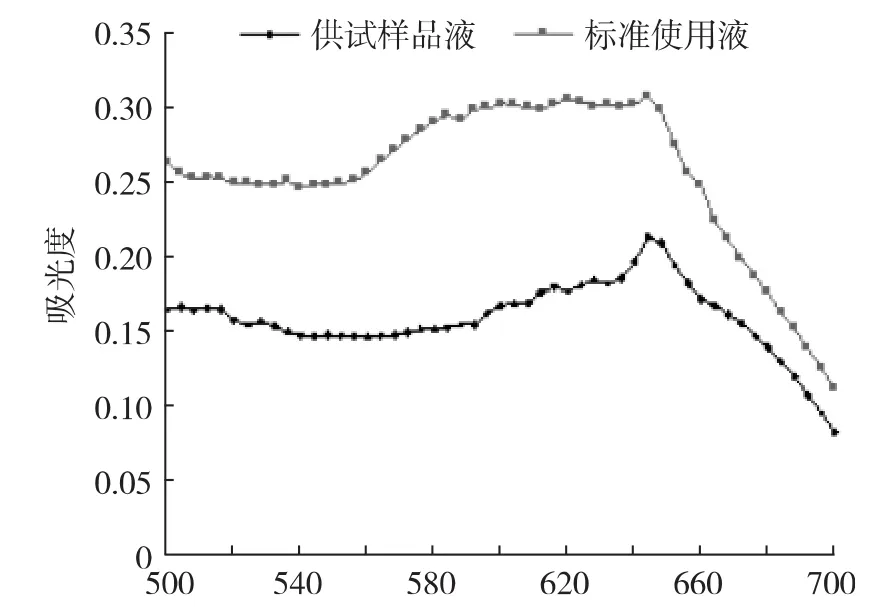
图1 最佳测定波长的确定
2.2 显色温度的选择
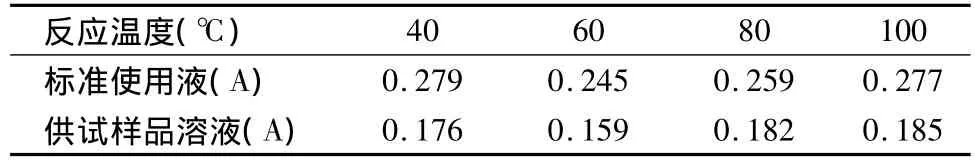
表1 不同温度下的吸光度
由表1可知,随着反应温度的升高吸光度有先减少后增大的趋势,分析沸点温度时吸光度增大可能是显色液由于长时间高温条件下水分蒸发使浓度增大所至。所以选择条件温和且吸光度较高的40℃作为最佳显色温度。
2.3 显色时间的选择
由图2可知,加热15 min后标准使用液和供试样品溶液的吸光度趋于平缓,所以选择15 min为最佳显色时间。
2.4 标准曲线的制备
以葡萄糖质量浓度(X,μg/mL)为横坐标,吸光度(Y)为纵坐标,绘制吸光度-葡萄糖质量浓度的关系曲线,其线性回归方程为 y=0.062x+0.025,相关系数r为0.988 3。结果表明,葡萄糖在0~100 μg/mL范围内其浓度与吸光度线性关系良好,符合要求,如图3所示。

图2 不同显色时间吸光度的比较

图3 葡萄糖标准曲线
2.5 精密度实验
由表2可知,标准使用液和供试样品溶液重复测定6次的RSD值分别为1.422 4%和2.202 8%,表明仪器的精密度良好和操作较规范。
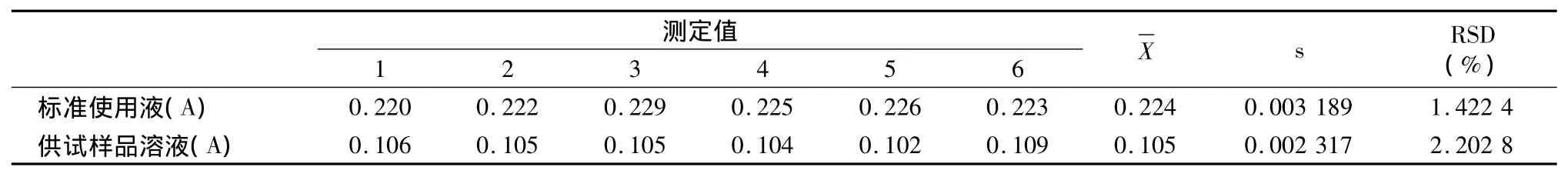
表2 精密度测定实验结果
2.6 加样回收率实验
由表3可知,该实验方法的平均回收率为88.95%,RSD为8.09%,表明该方法的回收率一般。
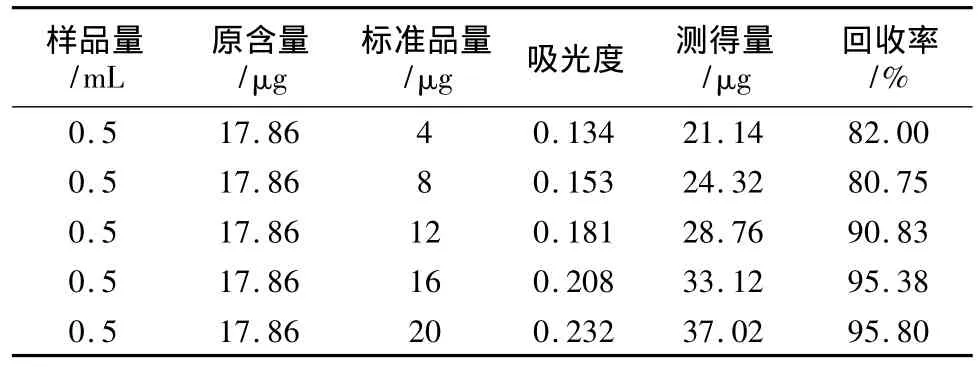
表3 加样回收率测定结果
2.7 稳定性实验
由表4可知,标准使用液的RSD为0.629 2%,供试样品溶液的RSD为1.667 4%,表明显色液在120 min内的稳定性良好。但方法简单、快速,无需多糖纯品和高级仪器,因而被广泛采用[10],目前在菊花多糖的含量测定报道较少,仅见用后者硫酸-苯酚法的报道,而蒽酮-硫酸法测定菊花多糖含量的报道尚未见到。

表4 稳定性实验结果
本研究首次对测定菊花多糖含量的蒽酮-硫酸法进行了优化,以确定最佳测定参数,结果显示蒽酮-硫酸法测定菊花多糖含量的最佳测定波长为644 nm,显色的温度为40℃、显色时间定为15 min。粗多糖含量在10~100μg/mL之间与吸光度成很好的线性关系。回归方程y=0.062x+0.025,相关系数 r为0.988 3。实验方法的平均回收率为88.95%,RSD为8.09%。显色液在120 min内稳定性好。
蒽酮-硫酸法在无对照品又不具备高效液相色谱仪的情况下,采用本法具有方法简单、易掌握、结果准确、快速等优点,对生产上检测多糖含量,具有实用价值。
3 小结与讨论
多糖的检测方法一般可分为二大类,一类是直接测定多糖本身,如高效液相色谱法和酶法。另一类是利用杨酸法、斐林法、硫酸-苯酚法、蒽酮-硫酸法等。前者测定方法准确,有效成分清晰,但需昂贵的仪器、多糖纯品和特定的酶,操作步骤繁琐,在应用中受到限制。后者虽然测定结果灵敏度有限,
[1] 彭少平,芦金清.金菊花的化学成分研究[J].中草药,2006,37(1):38-41.
[2] Kim IS,Koppula S,Park PJ,et al..Chrysanthemum morifolium Ramat(CM)extract protects human neuroblastoma SH-SY5Y cells against MPP+ - induced cytotoxicity[J].J Ethnopharmacol,2009,126(3):447 -454.
[3] Duha PD,Tua Y Y,Yen G C.Antioxidant Activity of Water Extract of Harng Jyur(Chrysanthemum morifolium Ramat)[J].Lebensmittel-Wissenschaft und-Technologie,1999,32(5):269 -277.
[4] 秦大伟,李树英,孟霞,等.微波预处理提取嘉菊总黄酮的工艺研究[J].中成药,2008,30(6):545 -548.
[5] 贾凌云,孙毅,王春阳,等.菊花总黄酮提取工艺研究[J].中药材,2003,26(1):35 -37.
[6] 周志祥,魏俊德.高效液相色谱法测定菊花中绿原酸含量的方法改进[J].时珍国医国药,2006,17(11):2221 -2222.
[7] 官艳丽,邹多生,王燕军,等.安徽产菊花脑挥发油成分分析[J].中成药,2007,29(6):914 -916.
[8] 赵西梅,肖忠峰,李锐,等.FAAS测定3种菊花茶中8种金属元素的含量[J].食品研究与开发,2008,29(8):123 -126.
[9] 任成忠.加表回收实验的实施及回收率计算的研究[J].工业安全与环保,2006,32(2):9 -11.
[10] 刘桂萍.冬虫夏草多糖测定方法的研究进展[J].药学实践杂志,2008,26(1):53-54.
