HIFU联合微泡消融兔肝VX2肿瘤:残瘤检测的病理及影像对比实验研究
2013-12-06何炜,王维,彭松
何 炜,王 维,彭 松
(中南大学湘雅三医院1.超声科;2.放射科,湖南 长沙 410013)
高强度聚焦超声(high intensity focused ultrasound,HIFU)是超声医学领域近十余年发展起来的一项无创治疗新技术,其利用体外分散发射的超声波,通过水、介质、皮肤在体内肿瘤部位聚焦,在焦点区域形成瞬间局部高温和空化损伤,将肿瘤细胞消融,而在焦点区域之外的部位则温度升高很低,因此对周围组织无损伤[1-2]。然而,HIFU的临床疗效因受到一些影响因素的干扰而减低,如肋骨及胃肠气体遮挡、辐照时间过长、肿瘤血供丰富等,均可能降低靶区HIFU能量或者增加辐照通道组织的能量沉积,从而导致一系列并发症,如皮肤烧伤、胃肠道穿孔及残瘤等[3-4]。
联用超声微泡造影剂增强HIFU消融肿瘤效果是当前研究热点之一[2,5-6],准确评估消融范围及识别残瘤对临床有重要指导意义。造影剂增强螺旋CT(CECT)是临床认可的热消融术后检测残瘤的金标准[1],许多研究表明,超声造影(CEUS)可以敏感、准确和实时地检测肿瘤滋养血管[6-7]。但目前尚未见HIFU联合微泡消融兔肝VX2肿瘤后CEUS同CECT检测残瘤能力的对比实验研究。为此,本研究拟探讨单纯HIFU同HIFU联合微泡消融兔肝VX2肿瘤的残瘤发生率以及评估CEUS和CECT检测残瘤的能力。
1 材料与方法
1.1 主要仪器 FEP-BY02型高能聚焦超声肿瘤治疗机(北京源德生物医学工程有限公司生产);ALOKA Prosound α10 和 ACUSON Sequoia 512型彩色多普勒超声诊断仪,浅表探头,频率 7~10 MHz,配备造影成像软件;Philips Brilliance 64排螺旋CT,MEDRAD双筒高压注射器等。
1.2 实验动物 清洁级健康新西兰大白兔40只(中南大学湘雅医学院动物学部提供),雌雄不限,体质量2.5 ~3.0 kg;股内侧皮下 VX2 种植瘤种兔1只(武汉大学附属协和医院放射科惠赠)。
1.3 兔肝VX2肿瘤模型建立 以3%戊巴比妥钠按1.0 ml/kg体重经兔耳缘静脉注射麻醉。以8%硫化钠脱去腹部肝区体毛,外用生理盐水洗净,剑突下正中切口,暴露肝左中叶。以眼科镊在肝表面刺1个深约1 cm的隧道,压迫止血备用。从VX2荷瘤种兔体内取出有活力的肿瘤组织,无菌生理盐水漂洗,修剪成约2 mm3的组织块。将1~2个修剪好的组织块植入隧道内,肝包膜破口用修剪好的小薄片明胶海绵封堵。然后,顺序缝合腹膜、肌层和皮肤。肿瘤植入后,饲养兔14 d即可用于实验。
1.4 实验动物分组 40只荷瘤兔随机分为假照组(n=10)、单纯HIFU组(n=15)和HIFU联合微泡组(n=15)。
1.5 影像学检测 HIFU消融前后3 h内完成CEUS和CECT检查。每次检查前动物禁食12 h,不禁水。首先使用24G静脉留置针置入家兔耳缘静脉内建立血管通路,胶布固定后备用。将荷瘤兔全麻并固定在检查台上,系腹带控制腹部呼吸运动幅度。
1.5.1 CEUS检查 造影前二维超声多方位扫查兔肝肿瘤,测量最大径(cm)。采用Bracco公司超声造影剂SonoVue,按说明书配制,每次使用剂量为0.2 ml/kg,经家兔耳缘静脉团注,继而注射2 ml生理盐水冲管。所有调节参数(深度、聚焦、总增益、TGC等)保持不变,设定机械指数<0.11,使用1 ml注射器行团注同时启动计时器。小幅度侧动探头观察全瘤增强特征。所有影像均存储于主机硬盘内。待CEUS完毕后立即行MDCT。
1.5.2 CECT 检查 Philips Brilliance 64 排螺旋CT扫描,探测器组合:0.625 mm×64;高压注射器:MEDRAD双筒高压注射器;图像后处理工作站:Mxview 2.1工作站;对比剂:非离子型对比剂碘海醇(350 mg/ml)。Pitch值为1.172,FOV 为 96 mm,Matrix 为 512,Rotation time 为 0.4 s,层厚 2.5 mm,非螺旋扫描,120 kV,80 mA,360 度旋转时间 1.2 s,每转扫描时间0.75 s,扫描50次,扫描总时间60 s。将对比剂自静脉套管从双筒高压注射器A管以1.5 ml/s速率注入,剂量为2 ml/kg,注射完毕后B管以同速率注入10 ml生理盐水。先行常规全肝平扫,确定病灶及感兴趣区的范围及层面,于造影剂注射后延迟1 s开始扫描。图像存储于主机硬盘。
1.6 HIFU消融 治疗参数:输出电功率200~600 W,单元发射时间(t1)为 0.15 s,占空时间(t2)为0.2 ~0.4 s,单点次数(T)为 30 ~50次。各参数可根据所治疗肿瘤的位置及层次深浅、肿瘤组织密度及超声衰减率适当进行调整,在实际治疗中的治疗点划分和焦点的位移均由计算机控制完成。实时超声显示辐照点变为强回声并且持续至少2 min为发生局部凝固性坏死的标志,可以转为下一点的消融[6]。
假照组:关闭治疗功率源,假照30 s后中止治疗。单纯HIFU组:经机载超声监控系统准确定位肿瘤后,开始辐照。HIFU联合微泡组:经耳缘静脉快速团注0.2 ml SonoVue微泡,15 s后开始辐照。记录单纯HIFU组和HIFU联合微泡组的剂量参数:辐照点数(n)、辐照时间(t=n×t1)及电功率。
1.7 组织病理学检查 第2次影像学检查完毕之后,即刻注射过量麻药处死实验动物,剖腹观察有无照射通道损伤、胃肠穿孔、肝破裂等并发症,取出肝脏,将肿瘤组织及瘤周5 mm肝组织取材切割为4~5块,浸泡于10%福尔马林溶液24 h后石蜡包埋,多方位多点切片,行光镜及电镜检查判断组织消融情况及有无残瘤。
1.8 统计学方法 采用SPSS 11.5统计软件包进行数据分析,计量资料以均数±标准差表示,以P<0.05为差异有统计学意义。各组间CEUS和CECT的不同增强模式构成比较采用χ2检验,各组间剂量参数比较采用成组设计t检验,消融后CEUS和CECT对残瘤的检测及其同病理的一致率采用χ2检验确切概率法。
2 结果
2.1 消融前CEUS和CECT观察各组肿瘤的血供情况 40灶兔肝VX2肿瘤在消融前CEUS和CECT分别表现为2种动脉相增强模式(表1)。CEUS对整体增强模式的显示率明显高于 CECT(77.5%vs 52.5%),而 CECT 对厚环状增强模式的显示率明显高于CEUS(47.5%vs 22.5%),二者比较差异有统计学意义(χ2=10.263,P=0.001)。

表1 40灶兔肝 VX2肿瘤消融前 CEUS和CECT增强模式比较Table 1 Comparison of enhancement patterns of CEUS and CECT in 40 rabbit VX2 tumors (例)
假照组、单纯HIFU组和HIFU联合微泡组肿瘤大小分别为(1.48 ±0.20)cm、(1.47 ±0.25)cm 和(1.47 ±0.16)cm,各组间比较差异无统计学意义(F=0.016,P=0.985)。假照组中CEUS显像6例呈弥漫性增强,4例呈厚环状增强;而CECT显像5例呈弥漫性增强,5例呈厚环状增强。单纯HIFU组中CEUS显像13例呈弥漫性增强,2例呈厚环状增强;而CECT显像7例呈弥漫性增强,8例呈厚环状增强。HIFU联合微泡组中CEUS显像12例呈弥漫性增强,3例呈厚环状增强;而CECT显像9例呈弥漫性增强,6例呈厚环状增强。各组间CEUS和CECT的不同增强模式构成比较差异无统计学意义(χ2=2.533,P=0.307 和 χ2=0.568,P=0.788)。所有肿瘤均为动脉相富血供,门脉相造影剂迅速廓清,呈“快进快出”。
2.2 HIFU联合微泡消融兔肝VX2肿瘤的剂量参数 HIFU联合微泡组的平均辐照时间、辐照点数及电功率均较单纯HIFU组为低(P<0.01,表 2)。
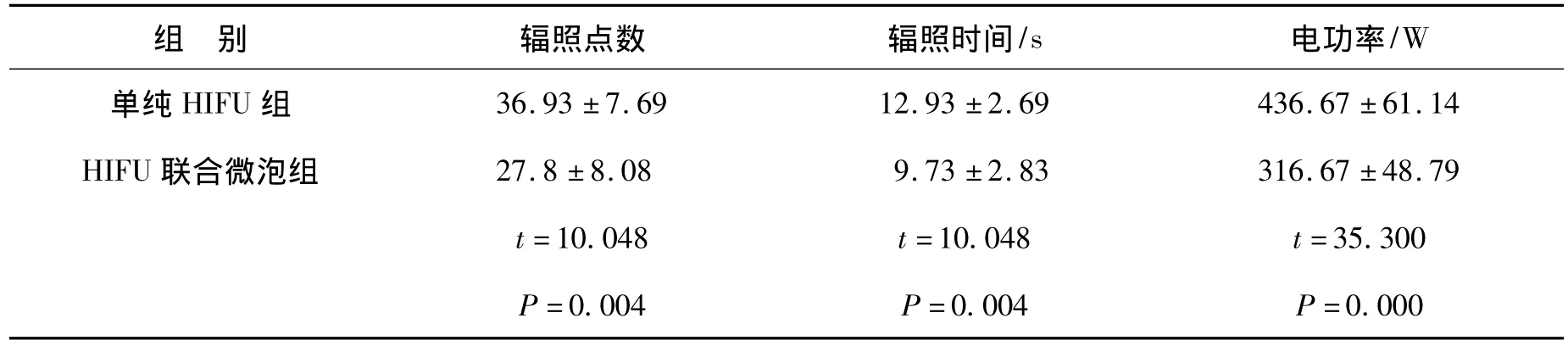
表2 单纯HIFU组和HIFU联合微泡组剂量参数比较Table 2 Comparison of HIFU dose parameters between HIFU group and HIFU+microbubble group
2.3 消融后CEUS和CECT对残瘤的检测及其同病理的一致率 本研究三组均顺利完成HIFU辐照,其中假照组影像学无明显变化,病理组织学显示肿瘤内丰富的微血管形成,仅有2例肿瘤中心有小片液化性坏死存在;单纯HIFU组主要表现为凝固性坏死,组织结构轮廓存在;而HIFU联合微泡组肿瘤细胞浆及组织间隙内出现了大量的空化泡,组织结构崩解消失。单纯HIFU组残瘤率为60.0%(9/15),HIFU联合微泡组为13.3%(2/15),二者比较差异有统计学意义(P<0.05,表3)。
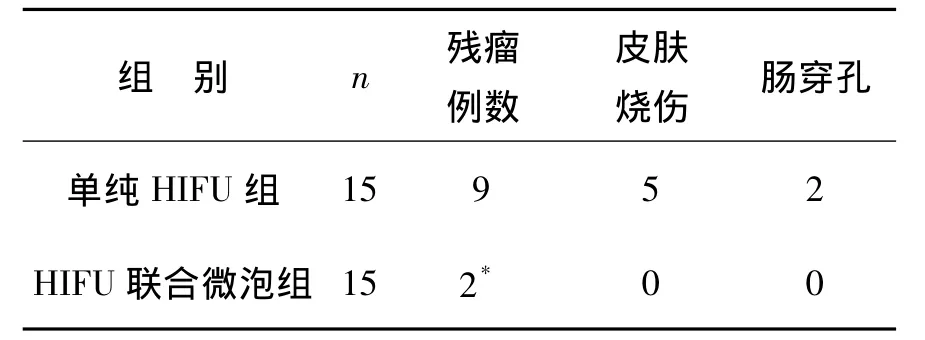
表3 单纯HIFU组和HIFU联合微泡组辐照后并发症比较Table 3 Comparison of complications between HIFU group and HIFU+microbubble group (例)
CEUS和CECT对完全消融者表现为肿瘤区域无造影剂进入,呈“黑洞征”;对有残瘤者,CECT表现为肿瘤内局灶异常增强信号,CEUS表现为肿瘤内局部残存微血管显像,呈“枯枝样”(图1和2)。CEUS和CECT检测残瘤同病理诊断的一致率分别为81.8%和27.3%,二者比较差异有统计学意义(P<0.05,表4)。
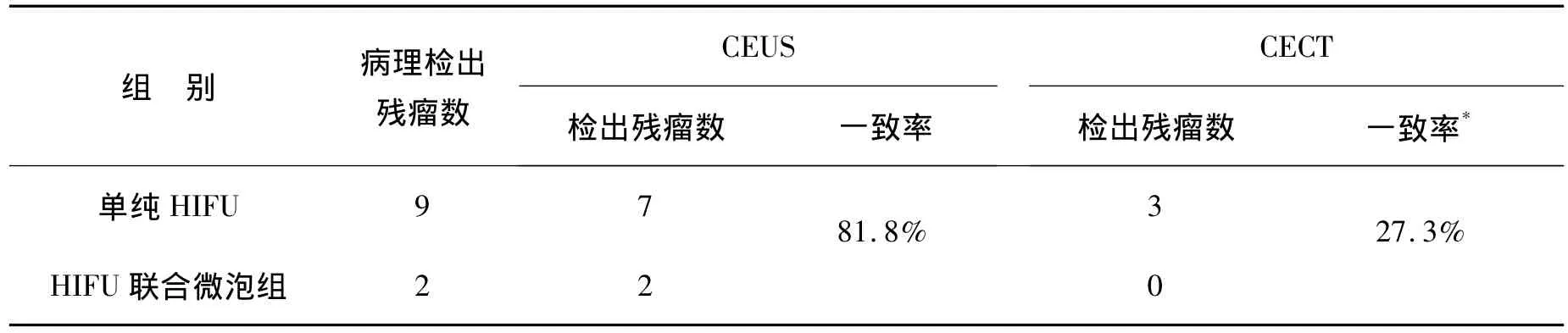
表4 CEUS和CECT检测残瘤同病理一致率的比较Table 4 Comparison of concordance rate of residual tumor between CEUS and CECT with pathology
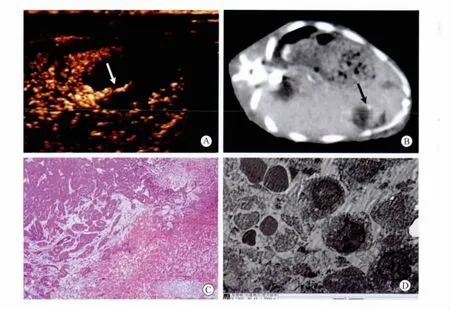
图1 单纯HIFU组消融后CEUS、CECT与组织病理变化Fig.1 CEUS,CECT and pathohistologic apperance in HIFU group
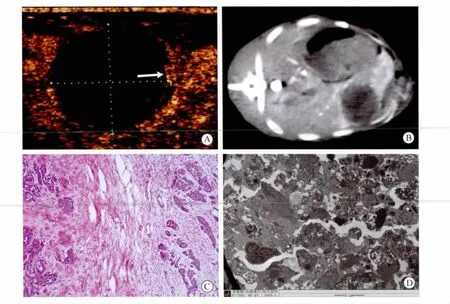
图2 HIFU联合微泡组消融后CEUS、CECT与病理组织变化Fig.2 CEUS,CECT and pathohistologic apperance in HIFU+microbubble group
3 讨论
HIFU是近年来发展迅速的一项无创性肿瘤消融术,主要利用热效应和空化效应等对组织产生的凝固性坏死和空化机械损伤等原理,研究表明其与肝切除术疗效相当[2,8]。目前HIFU的临床疗效因受到一些影响因素的干扰而减低,如肋骨及胃肠气体遮挡、辐照时间过长、肿瘤血供丰富等,均可能降低靶区HIFU能量或者增加辐照通道组织的能量沉积,从而会导致一系列并发症,如皮肤烧伤、胃肠道穿孔及导致残瘤等[3-4]。造成肿瘤凝固性坏死体积的大小取决于两方面因素:①HIFU治疗剂量;②活体生物组织的生物学特性[8]。提高HIFU治疗剂量虽然可以增加靶区的凝固性坏死体积,全面彻底的消融病灶,但是不可避免的会产生一系列严重并发症,如皮肤烧伤、胃肠道穿孔及腹膜粘连等[3-4]。通过改变活体组织的生物学特性以提高HIFU作用效率是当前研究的热点,而经周围静脉注射可使超声造影剂微泡迅速到达血供丰富的肿瘤内部及其周围组织,引入外源性空化核,使其组织声环境得以改变,具有良好的增效性[2,5-6]。
兔肝VX2肿瘤血供丰富且主要由肝动脉滋养[9],同人类肝细胞癌具有相似的血供特征,因此成为肝癌基础研究中最重要、最常用的动物模型之一[10]。本研究40灶兔肝VX2肿瘤模型均为移植后14 d,属于早期阶段,CECT和CEUS均显示其为动脉期富血供,之后快速消退,假照组的病理结果也显示肿瘤内丰富的滋养微血管形成,同影像结果一致。而CEUS和CECT对两种增强模式:整体增强和厚环状增强的显示率不同,本研究认为,CEUS所反映的兔肝VX2肿瘤血供状态较CECT更加真实,分析原因可能与这两种影像手段成像原理不同有关。CECT只是以固定的时间间隔进行的非连续性扫描,可能错过增强过程中一些稍纵即逝的动态变化特征;而CEUS为实时动态显像,可实时观察并追踪肿瘤的滋养血管,动态显示造影剂进入肿瘤及周围肝实质直至消退的完整过程,可更好的显示肿瘤新生动脉血管的血流灌注特点[6,7,11]。由于团注造影剂后在肝动脉首过供血时间短暂,加之早期兔肝VX2瘤恶性程度高,滋养微血管大量形成且发育不成熟[12],使得造影剂可以通过动静脉或门静脉-肝静脉“短路”途径快速廓清,因此动脉相持续时间亦短暂,CECT可能错过短暂的最佳成像的时间,而对其之前的不完全增强或者之后的消退开始成像,即多表现为厚环状增强。而CEUS能够完整的捕捉肿瘤整体增强的瞬间,对于本研究早期实性富血供的兔肝VX2肿瘤而言,即多表现为整体弥漫性增强。
本研究结果显示,HIFU联合新型的超声造影剂微泡SonoVue对兔肝VX2肿瘤的治疗安全、有效、可行。为达到即刻的HIFU治疗效果[6],HIFU联合微泡组的剂量参数均明显低于单纯 HIFU组,并且无明显并发症,提示SonoVue微泡有显著增强HIFU的作用效应。本研究还显示,单纯HIFU组的残瘤率较HIFU联合微泡组明显高(P<0.01),分析原因:兔肝VX2肿瘤中央部位的血管多为管径较细小的滋养血管,因此单纯HIFU组的主要作用机制热效应可以对其有效破坏,而肿瘤边缘部位血管多为自周边肝脏组织伸入的较大管径的滋养血管,其内血流速度较快,会很快将局部热量带走,热效应对其难以产生效果,而HIFU联合微泡组对较大管径的滋养血管及毛细血管均可有效破坏,也提示了机械空化效应可能为主要作用原理。病理组织学显示,HIFU联合微泡组肿瘤细胞浆内出现了大量的空化泡,组织结构崩解破坏,提示其增效机制可能与外源性微泡导致空化及机械损伤增强有关。本研究从组织病理学角度也充分证实,HIFU联合微泡组的残瘤形成明显少于单纯HIFU组,且无明显并发症,提示HIFU联合微泡可以显著提高兔肝VX2肿瘤的消融效果。两组均有不同程度残瘤的发生可能还与实验动物治疗时呼吸幅度控制不好有关,造成了焦点的偏离。提示无论用何种手段进行治疗,单次HIFU辐照尚不能造成组织的完全消融,需要多次治疗才能取得更好的疗效。
本研究结果显示,CEUS对残瘤的检出率高于CECT,同病理组织学的一致率明显高于CECT。分析原因,可能与CEUS使用14 MHz的高频探头,而兔肝VX2肿瘤距离体表表浅且直径较小(<2 cm)有关,这样可以进行实时高分辨率造影成像,可以清晰的追踪微泡在肿瘤微血管内的流动状态。CEUS使用低机械指数发射声束,SonoVue微泡在声束作用下发生连续共振而不会破裂,接收返回的二次谐波信号即可编码高分辨成像。微泡可在微循环中持续存在长达数分钟,使CEUS具备充裕的时间观察。注射后首次到达兔肝VX2肿瘤滋养血管是浓度最高的实相,成像最佳,之后虽然有所消退但仍可清晰显像。因此,在动脉相如果CEUS于一个切面上发现有残瘤微血管断面,之后的时相内小幅度侧动探头就可对其在肿瘤内的走行及增强情况进行实时追踪显像,完整的评估残瘤范围。
CECT对HIFU治疗后残瘤的检出率较低,而且同病理诊断的一致率较差,本研究认为原因如下:①相对于较小的兔肝VX2肿瘤(<2 cm),CECT成像分辨率欠佳;②造影剂循环存在个体差异,很难判断何时肿瘤内造影剂达峰值,而固定间隔的非连续扫描往往会错过残瘤增强的最佳时间;③残瘤内血管细小、分支较少时,CECT分辨困难。还有研究表明,热消融术后早期观察即刻疗效,CECT出现周围边缘增强伪像的发生率要明显高于CEUS,这会大大干扰对即刻疗效的评估,进而会影响是否二次消融的决断[13]。此外,本研究认为 CEUS较CECT操作简便,耗时少,可以在消融术后HIFU治疗台旁进行,可以准确的指导评估消融效果及是否需要即刻对残瘤部位补充消融,这些优点是CECT暂时所无法取代的。
综上,HIFU联合超声造影剂微泡SonoVue可以显著提高兔肝VX2肿瘤的消融效果,CEUS检测残瘤的能力优于CECT,对于应用于临床的价值还有待于进一步的研究。
[1]ILLING R O,KENNEDY J E,WU F,et al.The safety and feasibility of extracorporeal high-intensity focused ultrasound(HIFU)for the treatment of liver and kidney tumours in a Western population[J].Br J Cancer,2005,93(8):890-895.
[2]LUO W,ZHOU X,YU M,et al.Ablation of highintensity focused ultrasound assisted with SonoVue on Rabbit VX2 liver tumors:sequential findings with histopathology,immunohistochemistry,and enzyme histochemistry [J].Ann Surg Oncol,2009,16(8):2359-2368.
[3]LI J J,GU M F,LUO G Y,et al.Complications of high intensity focused ultrasound for patients with hepatocellular carcinoma[J].Technol Cancer Res Treat,2009,8(3):217-224.
[4]WUF,WANG ZB,CHEN W Z,etal.Extracorporeal high intensity focused ultrasound ablation in the treatment of patients with large hepatocellular carcinoma [J].Ann Surg Oncol,2004,11(12):1061-1069.
[5]LI Q,DU J,YU M,et al.Transmission electron microscopy of VX2 liver tumors after high-intensity focused ultrasound ablation enhanced with SonoVue[J].Adv Ther,2009,26(1):117-125.
[6]YU T,XIONG S,MASON T J,et al.The use of a micro-bubble agent to enhance rabbit liver destruction using high intensity focused ultrasound[J].Ultrason Sonochem,2006,13(2):143-149.
[7]MARUYAMA H,MATSUTANI S,SAISHO H,et al.Sonographic shift of hypervascular liver tumor on blood pool harmonic images with definity:timerelated changes of contrast-enhanced appearance in rabbit VX2 tumor under extra-low acoustic power[J].Eur J Radiol,2005,56(1):60-65.
[8]WU F,WANG Z B,CHEN W Z,et al.Dosimetry study on the extracorporeal ablation of hepatic carcinoma with high-intensity focused ultrasound[J].Chinese Journal of Physical Medicine and Rehabilitation,2000,22(5):267-270.
[9]WANG X,DU W H,YANG W X,et al.Observation of vascular enhancement in rabbits with liver VX2 tumor by using coherent contrast imaging[J].Acta Academiae Medicinae Militaris Tertiae,2005,27(3):227-229.
[10]MINAMI Y,KUDO M,KAWASAKI T,et al.Transcatheter arterial chemoembolization of hepatocellularcarcinoma:usefulness ofcoded phase-inversion harmonic sonography[J].AJR,2003,180(3):703-708.
[11]HE W,WANG W,ZHOU P,et al.Experimental study on phase timing of rabbit liver VX2 tumor by contrast-enhanced ultrasonography:comparison with multidetector spiral CT[J].Chinese Journal of Ultrasonography,2010,19(1):65-69.
[12]PARK K S,CHOI B I,WON H J,et al.Intratumoral vascularity of experimentally induced VX2 carcinoma:comparison ofcolorDoppler sonography, power Doppler sonography, and microangiography [J].Invest Radiol,1998,33(1):39-44.
[13]MELONI M F,GOLDBERG S N,LIVRAGHI T,et al.Hepatocellular carcinoma treated with radiofrequency ablation:comparison of pulse inversion contrast-enhanced harmonic sonography,contrast-enhanced power Doppler sonography,and helical CT [J].AJR,2001,177(2):375-380.
