蛋白酶激活受体-1在凝血酶诱导大鼠脑损伤及神经再生中的作用
2013-12-06刘飞飞柳夫义
刘飞飞,柳夫义,王 林,胡 华
(浙江大学医学院附属第二医院,浙江杭州 310009)
脑出血(intracerebral hemorrhage,ICH)后脑损伤机制和神经功能恢复一直是国内外研究的热点。自1980年Suzuki和Ebina首次提出血凝块的毒性作用以来[1],凝血酶在脑出血中的作用日益受到重视,现有研究表明,凝血酶可通过受体及非受体介导途径导致脑损伤[2],参与ICH后的内源性神经细胞再生[3-4]。
蛋白酶激活受体(protease-activated receptors,PARs)属于G蛋白偶联受体超家族,现已知有 4种 PARs,分别为 PAR-1、PAR-2、PAR-3和 PAR-4,其中 PAR-1、PAR-3和 PAR-4由凝血酶激活,PAR-2则由胰蛋白酶激活[5]。脑内的PAR-1主要表达在星形胶质细胞、小胶质细胞及神经元[6],PAR-3主要表达在星形胶质细胞和血管内皮细胞,PAR-4表达在星形胶质瘤细胞[7]。有研究发现,PAR-1激活可上调NMDA受体介导的兴奋性氨基酸毒性,从而导致细胞凋亡[8];PAR-1抑制剂 SCH79797通过ASK1/JNK信号通路减轻手术引起的神经元损伤[9]。PAR-3可作为 PAR-1的共同受体调控PAR-1信号通路[10],PAR-4激活可启动p38MAPK-NFκB通路[11]。这些研究表明,PARs激活后的作用复杂,其的作用具体机制需深入研究。本研究应用大鼠海马CA1区立体定向注射凝血酶、不同亚型蛋白酶激活受体的特异性激动剂,研究不同亚型蛋白酶激活受体的激活对脑损伤及神经再生的影响,从而探讨介导凝血酶在脑损伤和神经再生中作用的受体亚型。
1 材料与方法
1.1 药物和试剂 大鼠凝血酶购自美国Sigma公司;PAR-1激动剂(活性肽TFLLRN)、PAR-3激动剂(活性肽TFRGAP-NH2)和PAR-4激动剂(活性肽 GYPGKF-NH2)均购自美国Anaspec公司;兔抗鼠GFAP抗体、兔抗鼠DCX抗体和荧光标记的山羊抗兔IgG抗体购自美国Millipore公司;山羊血清购自上海鼎国生物技术有限公司;Flouro-Jade C试剂购自美国Chemicon公司;其余化学试剂为国产分析纯产品。
1.2 动物分组与模型制备 清洁级健康雄性Sprague-Dawley大鼠90只,体重200~260 g,由浙江省实验动物中心提供。采用裂区设计的方法将SD大鼠随机分为5组:生理盐水(NS)组、凝血酶组和3种蛋白酶激活受体激动剂组(PAR-1激动剂、PAR-3激动剂和 PAR-4激动剂),每组18只。各组再按照时间点随机分为1 d、3 d和7 d组。动物模型的建立依据文献[12],用10%水合氯醛腹腔麻醉大鼠(3 ml/kg),固定于脑立体定位仪,75%酒精消毒皮肤后取正中切口,暴露颅骨,选取右侧海马CA1区(Bregma线后 3.5 mm,中线旁开 2.0 mm),牙科钻钻开颅骨,暴露硬脑膜,用微量注射器垂直进针,深度3.0 mm。凝血酶和蛋白酶激活受体激动剂的注入剂量参照文献[13],以1μl/min速度分别注入 NS(10μl)、凝血酶(5 U)、PAR-1激动剂(10 nmol)、PAR-3激动剂(10 nmol)和PAR-4激动剂(10 nmol),缓慢注射 10 min,留针5 min。术后颅骨小孔用骨蜡封闭,缝合切口,术毕放回笼中自由活动进食。分别在注射后的1 d、3 d和7 d用水合氯醛深度麻醉大鼠,4%多聚甲醛经左心室灌注固定后取脑,脑组织置于固定液中过夜,梯度蔗糖脱水至沉底。冰冻切片机连续切片,用于免疫荧光(片厚15 μm)及 HE 染色(片厚8 μm)。
1.3 HE染色 组织切片经95%乙醇固定30 s后,苏木素染色1 min,1%盐酸酒精分化10 s,伊红复染30 s,常规脱水、透明,中性树胶封片。光镜观察,应用显微图像分析软件(NIH Image)计算右侧海马面积。
1.4 免疫荧光染色 切片经PBS浸润后加入5%山羊血清液,常温封闭30 min后,分别加入兔抗鼠GFAP抗体(1∶150稀释)或兔抗鼠DCX抗体(1∶150稀释),4℃孵育过夜。正常兔IgG用于阴性对照。切片加入荧光标记的山羊抗兔IgG抗体(1∶100稀释),常温避光孵育30 min,DAPI常温避光复染15 min,50%缓冲甘油封片。荧光显微镜观察,应用显微图像分析软件(NIH Image)计算右侧海马CA1区GFAP荧光染色阳性细胞和DCX荧光染色阳性细胞。
1.5 Fluoro-Jade C染色 Fluro-Jade C染色方法参照文献[14],切片固定在防脱玻片上,室温干燥30 min后,依次含1%NaOH的80%酒精溶液浸洗5 min,70%酒精浸洗2 min,去离子水洗2 min,0.06%高锰酸钾溶液匀速轻摇15 min,去离子水洗1 min,含0.0001%Fluoro-Jade C染液的0.1%醋酸避光染色30 min,去离子水洗2 min×3次,吹干,二甲苯处理1 min,中性树脂封片。荧光显微镜观察,应用显微图像分析软件(NIH Image)计数右侧海马CA1区的Fluoro-Jade C荧光染色阳性细胞。
2 结果
2.1 海马面积变化 海马注射凝血酶后1 d和3 d,海马的面积增大,7 d后海马的面积缩小。海马注射PAR-1激动剂在1 d和3 d同样引起海马面积增大,7 d后引起海马面积缩小。而海马注射PAR-3激动剂和PAR-4激动剂后1 d、3 d和7 d均未引起海马面积的明显变化(图1、表1)。
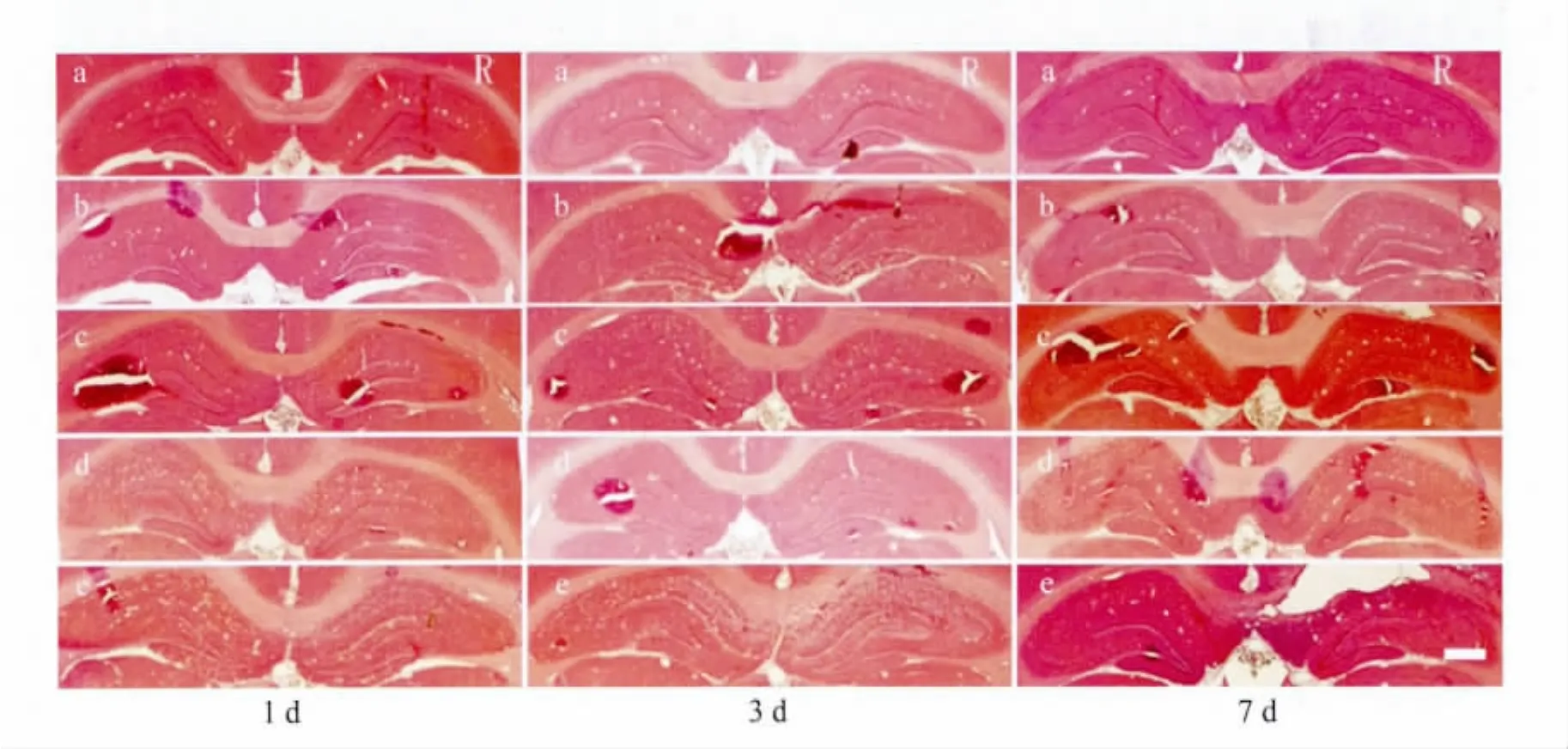
图1 各组不同时间点的海马图像Fig.1 The representative photo of hippocampus
表1 各组海马面积的比较Table 1 The area of hippocampus in different groups(n=6,,mm2)
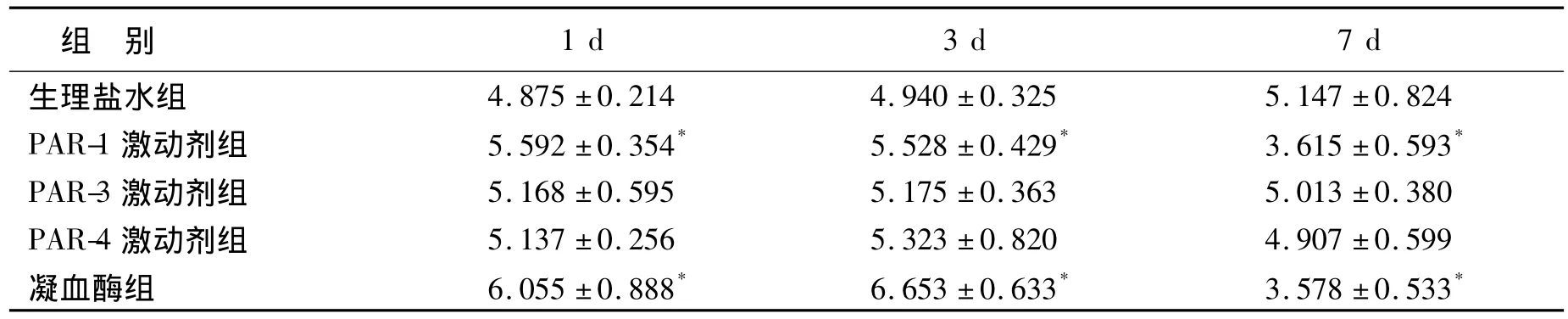
表1 各组海马面积的比较Table 1 The area of hippocampus in different groups(n=6,,mm2)
与生理盐水组比,*P <0.05.
组 别1 d 3 d 7 d生理盐水组4.875 ±0.214 4.940 ±0.325 5.147 ±0.824 PAR-1 激动剂组 5.592 ±0.354* 5.528 ±0.429* 3.615 ±0.593*PAR-3 激动剂组 5.168 ±0.595 5.175 ±0.363 5.013 ±0.380 PAR-4 激动剂组 5.137 ±0.256 5.323 ±0.820 4.907 ±0.599凝血酶组 6.055 ±0.888* 6.653 ±0.633* 3.578 ±0.533*
2.2 GFAP阳性细胞计数 海马注射凝血酶后1 d、3 d和7 d,GFAP阳性细胞明显增多,与注射NS组比较差异有统计学意义(P<0.05)。注射3种PAR激动剂均能够引起GFAP阳性细胞的表达增多,但与注射NS组比较仅PAR-1激动剂差异有统计学意义(P<0.05),见图2、表2。
2.3 Fluoro-Jade C阳性细胞计数 海马注射NS后1 d、3 d和7 d,Fluoro-Jade C阳性细胞数极少量,而海马注射凝血酶后1 d、3 d和7 d,Fluoro-Jade C阳性细胞显著增多,明显高于NS组(P<0.05)。PAR-1激动剂组的Fluoro-Jade C阳性细胞在1 d、3 d和7 d时均高于NS组(P<0.05),PAR-3激动剂组和 PAR-4激动剂组仅有少量Fluoro-Jade C阳性细胞(图3、表3)。

图2 各组不同时间点的GFAP免疫荧光染色Fig.2 The representative photo of GFAP fluorescence immunostaining
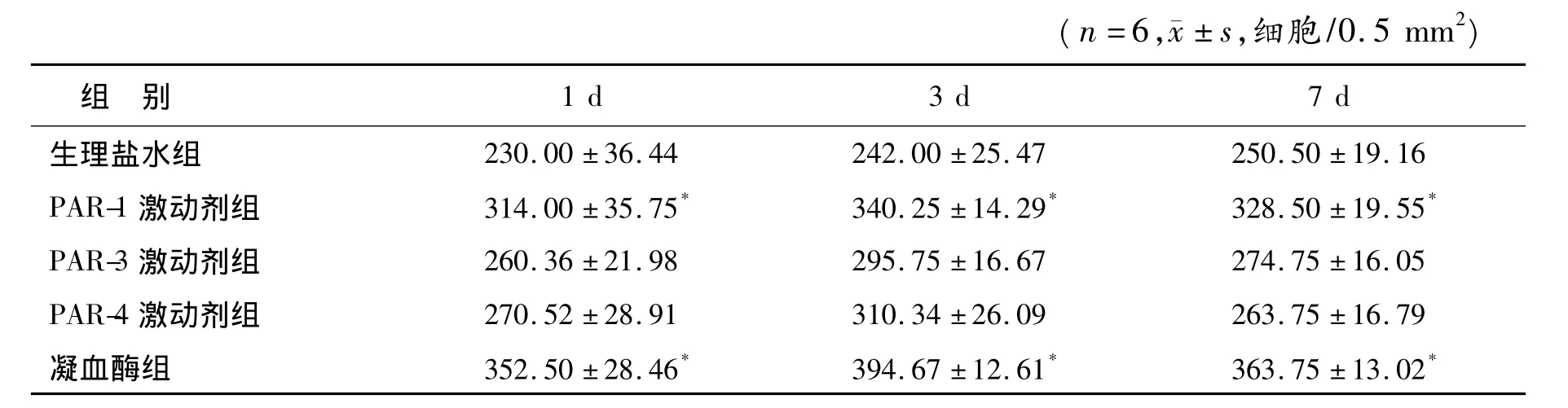
表2 各组海马CA1区GFAP阳性细胞数量的比较Table 2 The number of GFAP positive cells in the hippocampus CA1 region in different groups
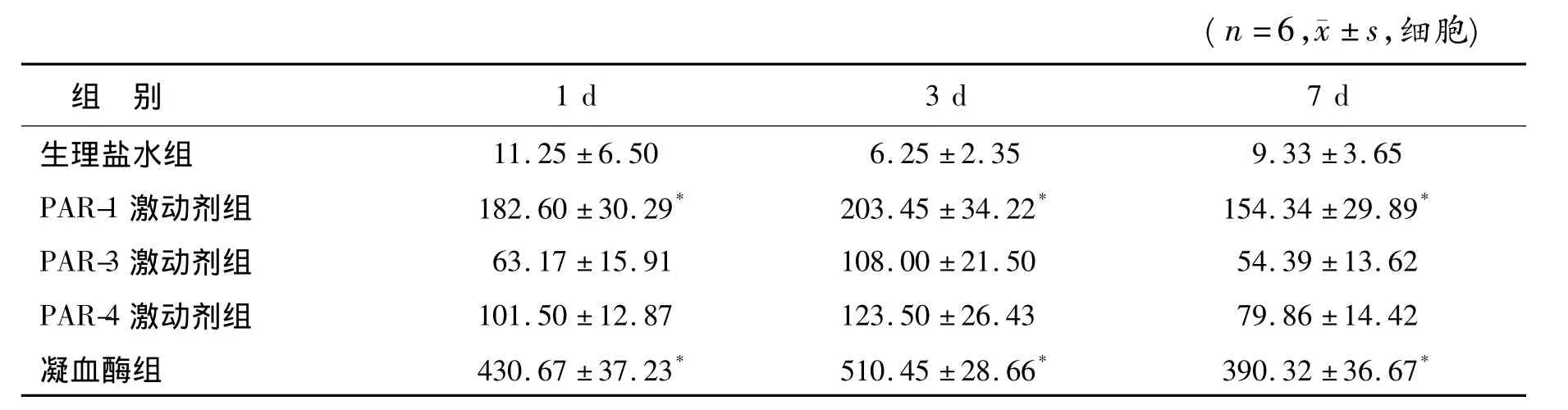
表3 各组海马CA1区Flouro-Jade C阳性细胞数量的比较Table 3 The number of Flouro-Jade C positive cells in the hippocampus CA1 region in different groups
2.4 DCX阳性细胞计数 注射凝血酶后3 d和7 d,海马CA1区DCX阳性细胞增加,注射PAR-1激动剂后3 d和7 d后也有增加,与注射NS组比较差异有统计学意义(P<0.05)。注射PAR-3激动剂和PAR-4激动剂后1 d、3 d和7 d,DCX阳性细胞数与注射NS组比较差异无统计学意义(图4、表4)。
3 讨论
本研究发现凝血酶能够引起海马面积在急性期增加、慢性期萎缩,同时伴随GFAP阳性细胞、Flouro-Jade C阳性细胞及DCX阳性细胞的增多,提示凝血酶能够导致神经损伤及再生。PAR-1特异性激动剂能够模拟凝血酶的作用,而PAR-3及PAR-4特异性激动剂无类似作用,提示凝血酶的受体作用主要与PAR-1相关。
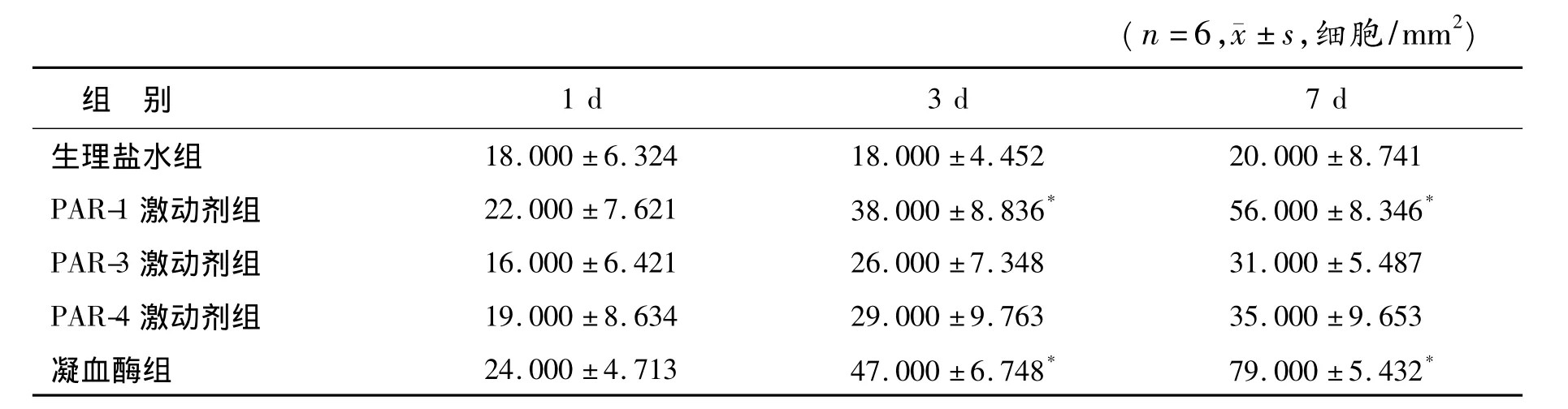
表4 各组海马CA1区DCX阳性细胞数量的比较Table 4 The number of DCX positive cells in the hippocampus CA1 region in different groups

图3 各组(3 d)海马CA1区的Flouro-Jade C染色Fig.3 The representative photo of Flouro-Jade C positive cells in the hippocampus(3 d)

图4 各组(7 d)海马CA1区DCX染色Fig.4 The representative photo of DCX positive cells in the hippocampus(7 d)
本研究发现,凝血酶具有直接的神经毒性作用,表现为早期海马肿胀及后期萎缩,神经元退行性变以及星形胶质细胞激活。凝血酶的这种毒性作用主要是通过激活PAR-1发生,PAR-3和PAR-4的作用不明显。自Suzuki等首次提出血凝块的神经毒性作用[1],大量研究发现凝血酶是血凝块诱导神经损伤的关键因子之一,ICH后凝血酶可通过受体途径激活RhoA、脑内基质金属蛋白酶(MMPs)和MAPK等通路[15],也可通过非受体途径激活补体表达和诱导自我吞噬现象发生[16]。PAR-1参与脑损伤有较多的报道,比如介导颅脑手术引起的神经元损伤[9]、脑缺血损伤[17-18]、NMDA 引起的损伤[19]。对蛋白酶激活受体与脑损伤的研究,以PAR-1较为多见,在体外,激肽释放酶相关肽6可通过激活PAR-1激活星形胶质细胞[20],PAR-1参与脑损伤后的胶质瘢痕形成[21],凝血酶及PAR-1还参与多种神经退行性疾病的发生和发展[22]。
其次,在注射凝血酶和PAR-1激动剂3 d后即可出现 DCX表达,而 PAR-3激动剂和PAR-4激动剂仅引起DCX少量表达,提示凝血酶和PAR-1激活与ICH后神经细胞再生密切相关。在大鼠脑中风和脑外伤模型中可观察到神经细胞再生现象[23-24],新生的神经干细胞主要起源于脑室外侧壁的脑室下带和海马齿状回的颗粒细胞下层[25],可移行至受损脑组织区域,起到改善预后的作用[26-27]。目前ICH后继发神经细胞再生的机制尚未阐明,有报道称,ICH后高迁移率族蛋白1、MMPs和凝血酶均可诱发神经细胞再生[3-4,28-29]。DCX 的表达与神经元前体细胞的移行有关,能较准确的反映神经细胞再生的情况,是检测神经细胞再生的可靠标记物[30]。
总之,本研究发现PAR-1激活是凝血酶诱发脑损伤的一个重要因素,并且PAR-1激活还参与了凝血酶所致的神经细胞再生。相信随着凝血酶及其受体研究的不断深入,必将会为治疗ICH后凝血酶所致脑损伤及促进神经再生提供新的思路。
[1]XI G H,WAGNER K R,KEEP R F,et al.Role of blood clot formation on early edema development after experimental intracerebral hemorrhage [J].Stroke,1998,29(12):2580-2585.
[2]LEE D Y,PARK KW,JIN B K.Thrombin induces neurodegeneration and microglial activation in the cortex in vivo and in vitro:Proteolytic and nonproteolytic actions[J].Biochem Biophys Res Comm,2006,346(3):727-738.
[3]HUA Y,KEEP RF,GU Y,et al.Thrombin and brain recovery after intracerebralhemorrhage [J].Stroke,2009,40(3 Suppl):S88-89.
[4]YANG S,SONG S,HUA Y,et al.Effects of thrombin on neurogenesis after intracerebral hemorrhage[J].Stroke,2008,39(7):2079-2084.
[5]ZHENG G Q,WANG X T,WANG X M,et al.Longtime course of protease-activated receptor-1 expression after intracerebral hemorrhage in rats[J].Neurosci Lett,2009,459(2):62-65.
[6]ZHOU Q B,JIA Q,ZHANG Y,et al.Effects of baicalin on protease-activated receptor-1 expression and brain injury in a rat model of intracerebral hemorrhage[J].Chin J Physiol,2012,55(3):202-209.
[7]KAUFMANN R,PATT S,ZIEGER M,et al.The two-receptor system PAR-1/PAR-4 mediates alphathrombin-induced[Ca2+](i)mobilizationin human astrocytoma cells[J].J Cancer Res Clin Oncol,2000,126(2):91-94.
[8]HAN K S,MANNAIONI G,HAMILL C E,et al.Activation of protease activated receptor 1 increases the excitability of the dentate granule neurons of hippocampus[J].Mol Brian,2011,4:32-43.
[9]MANAENKO A,SUN X,KIM C H,et al.PAR-1 antagonist SCH79797 ameliorates apoptosis following surgical brain injury through inhibition of ASK1-JNK in rats[J].Neurobiol Dis,2012,50C:13-20.
[10]MCLAUGHLIN J N,PATTERSON M M,MALIK A B.Protease-activated receptor-3(PAR3)regulates PAR1 signaling by receptor dimerization[J].Proc Natl Acad Sci USA,2007,104(13):5662-5667.
[11]CHEN W F,LEE J J,CHANGE C C,et al.Platelet protease-activated receptor(PAR)4,but not PAR1,associated with neutral sphingomyelinase responsible for thrombin-stimulated ceramide-NF-κB signaling in human patelets [J/OL].Haematologica,2012,97.Doi:10.3324/haematol.2012.072553.
[12]CHOI S H,LEE D Y,KIM S U,et al.Thrombininduced oxidative stress contributes to the death of hippocampal neurons in vivo:role of microglial NADPH oxidase[J].J Neurosci,2005,25(16):4082-4090.
[13]JIANG Y,WU J,HUA Y,et al.Thrombin-receptor activation and thrombin-induced brain tolerance[J].J Cereb Blood Flow Metab,2002,22(4):404-410.
[14]SCHMUED L C,STOWERS C C,SCALLET A C,et al.Fluoro-Jade C results in ultra high resolution and contrast labeling of degenerating neurons[J].Brain Research,2005,1035(1):24-31.
[15]BABU R,BAGLEY J H,DI C,et al.Thrombin and hemin as central factors in the mechanisms of intracerebral hemorrhage-induced secondary brain injury and as potential targets for intervention[J/OL].Neuosurg Focus,2012,32(4):E8.Doi:10.3171/2012.1.FOCUS11366.
[16]HU S,XI G,JIN H,et al.Thrombin-induced autophagy:a potential role in intracerebral hemorrhage[J].Brain Res,2011,1424:60-66.
[17]ZHANG J,WANG Y,ZHU P,et al.siRNA-mediated silence of protease-activated receptor-1 minimizes ischemic injury of cerebralcortex through HSP70 and MAP2 [J].J Neurol Sci,2012,320(1-2):6-11.
[18]WANG J,JIN H,HUA Y,et al.Role of proteaseactivated receptor-1 in brain injury after experimental global cerebral ischemia [J].Stroke,2012,43(9):2476-2482.
[19]HAMILL C E,MANNAIONI G,LYUBOSLAVSKY P,et al.Protease-activated receptor 1-dependent neuronal damage involves NMDA receptor function[J].Exp Neurol,2009,217(1):136-146.
[20]SCARISBRICK I A,RADULOVIC M,BURDA J E,et al.Kallikrein 6 is a novel molecular trigger of reactive astrogliosis[J].Biol Chem,2012,393(5):355-367.
[21]NICOLE O,GOLDSHMIDT A,HAMILL C E,et al.Activation of protease-activated receptor-1 triggers astrogliosis after brain injury [J].J Neurosci,2005,25(17):4319-4329.
[22]SOKOLOVA E,REISER G.Prothrombin/thrombin and the thrombin receptors PAR-1 and PAR-4 in the brain:localization,expression and participation in neurodegenerative diseases [J].Thromb Haemost,2008,100(4):576-581.
[23]HASSANI Z,O`REILLY J,PEARSE Y,et al.Human neural progenitor cell engraftment increases neurogenesis and microglial recruitment in the brain of rats with stroke [J/OL].PLoS One,2012,7(11):e50444.Doi:10.1371/journal.pone.0050444.
[24]OTERO L,ZURITA M,BONILLAC,etal.Endogenous neurogenesis after intracerebral hemorrhage [J].Histol Histopathol,2012,27(3):303-315.
[25]DONG J,LIU B,SONG L,et al.Neural stem cells in the ischemic and injured brain:endogenous and transplanted [J].Cell Tissue Bank,2012,13(4):623-629.
[26]KIM H J,SUN W.Adult neurogenesis in the central and peripheral nervous systems[J].Int Neurourol J,2012,16(2):57-61.
[27]BELLENCHI G C,VOLPICELLI F,PISCOPO V,et al.Adult neural stem cells:an endogenous tool to repair brain injury[J].J Neurochem,2013,124(2):159-167.
[28]LEI C,LIN S,ZHANG C,et al.Effects of highmobility group box 1 on cerebral angiogenesis and neurogenesis after intracerebral hemorrhage[J].Neuroscience,2012,229C:12-19.
[29]LEI C,LIN S,ZHANG C,et al.Activation of cerebral recovery by matrix metalloproteinase-9 after intracerebral hemorrhage[J].Neuroscience,2013,230:86-93.
[30]COUILLARD-DESPRES S, WINNER B,SCHAUBECK S,et al.Doublecortin expression levels in adult brain reflect neurogenesis[J].Eur J Neurosci,2005,21(1):1-14.
