子宫内膜基质干细胞的分离培养研究
2013-12-06王利公杨新园
王利公,杨新园,王 伟
(西安交通大学医学院第一附属医院1.检验科;2.妇产科;3.麻醉科,陕西西安 710061)
人子宫内膜由腺上皮细胞、间质细胞和血管组成,近年越来越多的研究表明,子宫内膜组织中存在一小群具有强大增殖和多向分化潜能的干细胞,可不断分裂增殖,及时补充脱落的终末分化细胞,使子宫内膜始终保持自我更新和再生能力。现代妇产科学研究向细胞、亚细胞及分子水平发展,在体外成功的培养子宫内膜干细胞可为研究细胞的生长分化、代谢以及激素作用机制提供一个理想的实验模型。本实验旨在分离、纯化子宫内膜间充质干细胞,即基质干细胞,观察细胞形态并分析其生长特点,建立子宫内膜基质干细胞体外培养模型,为探索其临床应用价值提供一定的研究基础。
1 材料与方法
1.1 试剂 DMEM培养基、胎牛血清购自Hyclone公司;胶原酶Ⅲ、免疫磁珠(CD45、EpCAM)、胰岛素、β-甘油磷酸钠、地塞米松、抗坏血酸、转化生长因子β1均购自Sigma公司;胰蛋白酶等购自 Gibco公司;CD105、CD90、CD45、CD34、OCT-4单克隆抗体以及 Vimentin抗体均购自Becton Dickinson公司。
1.2 标本 留取10例子宫内膜标本,患者年龄32~43岁,因子宫肌瘤行全子宫切除术,手术前3个月未服用激素类药物,组织学诊断未发现子宫内膜有病理性改变。标本均经本人及家属知情同意后获得。在无菌条件下取内膜全层+子宫肌层5 mm,取材远离病变部位,放入冰浴DMEM/F-12/5%NCS培养液中,低温条件下迅速转移到实验室进行分离培养。
1.3 子宫内膜基质干细胞的原代培养 无菌条件下PBS冲洗3次,小心刮取子宫内膜,剪碎约1 mm3的小块,加入胶原酶Ⅲ(300μg/ml)+DNA酶I(40μg/ml),置37℃恒温水浴摇床(150 r/min)消化,,大约45~60 min后,加入DMEM/F-12/5%NCS终止消化,用40 μm滤网过滤,收集滤液。用抗人CD45单抗免疫磁珠分离细胞。调整细胞浓度为1×108/ml,取细胞悬液80μl加入标记有EpCAM抗体的免疫磁珠20μl,混匀后置于4℃冰箱中15 min。加2 ml PBS,300 r/min 离心 10 min,小心吸去上清,用500μl PBS重悬细胞。将分离仪上分离得到的EpCAM-的基质细胞加入培养液,置于37℃,体积分数为5%CO2条件下培养,24 h后更换培养液。
在24孔培养板中培养细胞,达80%融合时吸除培养基,PBS轻洗3次,95%酒精室温固定10 min,PBS轻洗细胞3次;0.25%TritonX-100打孔,3%过氧化氢溶液浸泡10 min,PBS洗3次。滴入5%羊血清,室温10 min吸弃孔上的羊血清,直接加入已稀释的一抗Vimentin(1∶100稀释)4℃过夜,将一抗吸弃并用PBS洗5次;加入已稀释的二抗后放入37℃恒温箱中30 min,PBS洗5次;加入SP后放30 min,用PBS洗5次,加入DAB显色、复染、脱水、透明、封片。将分离的基质细胞进一步行克隆形成实验。将细胞低密度接种于60 mm培养皿上,接种密度为300~500细胞/cm2,6~7 d换液1次。培养15 d后选取形成的大克隆,克隆环获取,将获得的子宫内膜基质干细胞传代培养,用于后续实验。
1.4 检测细胞表面标志物 取第3代细胞,将1×106个细胞转移至离心管中,用PBS洗涤离心2次,弃上清,加入PBS重悬,分别取100μl PBS加入流式管中,1 号为空白对照,2、3、4、5号分别加稀释倍数为 1∶30的 CD34-PE、CD105-FITC、CD45-PE和 CD90-PE mAb工作液100μl,混匀后置37℃温箱中孵育30 min。每管加1 ml PBS混匀,1000 r/min离心10 min,弃去上清。分别加500μl PBS,上机检测;对照组未加入抗体。
1.5 细胞周期测定 取第3代细胞1×106个细胞离心后弃上清,加入700μl无水冰乙醇混匀,3 ~5 min 后加入300μl PBS 混匀,4℃保存4 h后送检。1500 r/min离心5 min,沉淀加Trton X-100 约140μl,孵育15 ~20 min,加碘化丙啶约2 ml,孵育15~20 min,上机检测。
1.6 细胞倍增时间测定 取第3代处于对数生长期的细胞,消化后制备成单细胞悬液,计数,调整细胞浓度为1×107/L,取11块96孔板,每板设6 个复孔,1 个对照孔,100μl/孔,即1000个细胞/孔,对照孔无细胞,仅加培养基。置37℃、体积分数为5%的CO2饱和湿度培养箱中培养,每3 d换液1次。从次日始,每天同一时间取一块96孔板,每孔加入5 g/L MTT 10μl,4 h后小心吸出孔内液体,注意防止吸出结晶,加入100μl三联液(100 g/L十二烷基硫酸钠、体积分数为5%的异丁醇、0.012 mol/L盐酸),12 h后在酶标仪上选用570 nm、490 nm波长测定各孔吸光度值。取均值,以时间为横坐标,吸光度值为纵坐标,绘制生长曲线,计算倍增时间。细胞倍增时间计算公式:Td=△t×Ig2/IgAt2-IgAt1。
1.7 子宫内膜基质干细胞的成脂和成骨的诱导分化 取第3代内膜基质干细胞1×105/cm接种于24孔板,待80%融合时,吸去完全培养基,加入成脂诱导培养液[1][DMEM/F-12/10%NCS基础培养液、1-甲基-3-异丁基黄嘌呤(IBMX)0.5 mmol/L、胰岛素 2 μmol/L、地塞米松1 ×10-7mol/L、吲哚美辛200 μmol/L],进行成脂肪细胞诱导分化3周,每3天进行半量换液。成脂诱导3周的细胞,观察到胞质中有空泡形成时,吸去培养液,PBS洗涤1次,4%多聚甲醛固定15 min,以0.375%油红O染色15 min,苏木精复染2~5 min,显微镜下观察、照相。分别在诱导前和诱导后21 d行RT-PCR测定过氧化酶活化增生受体 γ(抗原)(peroxisome proliferator-activated receptor gamma,PPARγ)、瘦素(leptin,LEP)的表达情况。
取第3代内膜基质干细胞1×105/cm接种于24孔板,待80%融合时,吸去完全培养基,加入成骨诱导培养液[1-3](DMEM/F-12/10%NCS基础培养液、地塞米松1×10-8mol/L、β-甘油磷酸钠10 mmol/L、抗坏血酸50 mg/L)诱导分化培养3周,每72 h换液1次。成骨诱导3周的细胞采用4%多聚甲醛固定15 min,PBS洗涤3次,加入1%茜素红溶液,37℃染色30 min,蒸馏水洗去多余染料,晾干后,甘油明胶封片,镜检。分别在诱导前和诱导后21 d行RTPCR测定碱性磷酸酶(alkaline phosphatase,ALP)、骨钙素(osteocalcin)的表达情况。
RT-PCR方法RNA提取:弃去各组细胞的培养液,PBS冲洗2次,每瓶加入Trizol l ml充分吹打溶解细胞;将细胞溶解液转入 EP管中,室温放置5 min;按0.2 ml/ml的容积比加入氯仿 0.2 ml,剧烈振荡 30 s,室温放置 10 min,12000 r/min 4℃离心5 min;将上清液转移至另一 EP管中,加入异丙醇0.5 ml,颠倒混匀数次,室温放置 5 min,12000 r/min 4℃ 离心 5 min;弃上清,加入75%的冷乙醇洗涤2次,慢慢旋转EP管洗涤沉淀,12000 r/min室温离心2 min;吸干残余液体,空气干燥15 min;向沉淀中加入50μl DEPC水,轻轻振荡混匀;将提取的RNA用紫外分光光度计测定OD值及OD 260/OD 280比值,计算 RNA浓度。样品进行RT-PCR。RNA浓度测定后,所提RNA进行琼脂糖凝胶电泳,先制胶后电泳,c-DNA制备。反应条件:42℃,10 min→30℃,20 min→99℃,5 min→4℃,5 min。按引物设计原则设计引物,由Invitrogen公司合成,具体见表1。电泳:取PCR产物4μl上样,同时在另一点样孔中加100 bp DNA Ladder 3μl。1.5% 琼脂糖凝胶电泳,所用电泳缓冲液为1.5×TBE,电压5 V/cm。电泳结束后,在凝胶成像仪下观察并拍照。

表1 脂肪细胞和骨细胞特异性基因引物序列和长度Table 1 Human endometrial stromal stem cells differentiation induction gene name and primer sequences for PCR amplification
1.8 OCT-4检测 在24孔培养板中培养细胞,达80%融合时弃去上清,40 g/L多聚甲醛固定,15 min,PBS冲洗3次,加入3%BSA封闭30 min,阻断非特异性染色的产生,加入BSA稀释的一抗OCT-4,4℃过夜,PBS冲洗3次,10 min/次,加二抗,室温作用1 h,PBS冲洗3次,DAB显色,显微镜下拍照记录。
2 结果
2.1 子宫内膜基质干细胞的体外培养 子宫内膜基质细胞多呈梭形、不规则三角形,核为卵圆形位于靠近细胞质的中央,细胞排列成漩涡状、放射状、或似栅栏状生长;Vimentin染色阳性(图1)。将细胞低密度接种培养板后,形成散在分布的集落,包含2种克隆(图2):小克隆数目多,由一些低核质比例,疏松连接的大细胞组成,这些细胞是一些较成熟的短暂扩充细胞,排列松散;大克隆数目少,其中含有高核质比例的小细胞>4000个,紧密聚集而成,这些细胞被认为是子宫内膜干细胞[4]。
2.2 基质干细胞表型特征鉴定 细胞表面抗原表达类似于骨髓间充质干细胞,均表达典型的间充质干细胞表面抗原 CD105、CD90,不表达造血干细胞表面抗原CD34、CD45(图3)。
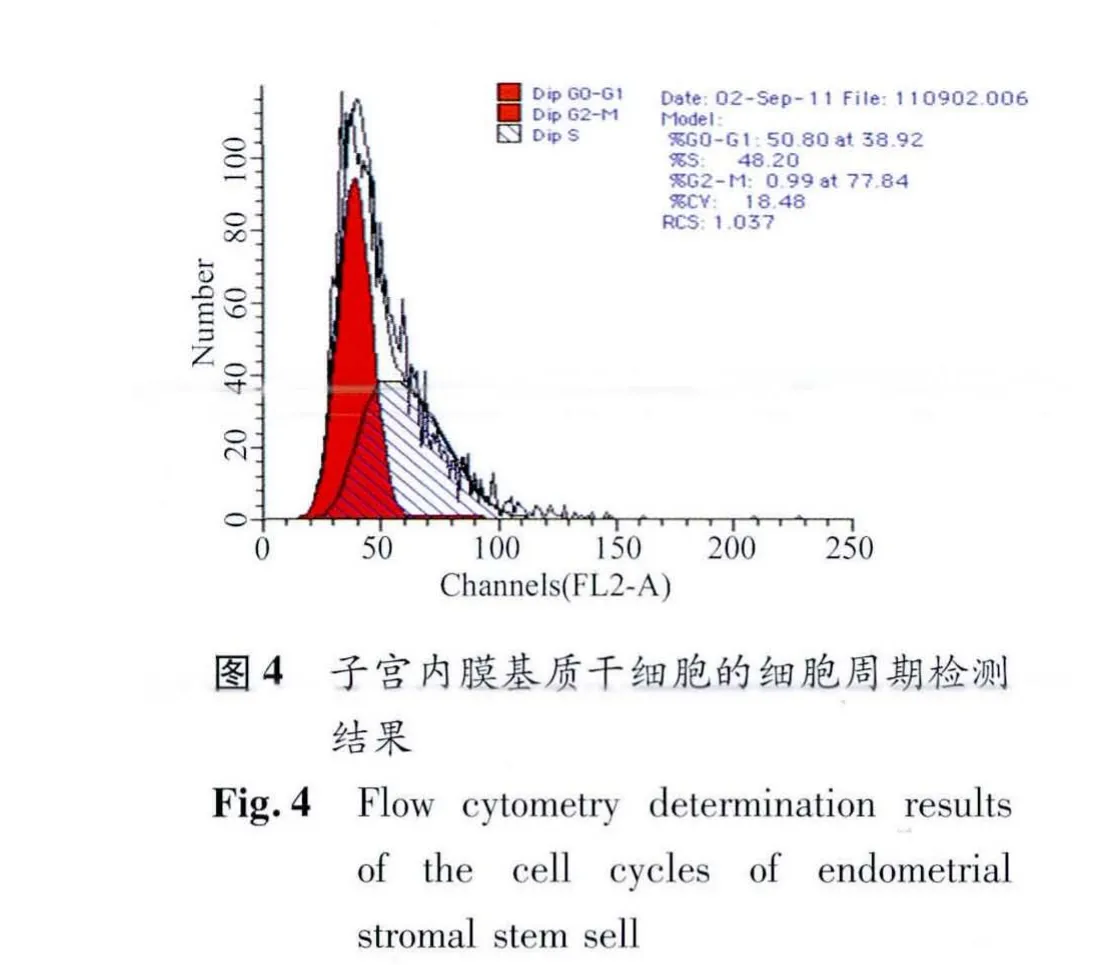
2.3 细胞周期测定 流式细胞仪检测结果表明,发生DNA复制的S期和G2-M期细胞比例高,意味着此细胞群中发生有丝分裂的细胞较多,因而增殖能力较强(图4)。
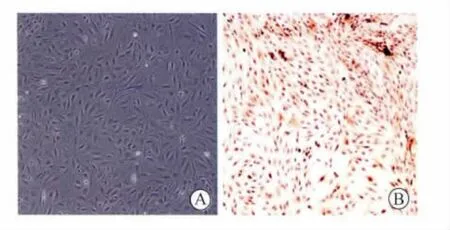
图1 原代子宫内膜基质细胞形态学观察Fig.1 Observation of morphological feature of primary cultured endometrialstromal cells
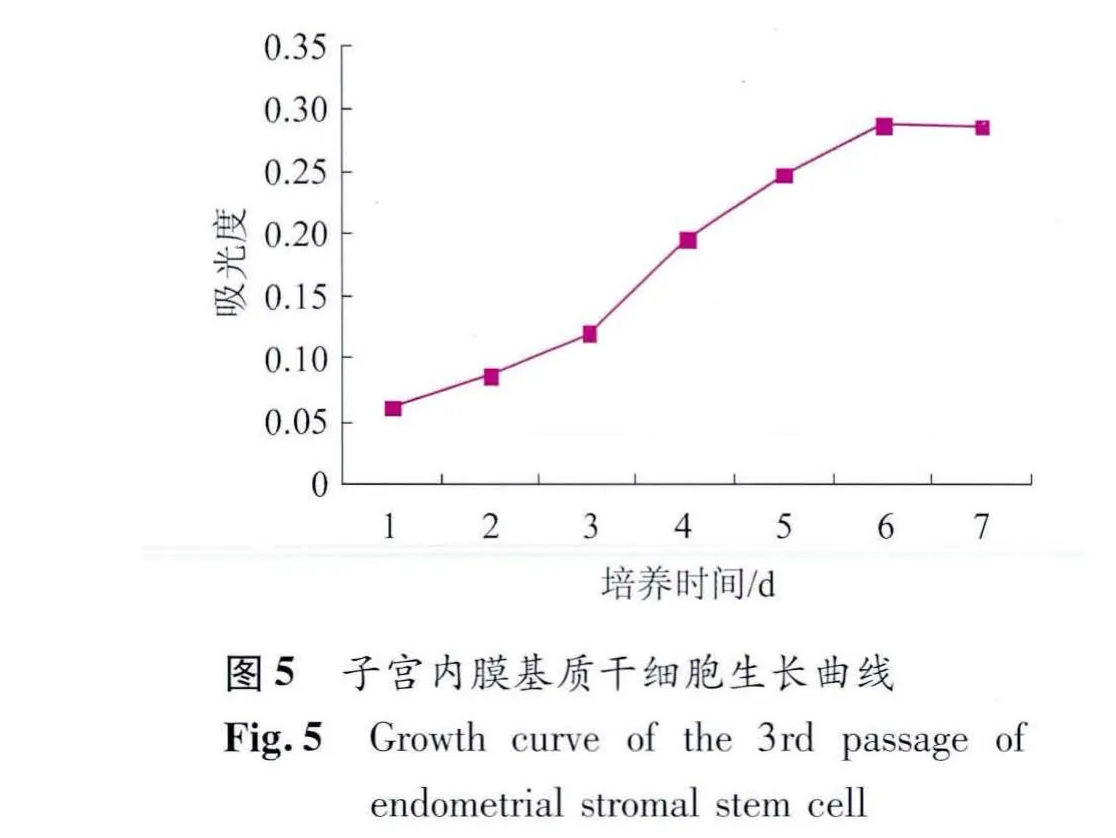
2.4 基质干细胞增殖活性测定 传代后第1~3天细胞增殖较慢,第4天开始细胞进入快速增殖期,第6天进入平台期,根据吸光度值绘制细胞生长曲线呈“S”形,有明显的滞留期、对数生长期和平台期。在细胞生长的对数期,细胞倍增时间为68 h(图5)。
2.5 子宫内膜基质干细胞成脂诱导后的形态观察及成脂基因表达 成脂诱导培养5 d,倒置显微镜观察细胞由梭形变为圆形或多角,体积增大,细胞呈多极突起,且突起细长,小部分细胞质内开始出现很小的折光性很强的脂滴,主要位于核周。诱导后10 d,部分细胞脂滴增多,有的脂滴聚集成较大的脂泡,脂肪细胞呈灶状分布。诱导后14 d,绝大部分细胞已变成脂肪细胞,细胞多呈圆形或椭圆形,细胞质内可见大量脂滴。诱导后21 d,油红O染色鉴定脂肪细胞中含大小不等的脂肪滴,脂滴被染成橙红色,细胞核为蓝色(图6-A)。RT-PCR测定显示诱导第21天PPARγ、LEP mRNA条带均呈阳性表达,未诱导组仅表达内参,PPARγ、LEP mRNA条带表达阴性(图6-A)。
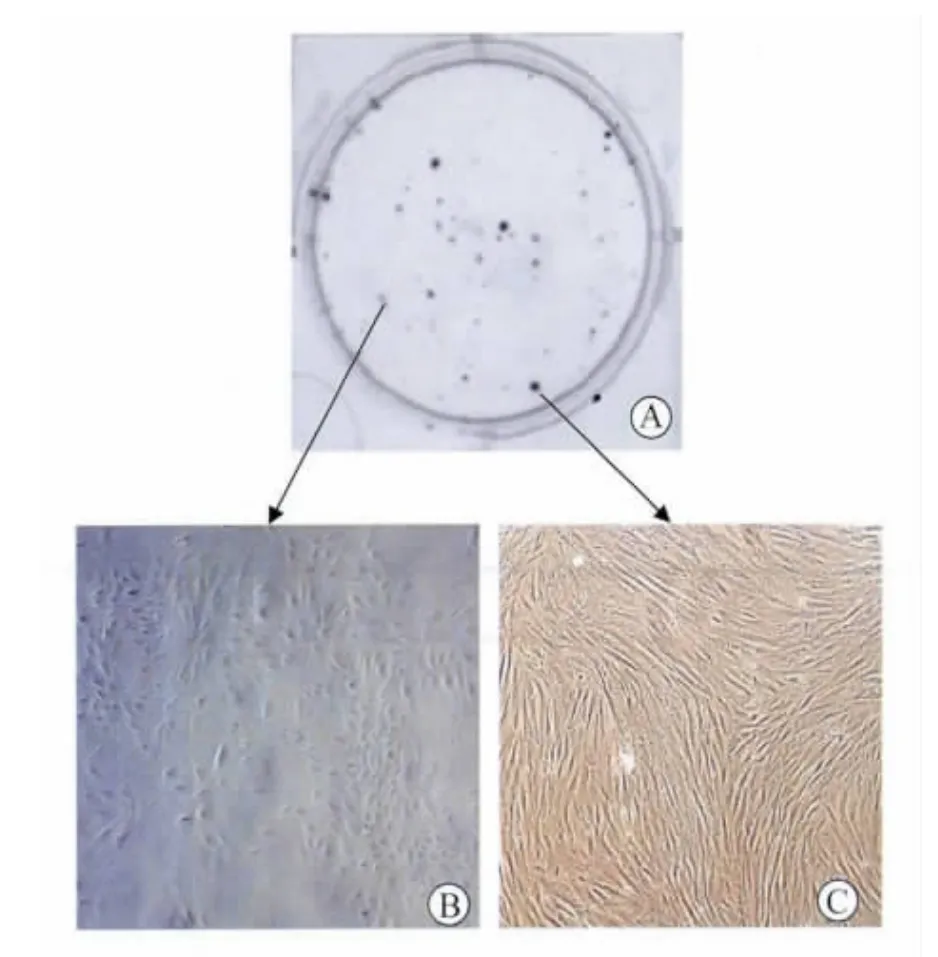
图2 子宫内膜基质细胞的克隆培养Fig.2 Colonies formed by human endometrial stromalcellsseeded atthe clonal density and cultured for 15 days
2.6 子宫内膜基质干细胞成骨诱导后的形态观察及成骨基因表达 经成骨诱导培养5 d后,细胞呈多中心、放射状排列,位于中心的细胞体积增大,而周围细胞仍呈长梭形状。诱导后7 d,倒置显微镜下观察其形态由梭形转变为卵圆形或多角形,细胞形态均一,体积明显增大,细胞质丰富,细胞器发达,细胞外基质分泌增多,细胞核增大,胞核颜色较淡。诱导21 d,细胞生长密集,中央可见类似结节状的结构,部分细胞呈现层叠样生长。茜素红染色后镜下可见细胞密集处有红色的沉着物,呈团样并向四周放射,中心颜色明显加深可见染成红色的钙结节(图6-B)。RT-PCR测定显示诱导第21天ALP、骨钙素mRNA条带均呈阳性表达,未诱导组仅表达内参,ALP、骨钙素mRNA条带表达阴性(图6-B)。
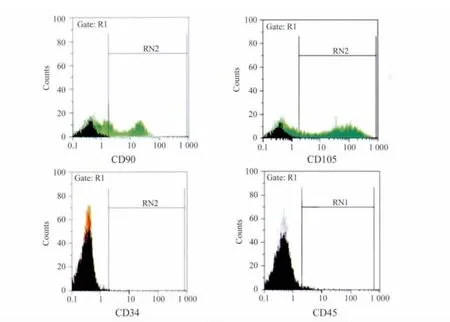
图3 流式细胞仪鉴定基质干细胞表面标记Fig.3 Flow cytometric analysis of cell surface markers
2.7 子宫内膜基质干细胞OCT-4的表达情况
免疫细胞化学染色证实子宫内膜基质干细胞OCT-4表达阳性(图7)。
3 讨论
干细胞理论在越来越多的研究中得到证实,但是由于成体干细胞在组织中数目极少[5-7],限制了干细胞的研究工作,因而有必要建立一种子宫内膜基质干细胞的富集纯化方法,以解决子宫内膜干细胞研究中由于干细胞数量极少所致的瓶颈问题。以往,子宫内膜组织中干细胞分离方法相对粗糙,难以去除混杂的细胞。基质细胞培养时细胞成分复杂,主要存在2种形态的贴壁细胞:梭形成纤维样细胞和大的圆形细胞。大部分标本中纤维样细胞占优势,基质干细胞夹杂其间很难分离。经典的干细胞分离方法是通过免疫磁珠法分选,但子宫内膜基质干细胞纯度不理想。本研究将免疫磁珠法和克隆形成实验结合纯化基质干细胞[4,8],再将纯化获取的大克隆细胞传代培养进行后续实验。在培养过程中,我们还注意到以下几个环节:①目前国内外对原代子宫内膜细胞的分离培养方法并不一致,大多数选用Ⅲ型胶原酶消化分离原代细胞,但也有使用I型胶原酶,或联合应用胰酶,甚至仅用胰酶进行消化分离的报道。实验经过摸索,使用300μg/ml的胶原酶Ⅲ搅拌消化,使子宫内膜组织和消化液充分混合,提高了消化效率,在较短的时间内取得了满意的消化效果,细胞获取量大,收集的原代活细胞多,且分离方法简便。②原代培养首次换液的时间宜在2~3 d,过早换液将丢失过多尚未贴壁细胞,实验过程中,第1天首次换液后,收集旧培养液离心洗涤,再接种仍有细胞生长;且原代细胞在培养4~5 d达到80%以上的融合才能传代成功,这可能与我们用的培养基中所加的胎牛血清浓度不同有关。③培养基中胎牛血清浓度保持在10% 左右为宜,过低由于缺乏生长因子刺激,细胞增殖较慢;而过高因含大量促进细胞生长增殖分化的因子,易引起细胞过早老化;④胰蛋白酶消化细胞时,可先将PBS润洗培养瓶2次,去除残留血清,更易将贴壁细胞消化下来,且消化时间缩短,不会因消化时间过长而对细胞造成损伤;⑤细胞传代时,注意接种密度,宜按1∶2比例传代,如此细胞才能保持良好的增长趋势,不会因接种密度过稀而致增长缓慢。
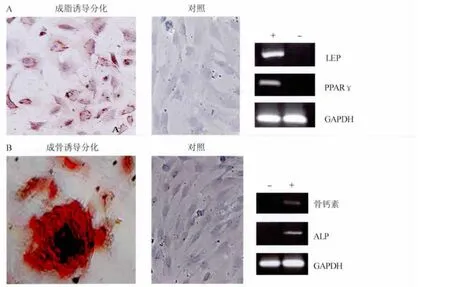
图6 子宫内膜基质干细胞多向分化能力检测Fig.6 In vitro differentiation of human endometrial stromal stem cells
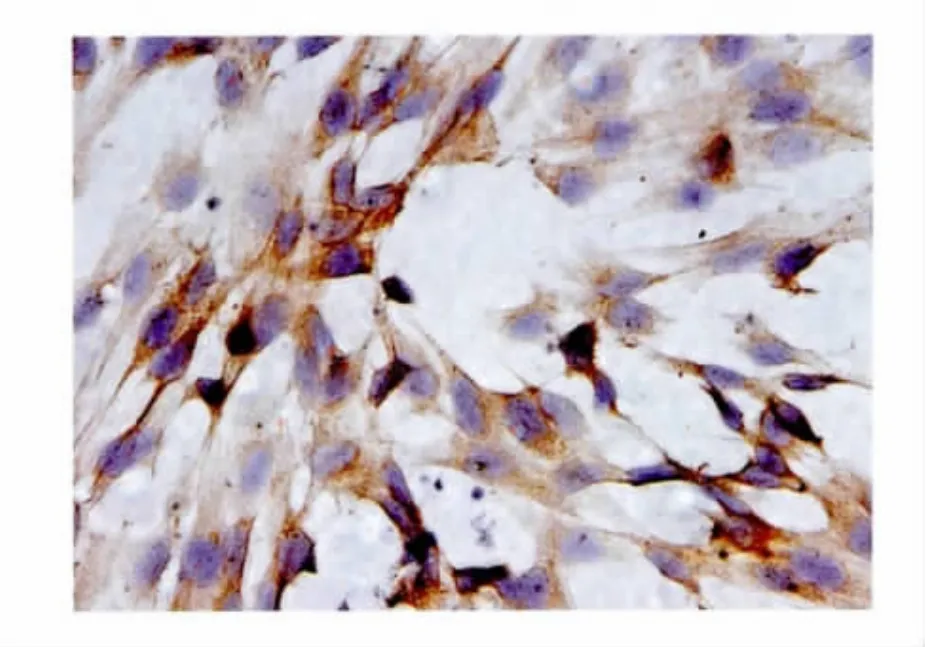
图7 子宫内膜基质干细胞OCT-4表达阳性(×200)Fig.7 Attached OCT-4 positive human endometrial stroma stem cell(×200)
子宫内膜干细胞目前缺乏特异性的表面标志[9],对它的识别是通过其细胞形态特征、增殖特点、干细胞特征性表面标志物及其功能性特征来综合分析。子宫内膜基质干细胞属于间充质干细胞(mesenchymal stem cells,MSCs),2005年国际细胞治疗协会(the International Society for Cellular Therapy,ISCT)定义了 MSCs的标准:首先,MSCs在标准培养条件下必须具备贴壁生长的特点;其次,MSCs表达 CD105、CD73 和 CD90,而 CD45、CD34、CD14 或CD11b、CD79a、CD19 表面分子表达阴性;第三,MSC在体外能分化为格根包尔氏细胞、脂肪细胞和成骨细胞。本实验在细胞培养过程中,通过倒置显微镜观察子宫内膜基质干细胞多呈梭形、不规则三角形,核为卵圆形位于靠近细质的中央,与骨髓间充质干细胞一样具有贴壁生长成纤维细胞样外观的体外生物学特征[10-11],Vimentin染色阳性,表明是基质细胞。尽管缺乏特异性的表面标志,但其表面标志物的检测对于干细胞的鉴定仍起着非常重要的筛选和鉴别排除作用。本实验流式细胞仪检测表面抗原显示,CD90、CD105表达阳性,不表达造血系标志CD34、CD45,表明获得的细胞为非造血类的、符合间充质干细胞的特点。
增殖能力是干细胞的一个重要的生物学特性,是选择组织工程种子细胞的一个重要考虑因素。测定生长曲线是观察细胞增殖生长基本规律的重要方法。从子宫内膜组织中分离培养的原代细胞接种后先经过4~5 d的生长迟缓期,然后进入增殖期,细胞在48 h内达到融合。而传代培养的干细胞潜伏期为3 d,第4天开始细胞进入快速增殖期,第6天进入平台期,实验结果的差异可能与细胞来源、接种密度、所用培养基和传代数有关。干细胞通过细胞周期分裂增殖,发生DNA复制的S期和G2-M期细胞比例高意味着此细胞群中发生有丝分裂的细胞较多,因而增殖能力较强。为进一步确认本实验所得细胞具有干细胞特性,采用成脂诱导剂(地塞米松、胰岛素、吲哚美辛和IBMX)培养基和成骨诱导剂(地塞米松;β-甘油磷酸钠;抗坏血酸)[1-3]诱导培养后,经特殊染色,RT-PCR 检测到LEP、PPARγ等脂肪细胞特异表达基因及成骨细胞特异表达基因骨钙素、ALP,证实子宫内膜基质干细胞具有向成脂、成骨方向分化的潜能[10]。子宫内膜基质干细胞的多向分化能力是在特定诱导条件下,这些细胞发生增殖、诱导并启动与细胞表型相关的特异性基因表达,因此,这些细胞朝着自己终末细胞方向分化。地塞米松对成脂、成骨分化具有双重作用,它依赖于使用剂量及作用时间等[12]。本实验应用低浓度(10-8mol/L)地塞米松配合抗坏血酸、β-甘油磷酸钠作为诱导剂,诱导子宫内膜基质干细胞表达ALP,3周后形成钙化结节;而较高浓度(10-7mol/L)的地塞米松与胰岛素共同作用激活细胞表面糖皮质激素受体,使其分化为脂肪细胞。
此外,转录因子Oct-4是多能干细胞和原始生殖细胞表达发育多能性的标志性基因,Oct-4免疫细胞化学染色阳性提示细胞是更为原始、增殖和分化能力更强的细胞。这些结果表明,用上述方法从子宫内膜组织中得到的细胞具有独特的细胞化学特征和表型,可以确定为子宫内膜基质干细胞。但是,到目前为止还未发现其特异性的标志,子宫内膜干细胞还有待于更深入的研究。
[1]PITTENGER M F,MACKAY A M,BECK S C,et al.Multilineage potential of adult human mesenchymal stem cells [J].Science,1999,284(5411):143-147.
[2]ZUK P A,ZHU M,ASHJIAN P,et al.Human adipose tissue is a source of multipotent stem cells[J].Mol Biol Cell,2002,13(12):4279-4295.
[3]GORO F,THOMAS T,HICOK K C.Differentiation of human marrow stromal precursor cells:Bone morphogenetic protein-2 increase OSF2/CBFA1,enhance osteoblast commitment,and inhabits late adipocyte maturation [J].J Bone Miner Bes,1999,14(9):1522-1535.
[4]CHAN R W,SCHWAB K E,GARGETT C E,et al.Clonogenicity of human endometrial epithelial and stromal cells[J].Biol Rep rod,2004,70(6):1738-1750.
[5]CHAN R W,GARGETT C E.Identification of labelretaining cells in mouse endometrium [J].Stem Cells,2006,24(6):1529-1538.
[6]KATO K,YOSHIMOTOM,KATOK,etal.Characterization of side-population cells in human normal endometrium [J].Human Reproduction,2007,22(7):1214-1223.
[7]GARGETT C E.Uterine stem cells:What is the evidence [J].Human Reproduction Update,2007,13(1):87-101.
[8]YANG Xinyuan,CHEN Wei,LI Xu(杨新园,陈葳,李 旭).Comparative study on culture methods of endometrial stromal stem cells[J].J Shanxi Med Univ(山西医科大学学报),2011,42(8):624-628.(in Chinese)
[9]CERVELLO I,MARTINEZ-CONEJERO JA,HORCAJADAS J A, et al.Identification,characterization and co-localization of labelretaining cell population in mouse endometrium with typical undifferentiated markers [J]. Human Reproduction,2007,22(1):45-51.
[10]DU H,TAYLOR H S.Contributionofbone marrow-derived stem cells to endometrium and endometriosis[J].Stem Cells,2007,259(8):2082-2086.
[11]KERNS,EICHLER H,STOEVE J,etal.Comparative analysis of mesenchymal stem cells from bone marrow,umbilical cord blood or adipose tissue[J].Stem Cells,2006,24(5):1294-1301.
[12]MALAVAL L,MODROWSKI D,GUPTA A K.Cellular expression of bone-related proteins during in vitro osteogenesis in rat bone marrow stromal cell cultures[J].J Cell Physiol,1994,158(3):555.
