白芍总苷对经肿瘤坏死因子-α诱导的HaCaT细胞细胞因子分泌的影响
2013-12-04张明爽李建军彭友华张建青徐观辉郑锦芬
张明爽 ,李建军 ,彭友华 ,张建青 ,徐观辉 ,郑锦芬
(1.北京大学深圳医院,深圳518036;2.北京大学医学部,北京100191)
银屑病是一种常见的慢性炎症性皮肤病,发病率较高,易复发,其病因病机至今仍不十分清楚。目前认为免疫异常是银屑病的重要发病机制之一。随着免疫学的发展,发现银屑病与T细胞失常有很大关系。局部浸润的T细胞和表皮角质形成细胞通过分泌肿瘤坏死因子-α(TNF-α)及白细胞介素-6、8、10(IL-6、8、10),干扰素-γ(IFN-γ)等细胞因子,在银屑病发生过程中起重要作用。白芍总苷(total gluco-sides of peony,TGP)是毛银科植物芍药的根部提取物,药理作用广泛,主要有抗炎、调节免疫、护肾、护肝、抗抑郁及影响细胞增殖等作用,临床研究发现其对银屑病治疗有确切的疗效。TGP可以在多个环节影响细胞免疫、体液免疫以及炎症过程,已有研究表明,TNF-α诱导的HaCaT细胞,可作为银屑病表皮细胞体外模型,因此,笔者通过检测TGP对经TNF-α诱导的HaCaT细胞因子 IL-6、8、10及IFN-γ的水平,探讨其在银屑病治疗中的可能抗炎机制。
1 材料与方法
1.1 一般材料 人永生化表皮细胞株HaCaT细胞购自美国标准生物品收藏中心(ATCC)。
1.2 试剂与仪器 试剂:DMEM干粉、胎牛血清、胰蛋白酶和细胞培养用青霉素-链霉素(Hyclone公司)、IL-6、8、10、IFN-γ ELISA 试剂盒(联科公司);仪器:CO2孵箱(美国热电3111型),倒置相差显微镜(日本Olympus CKX41型),酶标仪(Bio-RAD Model 680型)。
1.3 方法
1.3.1 细胞培养 HaCaT细胞培养在DMEM培养液中,另加10%胎牛血清,100 u/mL青霉素和50 u/mL链霉素。细胞在37℃、5%CO2条件下培养。细胞达到70%密度时进行传代,将处于对数生长期的HaCaT细胞消化,并以2×105个/mL细胞浓度,按每孔100 μL接种至96孔板。
1.3.2 细胞刺激和药物处理 传代的HaCaT细胞完全贴壁后,为观察TGP对TNF-α刺激的HaCaT细胞细胞因子分泌的影响,TNF试验组每孔均加入含 TNF-α 的培养基 100 μL,使其终浓度为 10 μg/L,培养12 h后换液,换成含不同浓度的TGP培养基200 μL,使其终浓度分别为 0,10,20,30,40 mg/L,对照组以原培养基培养12 h后,加入含不同浓度的TGP 培养基 200 μL,使其终浓度分别为0,10,20,30,40 mg/L,2组均置于37℃恒温孵箱中培养 48 h后取上清液待测。每组均设3个平行培养孔。
1.3.3 细胞因子的检测 采用ELISA法检测细胞培养上清液中 IL-6、IL-8、IL-10及IFN-γ的表达。具体方法参照说明书。
2 结果
2.1 TGP对经TNF-α诱导的HaCaT细胞IL-6分泌的影响 HaCaT细胞可自发分泌IL-6,经TNF-α刺激后,HaCaT细胞IL-6分泌量较对照组略有增加,但差异无统计学意义(P>0.05)。TGP可随着浓度的增加降低TNF试验组的IL-6的分泌,但对未经TNF-α刺激的对照组的IL-6分泌并无明显影响。见表1。
表1 PF对HaCaT细胞IL-6分泌的影响(n=3,±s,ng/L)
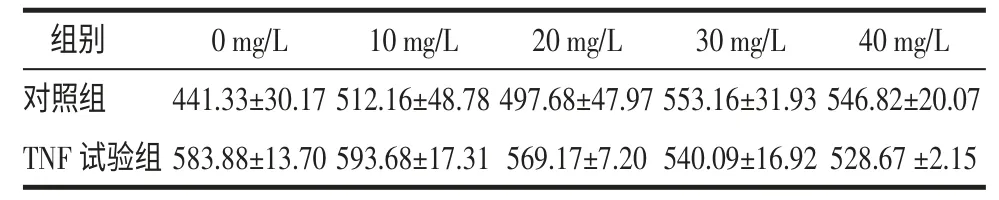
表1 PF对HaCaT细胞IL-6分泌的影响(n=3,±s,ng/L)
注:对照组组内:P<0.05;TNF 试验组内:P<0.05;对照组与 TNF 试验组组间:P>0.05。
组别 0 mg/L 10 mg/L 20 mg/L 30 mg/L 40 mg/L对照组 441.33±30.17 512.16±48.78 497.68±47.97 553.16±31.93 546.82±20.07 TNF 试验组 583.88±13.70 593.68±17.31 569.17±7.20 540.09±16.92 528.67 ±2.15
2.2 TGP对经TNF-α诱导的HaCaT细胞IL-8分泌的影响 HaCaT细胞可自发分泌少量IL-8,经TNF-α刺激后,HaCaT细胞IL-8的分泌量与对照组比较差异有统计学意义(P<0.001)。对照组试验结果示:低浓度的TGP对HaCaT细胞IL-8的分泌有一定的促进作用,但随着TGP作用浓度的升高这种促进作用逐渐减弱。TNF试验组结果示:TGP对经TNF-α作用后的HaCaT细胞IL-8的分泌有显著抑制作用,且该作用与作用浓度呈正相关。见表2。
表2 TGP对HaCaT细胞IL-8分泌的影响(n=3,±s,ng/L)

表2 TGP对HaCaT细胞IL-8分泌的影响(n=3,±s,ng/L)
注:对照组组内:P<0.05;TNF 试验组内:P<0.001;对照组与 TNF 试验组组间:P<0.001。
组别 0 mg/L 10 mg/L 20 mg/L 30 mg/L 40 mg/L对照组 5.64± 3.07 12.09± 1.68 10.46± 1.02 8.06±4.03 7.86± 2.00 TNF 试验组 344.84±66.41 218.25±13.29 180.40±23.68 166.04±3.74 150.84±14.83
2.3 TGP对经TNF-α诱导的HaCaT细胞IL-10分泌的影响 HaCaT细胞可自发分泌少量IL-10,经TNF-α刺激后,HaCaT细胞IL-10分泌量差异无统计学意义(P>0.05);加入 TGP 后,2组 IL-10的分泌量差异无统计学意义(P>0.05)。见表 3。
表3 TGP对HaCaT细胞IL-10分泌的影响(n=3,±s,ng/L)

表3 TGP对HaCaT细胞IL-10分泌的影响(n=3,±s,ng/L)
注:对照组组内:P>0.05;TNF 试验组:P>0.05;对照组与 TNF 试验组组间:P>0.05。
组别 0 mg/L 10 mg/L 20 mg/L 30 mg/L 40 mg/L对照组 1.76±0.61 1.54±2.00 2.90±0.25 2.35±1.79 2.77±1.19 TNF 试验组 0.83±0.40 1.48±0.34 2.30±1.06 2.14±0.25 3.28±2.23
2.4 TGP对经 TNF-α诱导的 HaCaT细胞 IFN-γ分泌的影响 HaCaT细胞可自发分泌少量IFN-γ,经 TNF-α刺激后,HaCaT细胞 IFN-γ的分泌量较对照组比较差异有统计学意义(P<0.001)。对照组试验结果示:TGP对HaCaT细胞IL-8的分泌有轻微抑制作用,但与作用前比较差异无统计学意义(P>0.05)。TNF试验组结果示:TGP对经TNF作用后的HaCaT细胞IL-8的分泌有显著抑制作用,且该作用与作用浓度呈正相关。见表4。
表4 TGP对HaCaT细胞IFN-r分泌的影响(n=3,±s,ng/L)

表4 TGP对HaCaT细胞IFN-r分泌的影响(n=3,±s,ng/L)
注:对照组组内:P>0.05;TNF试验组内:P<0.001;对照组与TNF试验组组间:P<0.001。
组别 0 mg/L 10 mg/L 20 mg/L 30 mg/L 40 mg/L对照组 2.833±0.09 3.36±0.24 2.52±0.48 2.36±0.55 1.79±0.63 TNF 试验组 42.16±0.44 33.72±0.82 30.43±0.48 26.40±0.32 15.66±0.09
3 讨论
银屑病是一种炎症增生性皮肤病,银屑病的主要病理表现即为KC异常增殖、分化不全及局部炎细胞浸润等炎症表现。研究发现,银屑病可能是一种Th1/Th2细胞平衡紊乱的炎症性疾病,Th1分化优势及Th1型细胞因子介导了银屑病的发生和发展[1]。细胞因子是一类糖蛋白分子,在机体的免疫应答及炎症反应方面均起着关键的作用,它们的产生和相互作用对机体防御疾病和维持生理平衡均有重要意义。许多皮肤病的发病和药物(类似物或拮抗物)的作用机制均与细胞因子表达紊乱有关[2]。帕夫林提取白芍的药效成分单体,主要为一组糖苷类物质,包括芍药苷、羟基芍药苷、芍药花苷、芍药内酯苷、苯甲酰芍药苷,统称为TGP。现代药理学研究表明TGP具有抗炎、镇痛、抗应激和双向调节免疫、保肝等作用,现已广泛应用于自身免疫性疾病的治疗[3]。有研究显示TGP具有抑制Th1型细胞因子,增强Th2型细胞因子效应的作用[4]。
HaCaT细胞是来源于正常成年人皮肤KC的永生化的细胞株。虽然有报道称HaCaT细胞与原代培养的表皮KC对某些刺激的反应有差异,但是HaCaT细胞具有和基底层KC相似的特征,而且其具有银屑病皮损处KC所表现的过度增殖的特征。因此,HaCaT细胞已被广泛用来作为体外抗银屑病药物的研究模型[5]。TNF-α是一种炎性细胞因子,有报道银屑病患者皮损处TNF-α水平增高,其可诱导角质形成细胞合成多种细胞因子,可促进角质形成细胞和血管内皮细胞表达细胞间黏附分子,增强中性粒细胞对内皮细胞的黏附能力,从而促进炎症细胞在局部的浸润和活化[2]。本次实验结果表明,HaCaT细胞能自发性分泌 IL-6、IL-8、IL-10、IFN-γ,用 TNF-α刺激 HaCaT 细胞后,其 IL-6、IL-8、IFN-γ 分泌量上升,其中以IL-8和IFN-γ增幅最为明显,与文献报道一致[6],而IL-10分泌量未见明显变化。根据银屑病免疫-炎症机制细胞因子网络学说,IL-6是由成纤维细胞、内皮细胞和在各种病理情况下侵入皮肤的炎症细胞产生的一种具有生物活性的刺激因子,为机体主要介导炎症反应的细胞因子,其在银屑病细胞因子网络中的主要作用是促使角质细胞异常增生及刺激T细胞活化[7],有研究表明,银屑病患者血清IL-6非常显著地高于正常人组(P<0.01),Paquet等[8]发现,银屑病角质细胞比正常人角质细胞对IL-6的刺激更敏感。IL-8是强力中性粒细胞趋化因子,当皮肤受到外源性致敏原和刺激因子作用后可由KC产生,在银屑病、天疱疮、疱疹样天疱疮和大疱性类天疱疮等自身免疫病以及鳞状细胞癌等肿瘤细胞中均呈高表达状态。IL-10也可由角质形成细胞产生,是一种Th细胞免疫抑制因子,研究发现其具有免疫抑制和抗炎作用,在调节Th1细胞来源的细胞因子中起重要作用,因而早期被称为细胞因子合成抑制因子[9]。研究证实IL-10的抗银屑病作用是通过调节角质形成细胞分泌细胞因子所致。IFN-γ主要由Th1细胞产生,其局部浓度的改变直接影响炎症反应的程度。研究发现IFN-γ可促进角质形成细胞增殖,当IFN-γ的作用被阻断时,角质形成细胞的增殖减慢,由角质形成细胞分泌的细胞因子也相应减少[10]。结果显示,体外培养角质形成细胞,在TGP的作用下,TNF-α试验组和对照组的IL-8及IFN-γ分泌量均下降,且TNF试验组下降更为明显;TNF-α试验组的IL-6分泌下降,而其对照组未见明显改变;TNF-a试验组及对照组的IL-10在作用前后均未见明显变化。以上研究结果提示TGP对HaCaT细胞细胞因子分泌的影响或许与其与TNF-α的相互作用有关,经TNF-α刺激后细胞内 IL-6、IL-8、IFN-γ的分泌量发生变化且其对TGP的作用变得更加敏感,因此,TGP很有可能是通过影响这些细胞因子分泌的变化,来达到调控表皮细胞增殖的作用。
本次研究证实了,TGP可以通过抑制IL-6、IL-8及IFN-γ的分泌发挥其免疫调节作用,这为相关皮肤病的治疗提供了一条新的思路。当然,目前该药在皮肤科的应用还属于初步研究阶段,为了更好地评估其疗效范围及安全性,尚需进行大规模的临床试验和研究。
[1]彭友华,李建军.信号传导与转录激活因子-3与银屑病[J].国际皮肤性病学杂志,2010,36(5):276-278.
[2]黄玲娟,钟江,王艺,等.细胞因子相关性及在银屑病发病机制中的作用[J].健康必读(中旬刊),2012,11(2):251-252.
[3]彭友华,李建军.白芍总苷在皮肤科的应用及研究进展[J].皮肤性病诊疗学杂志,2010,17(3):250-252.
[4]王玉英,熊小利,龙剑文,等.白芍总苷对静止期银屑病患者血清TNF-α及IL-8的影响 [J].现代中西医结合杂志,2009,18(18):2111-2112.
[5]江智茂,程滨珠,李建军,等.角质形成细胞的培养及其表皮生长因子受体表达[J].中国组织工程研究与临床康复,2007,11(3):423-426.
[6]刘晓雁,鲁杰,卢竞,等.银屑病患儿血清中肿瘤坏死因子α、白介素 6、白介素 8 的检测[J].临床皮肤科杂志,2001,30(5):304-305.
[7]胡银娥,王斌,瞿伟,等.NB-UVB联合白芍总苷治疗寻常型银屑病的疗效及对血清TNF-α、OPN及IL-6的影响[J].中国现代医生,2012,50(3):53-55.
[8]Paquer P,Pierard GE.Interleukin-6 and the skin[J].Int Arch Allergy Immunol,1996,109:308-317.
[9]赵飞,李红文,王诗淇,等.IFN-α对体外银屑病角质形成细胞分泌IL-10的影响[J].郑州大学学报(医学版),2007,42(4):730-732.
[10]田晓静.银屑病患者血清IL-8与TNF-α和IFN-γ检测的临床意义及与PASI评分的相关性[J].常州实用医学,2011,27(3):171-172.
