大剂量甲氨蝶呤治疗儿童急性淋巴细胞白血病的血药浓度及影响因素分析
2013-12-03顾敏李爽郝良纯李佳特张楠张继红
顾敏,李爽,郝良纯,李佳特,张楠,张继红
(中国医科大学附属盛京医院小儿血液内科,沈阳110004)
甲氨蝶呤(methotrexate,MTX)目前已成为应用于白血病、淋巴瘤、头颈部肿瘤、骨肉瘤以及多种自身免疫性疾病最为广泛的一种抗代谢药物,尤其是大剂量甲氨蝶呤(HDMTX)的应用对减少儿童急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)髓外白血病的发生,提高总体无病生存率起到了重要作用。尽管在MTX应用过程中加用水化、碱化治疗,但部分患者还是会出现MTX排泄延迟并出现相关不良反应,如黏膜损害、肝肾功能损伤等,甚至可危及生命。我科2010年1月至2011年1月间收治39例初诊ALL患儿应用HD-MTX治疗,进行157例次血药浓度监测分析,现将结果报道如下:
1 材料与方法
1.1 病例来源
2010年1月至2011年1月于我院儿科血液病房收治的39例ALL患儿,男26例,女13例,年龄10个月~14岁,平均年龄6岁,中位年龄4岁,平均体质量28.6 kg(9.5~89.0 kg),中位体质量20.0 kg,平均体表面积为0.9 m2(0.4~2.0 m2),中位体表面积为0.8 m2。根据中华医学会儿科学分会血液学组2006年儿童急性淋巴细胞性白血病诊疗建议(第3次修订草案)[1]对患儿进行分组,其中低危组17例,中危组14例,高危组8例。所有患儿接受HD-MTX治疗时均处于完全缓解期,治疗前对患儿进行血常规、肝肾功能和尿便常规检查、心电图及必要的骨髓形态学等检查。采用1、2、3、4、5、6个HDMTX 治疗的患者分别为2、1、3、23、8、2 例,共157 个疗程。
1.2 诊断及治疗方案
诊断及治疗参照中华医学会儿科学分会血液学组2006年儿童急性淋巴细胞性白血病诊疗建议(第3次修订草案)[1]。本研究中的39例患儿共接受157次髓外防治,MTX的应用剂量:低危组为2.0 g/m2、中危组为3.0 g/m2、中、高危组免疫表型为T表达者给予5.0 g/m2。总量的1/6剂量(每次≤500 mg)作为突击量,在30 min内快速滴入,余量于23.5 h用输液泵维持均匀滴入。突击量MTX开始滴入后0.5~2 h内进行三联鞘内注射1次。同时加用VDT方案,即第1天应用长春新碱(1.5 mg/m2),最大剂量为2 mg/次、第1天至第7天口服地塞米松[6~8 mg/(m2·d)]及硫鸟嘌呤或6-巯基嘌呤[50~75 mg/(m2·d)]。在开始滴注MTX36 h给予CF解救,剂量为每次l5~30 mg/m2,每6 h静脉注射、口服或肌肉注射1次,具体次数视MTX血药浓度而定,总解救量为MTX量的3%~5%。若24 h MTX 浓度>10 μmol/L、44 h>1.0 μmol/L、68 h>0.1 μmol/L,则提示代谢延迟。治疗过程还包括水化[第1~3天的水化量分别为3,2.5,2 L/(m2·d)]、碱化尿液[第1~3天的碱化量分别为130、100、80 mL/(m2·d)]治疗和预防性保护肝脏、心脏功能治疗。
在应用MTX44~48 h后开始进行MTX血药浓度监测,并依据MTX血药浓度值调整CF解救剂量,以后每24 h检测血药浓度1次,直至MTX血药浓度≤0.1 μmol/L方可停止解救。期间动态观察患儿是否出现皮肤、黏膜损害,并监测血、尿常规、肝肾功能的变化。
1.3 MTX血药浓度的检测
应用TDX荧光偏振免疫分析仪检测MTX血药浓度。
1.4 统计学处理
记录患儿性别、年龄、体质量、身高、体表面积、单位体表面积MTX用量、血药浓度、化疗前肝肾功能、尿常规、是否存在发热、感染等病理状态、单位体表面积碱化及水化量、对应化疗后尿常规等,分别观察上述因素对MTX血药浓度的影响。计量资料以t检验分析结果;计数资料行χ2检验。P<0.05认为差异有统计学意义。
2 结果
2.1 MTX血药浓度及影响因素分析
157例次HD-MTX治疗中HD-MTX2.0 g/m2者76例次,3.0 g/m2者76例次,5.0 g/m2者5例次。共检测MTX血药浓度237次,发生排泄延迟共44次(28%),其中44~48 h MTX血药浓度(C44-48)>1.0 μmol/L者32次(20.4%),68~72 h MT血药浓度(C68-72)>0.1 μmol/L者12次(7.6%)。C44-48平均值为1.0 μmol/L(0.05~9.5 μmol/L),中位值为0.39 μmol/L;C68-72平均值为0.40 μmol/L(0.02~3.4 μmol/L),中位值为0.14 μmol/L。根据MTX血药浓度及时调整CF解救剂量,直至MTX血药浓度≤0.1 μmol/L停止解救。代谢延迟患儿CF解救次数为5~37次,CF累积剂量为50~3300 mg,CF解救剂量占HD-MTX剂量的7.1%(1%~92%),中位值为3.8%。157例次HD-MTX治疗共采集C44-48125次,C68-7291次,C92-9621次。39例中26例(66.7%)至少有1个疗程排泄延迟,有14例(35.9%)至少有2个疗程排泄延迟,有4例(10.3%)至少有3个疗程排泄延迟。结果提示MTX代谢存在个体和同一个体不同时间的差异性。
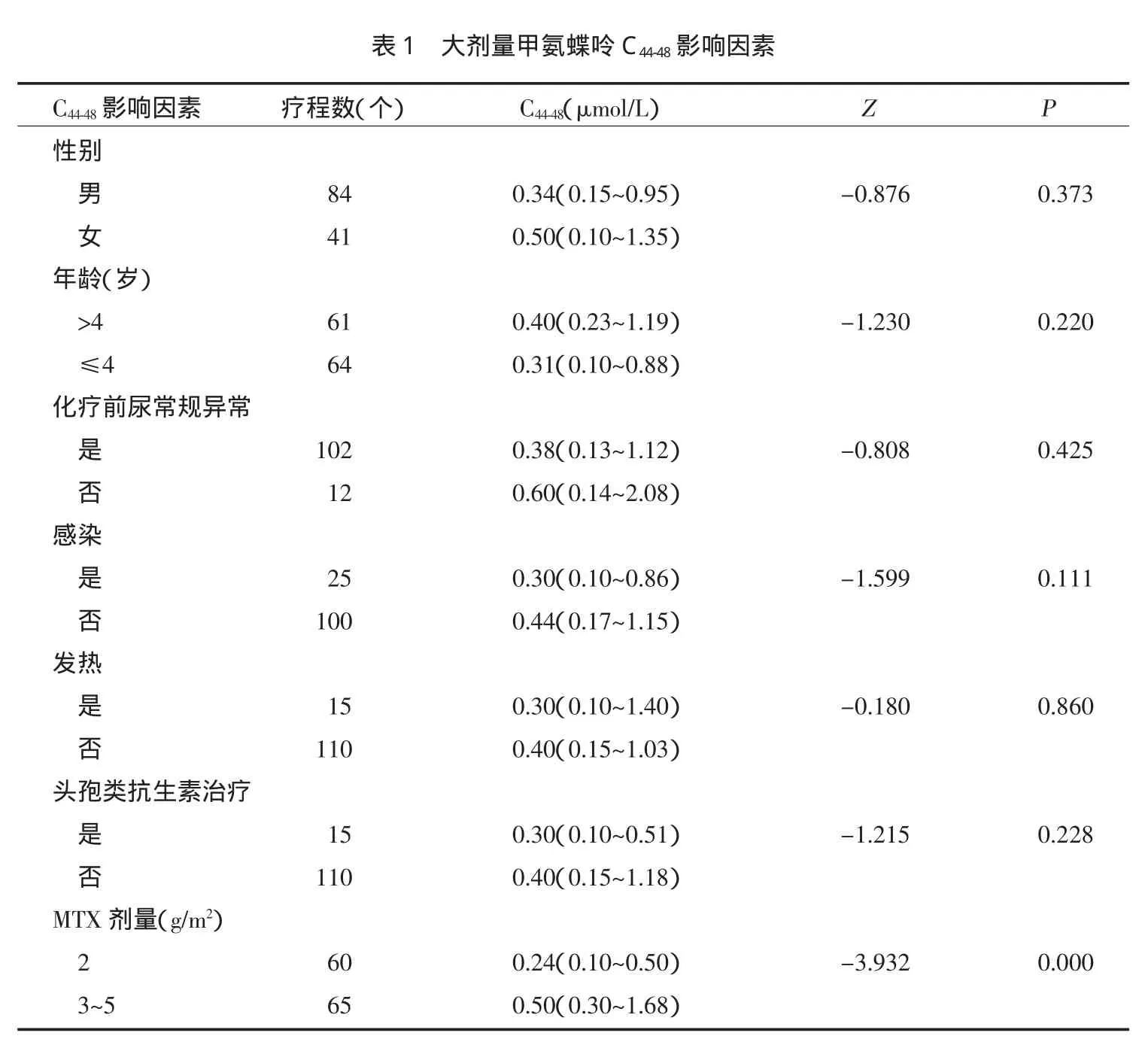
研究发现性别、年龄、总蛋白及白蛋白水平、化疗前是否存在感染、发热、尿常规异常患儿44~48 h MTX血药浓度无统计学差异,但2 g/m2组患儿44~48 h MTX血药浓度较3~5 g/m2组患儿明显降低(P<0.05),见表1。根据44~48 h甲氨蝶呤血药浓度是否>1 μmol/L分组,发现致甲氨蝶呤排泄延迟的危险因素有甲氨蝶呤用量、开始化疗后24 h内尿常规pH值,见表2。
2.2 不良反应
157例次HD-MTX治疗中有37例次(23.6%)发生不良反应,2/3以上表现为皮肤黏膜损害和胃肠道反应,主要表现为口腔黏膜溃疡、肛周皮肤破溃、皮疹,恶心呕吐、腹痛腹泻。其他不良反应可见肝肾功能损害如肌酐清除率下降(多见于排泄延迟患儿)、蛋白尿、尿淋漓、转氨酶水平升高,少见发热、骨髓抑制、过敏反应等,无严重感染发生,无死亡病例。并且发生排泄延迟患儿(10例次)与正常排泄患儿(5例次)消化道反应的发生率差异有统计学意义(P=0.001)。

3 讨论
本研究中C44-48分布情况显示MTX代谢存在个体和同一个体不同时间的差异性。这与文献报道一致[2]。国内外文献对MTX排泄影响因素报道不一,有研究认为患儿的年龄、身高、体质量影响MTX排泄[3,4];MTX药物剂量亦可影响MTX排泄[5,6]。本研究资料显示患儿一般情况(如性别、身高、体质量等)与MTX排泄延迟无相关性,但MTX剂量影响MTX排泄,2 g/m2组患儿44~48 h MTX血药浓度较3~5 g/m2组患儿明显降低(P<0.05),3 g/m2组排泄延迟率较2 g/m2组患儿升高(P<0.05)。Mir等[7]对26例骨肉瘤患者进行了 HD-MTX治疗,发现给予碱化治疗使尿pH值维持在7.5以上,与既往加强水化、碱化治疗相比未降低MTX的高峰浓度,在取得良好化疗效果的同时不良反应发生率降低,安全性良好;这与本研究结果一致,即开始化疗24 h内监测尿pH值≥7.0或<7.0者排泄延迟率低(P<0.05),这是因为甲氨蝶呤及其代谢产物均为弱酸性物质,在酸性的肾脏环境下可形成结晶阻塞肾小管,降低了甲氨蝶呤的排泄。因此若患儿尿pH值<7.0,应注意患儿是否存在排泄延迟。
除此之外大量研究已经证明甲氨蝶呤和叶酸代谢途径的基因多态性影响甲氨蝶呤排泄和化疗后的不良反应,如ABCC2基因突变可致介导MTX转运的多药耐药蛋白2功能缺失,从而导致MTX排泄延迟及可逆性肾损害;MTHFR677C>T突变基因型患者MTHFR酶活性下降,发生血液毒性和非血液毒性风险较野生型患者升高,而MTHFR酶活性正常的患者如将甲氨蝶呤剂量升高MTX相关毒性也并没有增加[8,9]。因此药物遗传学进一步发展可为实现药物个体化治疗、提高药物治疗安全、降低治疗风险提供依据和方法。
大剂量甲氨蝶呤除对肿瘤细胞产生毒性外,对所有快速分裂的正常细胞如胃肠道上皮细胞和骨髓细胞也有严重毒性。其不良反应发生率和严重程度直接取决于甲氨蝶呤血药浓度的高低和持续时间的长短。本研究发现患儿发生排泄延迟后消化道不良反应明显增加,与文献报道一致[10,11]。因此临床应用HD-MTX过程中出现消化道不良反应等表现时应警惕是否发生MTX排泄延迟。
综上所述,为了减轻MTX的不良反应,在治疗前尽可能让患儿处于比较良好的身体状态,做好水化、碱化,注意保护皮肤黏膜和肝功能,密切观察骨髓抑制状况,对MTX用量较高、24 h内尿pH值偏低及出现不良反应的患儿应提高警惕。并对药物浓度进行监测,给予适时适量四氢叶酸钙解救,防止出现危及生命的严重不良反应,但应避免过多的四氢叶酸钙解救而影响疗效。
[1]中华医学会儿科学分会血液学组.儿童急性淋巴细胞白血病诊疗建议(第三次修订草案)[J].中华儿科杂志,2006,44(5):392-395.
[2]Joannon P,Oviedo I,Campbell M,et al.High-dose methotrexate therapy of childhood acute lymphoblastic leukemia:lack of relation between serum methotrexate concentration and creatinine clearance[J].Pediatr Blood Cancer,2004,43(1):17-22.
[3]杨丽华,卢新天,卢炜,等.大剂量甲氨蝶呤在急性白血病患儿体内的群体药动学[J].中国药学杂志,2005,40(13):1007-1012.
[4]张春燕,顾健,李玉珍,等.大剂量甲氨蝶呤治疗329例儿童急性淋巴细胞白血病的群体药物动力学研究[J].中国实验血液学杂志,2008,16(1):106-I10.
[5]徐卫群,汤永民,方澄清,等.大剂量甲氨蝶呤治疗儿童急性淋巴细胞白血病排泄延迟分析[J].中华血液学杂志,2005,26(1):15-18.
[6]许宏,宋文琪,徐樨巍.儿童急性淋巴细胞白血病治疗中甲氨蝶呤血药浓度监测分析[J].中国新药与临床杂志,2010,29(11):850-852.
[7]Mir O,Ropert S,Babinet A,et al.Hyper-alkalinization without hyper-hydration for the prevention of high-dose methotrexate acute nephrotoxicity in patients with osteosarcoma[J].Cancer Chemother Pharmacol,2010,66(6):1059-1063.
[8]Castaldo P,Magi S,Nasti AA,et al.Clinical pharmacogenetics of methotrexate[J].Curr Drug Metab,2011,12(3):278-286.
[9]Salazar J,Altés A,del Río E,et al.Methotrexate consolidation treatment according to pharmacogenetics of MTHFR ameliorates eventfree survival in childhood acute lymphoblastic leukaemia[J].Pharmacogenomics J,2012,12(5):379-385.
[10]许静,李天嫒,徐康康,等.大剂量甲氨蝶呤治疗儿童急性淋巴细胞白血病排泄延迟分析[J].安徽医药,2009,13(12):1554-1555.
[11]王迪凡,牛晓辉,张清,等.骨肉瘤术前应用大剂量甲氨蝶呤化疗的药代动力学及临床分析[J].首都医科大学学报,2007,28(4):505-509.
