兔颈内动脉不同浓度丙泊酚输注药效学研究
2013-12-03尹红陈卫民朱俊超洪涛
尹红,陈卫民,朱俊超,洪涛
(中国医科大学附属盛京医院麻醉科,沈阳110004)
目前应用最广泛的动脉内选择性给药系统是颈动脉内给予麻醉药物,进行脑功能定位,即禾田试验(Wada test)[1]。随着现代微导管技术及其安全性的发展,动脉给药技术应用愈发广泛。现阶段研究最多的是颈动脉丙泊酚单次给药,主要研究药物在脑内分布,对脑功能、脑代谢、血脑屏障及全身系统的影响[2,3]。静脉麻醉药物丙泊酚具有高脂溶性、高蛋白结合率、超短效等特点,常用于禾田实验[4,5]。药物颈内动脉选择性给药药效及药代动力学特点目前还未完全明了,取决于所给药物的种类、剂量、给药速度及解剖结构的差异等等[6]。有学者报道颈动脉给药的药效关系和药物分布存在很大变异[7],故有必要进一步研究动脉内单次给药及持续给药的量效关系,以指导并进一步优化颈动脉给药临床疗效。本文旨在通过研究不同浓度丙泊酚对脑电的抑制作用,而揭示动脉内持续输注麻醉药物对大脑功能及其他系统的影响。
1 材料与方法
1.1 材料
动物:经中国医科大学盛京医院实验中心动物室提供大耳白兔25只,体质量2.0~2.5 kg,雌雄不限。
1.2 方法
前瞻性实验研究,随机对照盲法。
实验前2 h禁食水,实验时间均选择在9:00~12:00间进行。前1 d备皮、剃毛,麻醉状态下颈部及右股部血管神经分离。具体如下:颈部切开,仔细分离右侧颈总动脉及颈内静脉及其伴行的颈部神经,向上分离颈总动脉直至乳突部分叉处。分离颈总动脉向上外分支即颈外动脉,创面用庆大霉素冲洗以防感染,备第2天使用。第2天耳缘静脉芬太尼5.0 μg/kg,地塞米松10 mg给药,右股动脉连接多功能监护仪(Life Scope 9,NIHON KOHDEN,日本),监测有创动脉压(MAP)、心率(HR)、呼吸(RR)(SIEMENS·ELEMA AB,瑞典)。大脑状态指数(cerebral state index,CSI)。监测按照说明(Danmeter,DK-5000 Odense C,丹麦)、兔脑电预实验结果[8]及Pellegrino等[9]CSI用于犬的研究前额正中(Fp)为额中央电极(正极),顶正中(Cz)为负极,左侧颞乳突为参考电极,连续监测CSI、BS(Burst suppression ratio)值的变化。持续微量泵给予0.9%乳酸林格液10 mL·kg-1·h-1,恒温头灯保持体温在(36.0±0.5)°C。静脉内丙泊酚 8 mg/kg[10]诱导气管插管(ID3.0),自主呼吸,必要时辅助控制呼吸,维持EtCO2在35~45之间。动脉给药之前1.5%(V/V)异氟醚吸入维持麻醉状态(CSI保持在 60~75间)[11],打开颈部,分离显露右颈总动脉,结扎其分叉颈外动脉,置入套管针,针头位置定在颈总动脉分叉处下方约0.5 cm处固定,连接肝素封管双管连接管及预充丙泊酚及其微量泵备用。
按Dixon序贯法选择6个剂量组,颈内动脉持续输注丙泊酚。以每10 mL·kg-1·h-1为单位,每组实验(G1:0.33%;G2:0.5%;G3:1%丙泊酚)均10 s内推注1%丙泊酚3 mg/kg动脉内给药(bolus)诱导。继以60 mL·kg-1·h-1速度持续输注丙泊酚,若大脑状态指数(CSI)降低到50以下并出现BS>0维持10分以上者,同一组下一动物选择下一剂量组,即同一bolus后以50 mL·kg-1·h-1速度持续输注观察。若未出现CSI<50或BS>0或未维持10分以上者,同一组下一实验升高1个剂量。每一组以第一次变号的前一个动物作为实验开始,依次直到每组均出现6个交叉点后结束试验。每一实验动物接受3组实验,随机选择组别,前一组实验结束,恢复期观察CSI、BS及MAP、HR等生命体征变化。恢复期至少观察10 min,若期间实验兔出现麻醉变浅征象,则辅用异氟醚维持浅麻醉使CSI保持在70上下。恢复期结束后开始下一组实验。
剔除标准:试验中不耐受气管导管,出现体动,血压变化大于基础值的30%以上或者出血过多,CSI数值异常变化,不符合麻醉深度者剔除。
观察指标:5个时间点(T1:基础值;T2:丙泊酚输注前,T3:输注后2 min;T4:输注后5 min时点;T5:恢复5 min)记录兔 MAP、HR、CSI、BS 的变化,同时监测RR及EtCO2、SpO2、体温,并记录实验过程中出现的不良反应,如呼吸抑制、血压波动大于30%基础值、体动反应、出血等。
1.3 统计学分析
2 结果
2.1 一般资料
3组各完成24、25、24例,一般资料见表1。每例实验兔完成3组实验过程中未出现呼吸抑制、循环紊乱、体动反应、出血过多等并发症。整个实验过程中 EtCO2保持在35~45,体温维持在(36.0±0.5)℃间。麻醉开始后3组呼吸频率均显著降低,组间比较无统计学意义(P>0.05)。
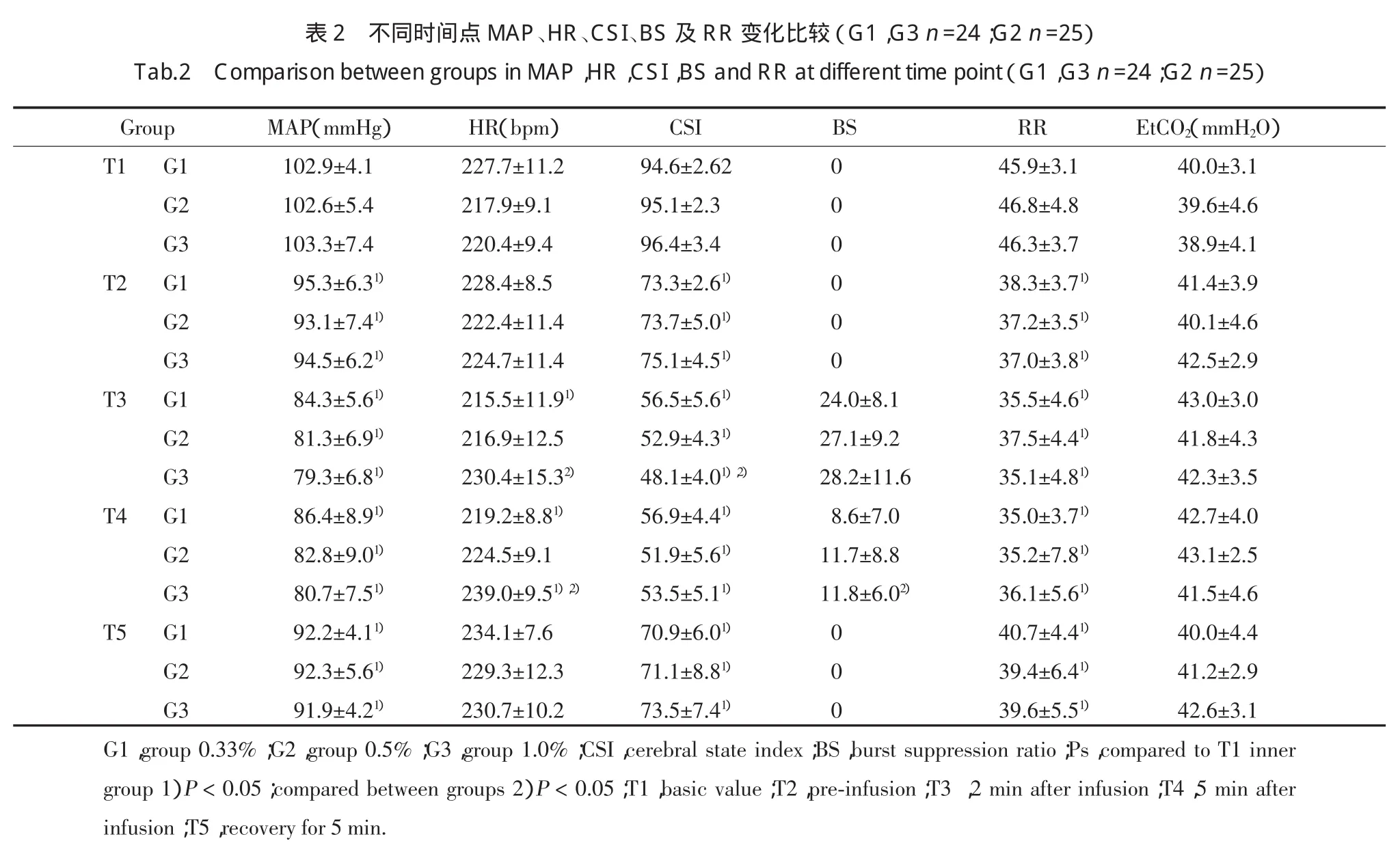
2.2 血液动力学变化
3组MAP在麻醉期间均有所降低(P<0.05),丙泊酚输注开始后2 min、5 min时点0.33%组HR降低(P<0.05),1.0%组 HR 则升高 P<0.05),且均高于前2组(P<0.05)。0.5%组HR变化无统计学意义。见表2。
T2时点CSI3组基本均维持在70~75间,均未出现BS值。丙泊酚输注开始后2 min CSI均降低,1%组CSI小于前2组(P<0.05),而此时BS组间比较差异无统计学意义。5 min时点3组CSI比较无明显差异,而1%组BS高于其他2组(P<0.05)。见表2。
2.3 序贯实验结果
经回归分析Probit检验得出0.5%组50%实验兔达到CSI<50,BS>0且维持10 min所需速度3组中最低,为29.263 mg·kg-1·h-1(95%可信区间为19.692~37.061),0.33%组为 41.761(95%CI:29.233~50.930),1.0%组为31.939 mg·kg-1·h-1(95%CI:9.116~42.320)。95%的实验兔达到此标准的速度0.5%组为在3组中最低,为45.320 mg·kg-1·h-1(95%CI:37.365~92.497)。0.33%组为 60.745 mg·kg-1·h-1(95%CI:51.344~128.895),1.0%组为54.969 mg·kg-1·h-1(95%CI:43.755~173.179)。见表3。

图1~3所示为实验兔达到锁定麻醉深度时的3组丙泊酚速度反应曲线。
3 讨论
与静脉给药比较,颈内动脉给药的临床意义在于:药物直接进入脑血管,通过血脑屏障发挥药效,具有起效更快、局部药物浓度更高、效果确切、用药量很少、全身毒副作用低等优点。因此,凡临床上靶器官是脑的药物,理论上均可通过颈内动脉直接给药。重要的是,经颈内动脉给药途径,目前尚未证明存在脑血管及脑组织不良反应的报道[12,13]。Wang等[14]实验表明颈内动脉输注丙泊酚为静脉用量的1/5左右,且无全身低血压和脑血流量的下降。所以在脑灌注危险因素存在的时候,颈内动脉给药更具潜在的优势。预实验中,我们尝试颈内动脉直接输注丙泊酚达到一定的麻醉深度,结果需要很高的持续输注速度才可达到脑电爆发抑制深度。同时我们注意到其他系统并发症(低血压、呼吸抑制等)随之出现。经过改进,预先颈内动脉给予负荷量达到一定的脑电抑制后再进行持续输注维持麻醉深度是可行的,并且循环方面也显示出比较稳定的特点。经本实验证实,颈内动脉持续输注丙泊酚可以维持一定的麻醉深度,达到脑电爆发抑制,同时循环、呼吸相对稳定,无明显不良反应出现。

CSI是一种新的麻醉深度/镇静程度监测指标,是采用脑电信号的子参数作为一种自适应神经模糊推理系统的输入,经证实CSI可以反映丙泊酚麻醉状态下脑电抑制情况及镇静程度[15]。已成功应用于临床麻醉深度监测以外[16,17]Ribeiro及其他学者研究CSI用于犬脑电监测,研究CSI反映丙泊酚TCI麻醉效应室浓度方面,CSI表现出与效应室丙泊酚浓度呈现负相关,说明CSI可以反映丙泊酚静脉诱导时犬脑电变化状态[18,19]。兔丙泊酚、异氟醚全麻状态下CSI保持在50~75之间,当伤害性刺激时表现出瞬间上升的趋势。试验当中只要阻抗控制在3 kΩ以内,即可得到较满意的监测结果[8]。而且兔颈动脉存在灵长类相似的颈内动脉和颈外动脉分叉,故我们选择兔作为实验对象[20]。
根据Chatrian等编著的《国际脑电图和临床神经生理学会的联盟术语汇编》,爆发性抑制波形(burst suppression pattern,BSP)定义为 θ波及(或)δ波有时混杂有更快的快波,呈爆发与介于其间的相对静止期的赋有特征的波形,通常是上述的高波幅爆发与10 μV以下近于平坦的低波幅脑电活动以数秒间隔相互交替出现的波形[21]。脑电爆发抑制波形定量描述即爆发性抑制比率(burst suppression ratio,BSR):是脑电图为量化这一特殊现象发展而成的一个时域参数。为了计算这一参数,定义抑制波为那些持续时间大于0.50 s,且在此期间波幅不能够超过约±5.0 μV的周期。计算抑制周期占整个爆发性抑制模式持续时间长度的比率即为BSR。
爆发性抑制模式不仅可作为大脑皮层电生理抑制的标志,而且可成为使用全身麻醉药保护脑组织合适剂量的指示。之前有报道称丙泊酚达到脑电50%爆发性抑制时,脑血流已接近最大程度的降低[22]。为降低因丙泊酚颈内动脉输注所引起的脑血流改变,及先前所预测的颈动脉给药药代动力学不确定性,本实验仅以BS出现>0、CSI<50达到10 min为所要达到的麻醉深度,研究不同浓度丙泊酚不同输注速度所产生的麻醉效应。
兔静脉麻醉丙泊酚用量一般为7~8 mg/kg,维持浓度为0.7 mg·kg·-1·min-1[23]。盖成林等[24,25]研究犬及人颈内动脉丙泊酚麻醉可行性得出动脉麻醉诱导及维持用量为静脉所需用量的1/3~1/5。在预实验中,丙泊酚颈内动脉输注达到脑电爆发抑制的药量比较大,几乎达到80 mg·kg-1·h-1。我们注意到如果预先给予负荷量,单次剂量继以持续输注模式,所需药量会大大降低。故我们选择动脉单次给药量为静脉诱导药量的1/3,探讨持续输注达到一定麻醉深度,即达到脑电爆发抑制的同时CSI<50,维持10 min以上所需的最佳浓度,速度组合。从序贯实验Probit检验结果分析:0.5%丙泊酚组50%实验动物达到所需麻醉深度的有效速度是29.26 mg·kg-1·h-1,1.0%组与之相差不多为31.939 mg·kg-1·h-1。而0.5%丙泊酚组95%可信区间较集中,在19.692~37.061 mg·kg-1·h-1间,说明0.5%丙泊酚颈内动脉持续输注速度在29.26 mg·kg-1·h-1左右时可以达到相对稳定的麻醉深度。而1.0%组95%可信区间较离散,在9.116~42.320 mg·kg-1·h-1间,从药代药效学理论分析有可能是高浓度丙泊酚直接通过血脑屏障,除了一部分发挥麻醉效应外,高浓度药物未被脑组织全部吸收,动脉血流不断稀释,药物再分布,蛋白结合及脑内局部分布不平衡等因素出现速度范围较广[26,27]。而降低给药浓度,提高给药速率,会降低因动脉血流所产生的局部药物分布不均的现象,产生相对稳定的脑组织效应室浓度。0.33%组所需给药速度相当于静脉给药速度,为 41.761 mg·kg-1·h-1,其浓度只是静脉用药的1/3,这样在达到同一药效的同时可以降低因药物余量所引起的其他系统不良反应。理论上,颈内动脉所给药物浓度高于单位时间内脑摄取的最大能力,则药物多余部分直接入静脉系统再分布。这样进入循环而产生所不希望的不良反应如循环抑制等。从本研究结果分析,0.5%丙泊酚颈内动脉持续输注所需速度为静脉用药的1/2,同时总药量也降低1/2,总体上仅为静脉用药量的1/4,而且术后观察未见其他不良反应。
因为尚缺乏对颈内动脉持续给药药代动力学特点的深入研究,本实验仅持续给药10 min观察所能达到的药效及所需药量。在今后的研究中还需扩大实验例数及有关颈内动脉长时间给药有可能存在的不良反应如血脑屏障,脑血管功能及其微观变化等的研究。
综上,颈内动脉持续输注不同浓度丙泊酚可以达到脑电爆发抑制的麻醉深度,高浓度丙泊酚持续输注10 min达到一定麻醉深度所需给药速度范围较广,而降低给药浓度,可以提高所需药物速度的稳定性,与静脉持续给药相比,降低麻醉药用量而避免药物余量所产生的不良反应。
[1]Baxendale S.The Wada test[J].Curr Opin Neurol,2009,22,(2):185-189.
[2]Coubes P,Baldy-Moulinier M,Zanca M,et al.Monitoring sodium methohexital distribution with [99 mTc]HMPAO with single photon emission computed tomography during Wada test[J].Epilepsia,1995,36(10):1041-1049.
[3]Joshi S,Wang M,Etu JJ,et al.Bolus configuration affects dose requirements of intracarotid propofol for electroencephalographic silence[J].Anesth Analg,2006,102(6):1816-1822.
[4]Bazin JE,Picard P,Gabrillargues J,et al.Propofol administered via the carotid artery to achieve a Wada test[J].Can J Anaesth,1998,45(7):707-708.
[5]Takayama M,Miyamoto S,Ikeda A,et al.Intracarotid propofol test for speech and memory dominance in man [J].Neurology,2004,63(3):510-515.
[6]Hassenbusch SJ,Anderson JH,Colvin OM.Predicted and actual BCNU concentrations in normal rabbit brain during intraarterial and intravenous infusions[J].J Neurooncol,1996,30(1):7-18.
[7]Trenerry MR,Loring DW.Intracarotid amobarbital procedure.The Wada test[J].Neuroimaging Clin N Am,1995,5(4):721-728.
[8]Yin H,Chen WM,Zhao P.Cerebral state index may reflex electrical brain activity during propofol or isoflurane anaesthesia in rabbits[J].Veterinary Record,2013,172(7):184.
[9]Pellegrino FC,Sica REP.Canine electroencephalographic recording technique:findings in normal and epileptic dogs[J].Clin Neurophysiol,2004,115(2),477-487.
[10]Aeschbacher G,Webb AI.Propofol in rabbits.Determination of an induction dose[J].Lab Anim Sci,1993,43(4):324-327.
[11]Patel P,Mutch W.The cerebral pressure-flow relationship during1.0 MAC isoflurane anesthesia in the rabbit:The effect of different vasopressors[J].Anesthesiology,1990,72(1):118-124.
[12]Murphy EJ.Intra arterial injection ofrterial injection of metoclopramide,midazolam,propofol and pethidine[J].Anaesth Intensive Care,2002,30(3):367-369.
[13]Macpherson RD,Rasiah RL,Melod LJ.Intraarterial propofol is no tdirectly toxic to vaseular endothelium [J].Anesthesiology,1992,76(6):967-971.
[14]Wang M,Joshi S,Emerson RG.Comparison of intraearotid and intravenous propofol for electrocerebral silence in rabbits[J].Anesthesiology,2003,99(4):904-910.
[15]Zhong T,Guo QL,Pang YD,et al.Comparative evaluation of the cerebral state index and the bispectral index during targetcontrolled infusion of propofol[J].Br J Anaesth,2005,95(6):798-802.
[16]Anderson RE,Jakobsson JG.Cerebral state index response to incision:a clinical study in day-surgical patients[J].Acta Anaesthesiol Scand,2006,50(6):749-753.
[17]Cortinez LI,Delfino AE,Fuentes R,et al.Performance of the cerebral state index during increasing levels of propofol anesthesia:A comparison with the bispectral index[J].Anesth Analg,2007,104(3):605-610.
[18]Ribeiro LM,David A.Brain monitoring in dogs using the cerebral state index during the induction of anaesthesia via target-controlled infusion of propofol[J].Res Vet Sci,2008,85(2):227-232.
[19]Peter JA,Henrik S.Cerebral state monitoring in Beagle dogs sedated with medetomidine[J].Vet Anaesth Analg,2006,33(4),237-240.
[20]Joshi S,Wang M,Hartl R.Retinal discoloration test[J].JCereb Blood Flow Metab,2004,24(3):305-308.
[21]Rampil IJ.A primer for EEG signal processing in anesthesia[J].Anesthesiology,1998,89(4):980-1002.
[22]Doyle PW,Matta BF.Burst suppression or isoelectric encephalogram for cerebral protection:evidence from metabolic suppression studies[J].Br J Anaesth,1999,83(4):580-584.
[23]Aeschbacher G,Webb AI.Propofol in rabbits.2.Long-term anesthesia[J].Lab Anim Sci,1993,43(4):328-335.
[24]盖成林,陈卫民,郑晓春,等.犬颈内动脉和股静脉输注丙泊酚达脑电静息的作用比较[J].中华麻醉学杂志,2007,27(3):232-235.
[25]盖成林,陈卫民,冉德春,等.颈总动脉输注丙泊酚维持全身麻醉的临床观察[J].南方医科大学学报,2008,28(8):1422-1424.
[26]Agid R,Rubinstein R,Siegal T,et al.Does streaming affect the cerebral distribution of infraophthalmic intracarotid chemotherapy?[J].Am J Neuroradiol,2002,23(10):1732-1735.
[27]Saris SC,Blasberg RG,Carson RE,et al.Intravascular streaming during carotid artery infusions.Demonstration in humans and reduction using diastole-phased pulsatile administration[J].J Neurosurg,1991,74(5):763-772.
