食品中沙门氏菌的NASBA快速检测技术
2013-12-02钟响刘宁尹伟力耿金培粟智平段效辉
钟响,刘宁,尹伟力,耿金培,粟智平,段效辉
(烟台出入境检验检疫局,山东 烟台 264000)
食品安全问题中最常见却最易被忽视的原因就是食物被致病性细菌污染。根据《卫生部关于2012年全国食物中毒事件情况的通报》[1],微生物性食物中毒事件的报告起数和中毒人数均为最多。沙门氏菌是最重要的食源性致病菌中之一,属于肠杆菌科,是肉及肉制品、蔬菜甚至水产品感染的重要来源。我国沙门氏菌的检验方法多采用传统方法,操作繁琐,耗时较长,很难适应食品安全和公共卫生事件应急处理快速反应的需要;同时,由于沙门氏菌属有2000种以上的血清型,生化反应、血清学反应多有交叉,因此传统检测方法在特异性和敏感性上也有其局限性[2-3]。
NASBA (nucleic acid sequence-based amplification)技术,即依赖核酸序列的扩增技术,是在PCR基础上发展起来的一种扩增RNA的新型分子生物学检测技术。NASBA技术操作简便,不需要特殊仪器;不需要温度循环,42℃2 h左右可将模板扩增109~1012倍,灵敏度高;由于外源双链DNA无T7启动子序列,不会被扩增,大大提高了NASBA反应的特异性[4-5]。NASBA已成功应用于禽流感、麻疹病毒、带状疱疹病毒、轮状病毒、丙肝病毒、口蹄疫病毒、草莓斑驳病毒等多种病毒检测[6-13],但在DNA病原菌检测中的研究甚少。本研究将NASBA技术用于食品中沙门氏菌的检测,可缩短检测周期,提高检出率,为进出口和国内食品安全提供强有力的技术保障。
1 材料与方法
1.1 试剂与仪器
1.1.1 标准菌株
鼠伤寒沙门氏菌Salmonella typhimurium ATCC 14028,甲型副伤寒沙门氏菌Salmonella paratyphi A ATCC9150,大肠埃希氏菌Escherichia coli ATCC25922,金黄色葡萄球菌Staphyloccocus aureus ATCC25923,均来源于美国典型培养物保藏中心。
1.1.2 主要试剂
细菌总RNA提取试剂盒:商品名E.Z.N.ATM,美国Omega公司;T7RNA聚合酶(20 U/μL)、RNAseH(5U/μL)、AMV(20 U/μL)、NTP(4×25μmol×100 mM)、dNTP(4×10 mM each)、RNA Laddder、引物(上海生工),RNasin(40 U/μL)、6×RNA Loading buffer、50×TAE、EB:北京鼎国培养基等:北京陆桥。
1.1.3 主要仪器
PTC-200型PCR基因扩增仪:美国MJ公司;BioPhotometer核酸蛋白分析仪:德国eppendorf;多用电泳系统PROTEAN II:美国BIO-RAD;凝胶成像系统Alpha Imager2200:美国 Alpha Innotech。
1.2 方法
1.2.1 引物设计
依据沙门氏菌属invA基因保守序列设计引物,序列如下(画线部分为T7 RNA聚合酶结合位点):
SM-F:5’-AATTCTAATACGACTCACTATAGGGAG CTGCGGTATTCGTGACTT-3’
SM-R:5’-GTGGTGGTCGCAGTTG-3’
1.2.2 总RNA的提取
按照细菌总RNA提取试剂盒E.Z.N.ATM说明提取细菌总RNA,测定OD值,评价RNA质量。
1.2.3 NASBA扩增
1)在25μL扩增体系中加入 AMV反转录酶Buffer(5×)5μL,T7 RNA 聚合酶 Buffer(5×)5μL,RNaseH Buffer(10×)2.5μL,RNasin(RNA 酶抑制剂,40 U/μL)0.5μL ,上、下游引物(15μmol/L)各 1μL,RNA 模板 2μL;置于 65℃、5 min,使 RNA 解链;然后立即置于42℃、5 min。
2)迅速加入 T7 RNase(20 U/μL)2μL,AMV 逆转录酶(20 U/μL)0.4μL ,RNaseH(5 U/μL)0.05μL,无菌ddH2O补至25μL;小心混匀并轻微离心,置于42℃中孵育90 min;反应完成后立即将反应管置于-20℃终止反应,备用。
1.2.4 电泳及结果记录
将冷却的NASBA产物点样于2.0 g/L琼脂糖凝胶,置于1×TAE缓冲液中,5 V/cm电压电泳20 min,EB染色10 min,在凝胶成像系统下观察并记录结果。
1.2.5 特异性试验
取鼠伤寒沙门氏菌ATCC14028,甲型副伤寒沙门氏菌ATCC9150,大肠埃希氏菌ATCC25922,金黄色葡萄球菌ATCC25923,按1.2.3和1.2.4进行特异性反应。
1.2.6 灵敏度试验
将提取的细菌总RNA稀释成同样浓度40ng/μL,用 DEPC 处理灭菌水稀释为 10-1、10-2、10-3、10-4、10-55个梯度,分别进行NASBA扩增,试验步骤同1.2.3和1.2.4。
1.2.7 人工污染样品验证试验
1.2.7.1 人工污染样品
按表1所示人工污染9份样品。
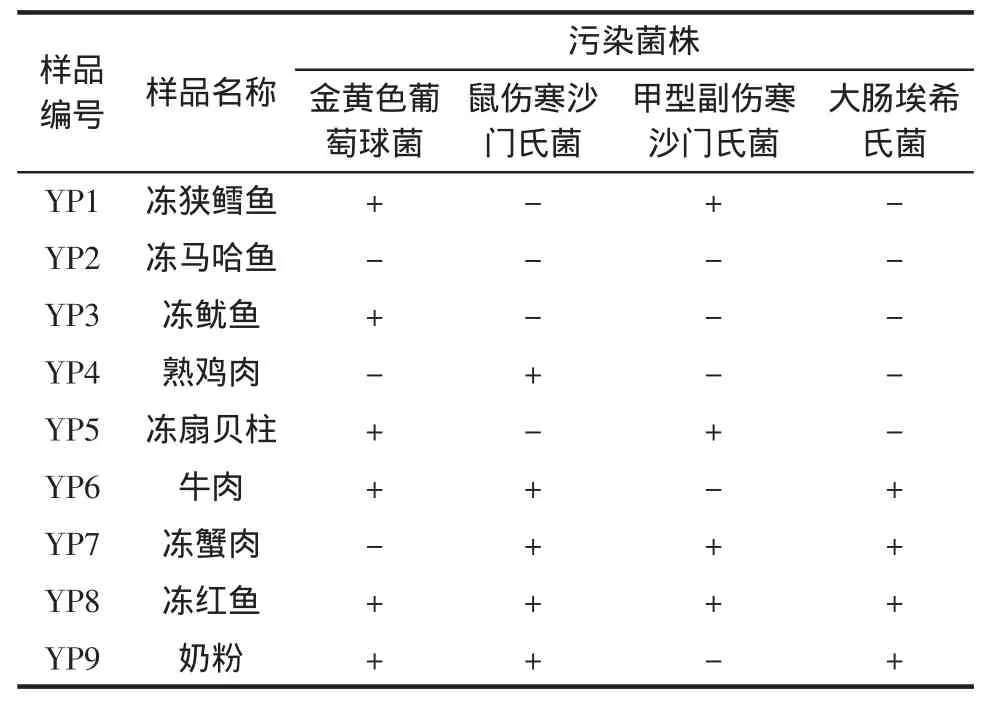
表1 人工污染样品情况Table 1 Artificially contaminated samples
1.2.7.2 样品的增菌
各取样品25 g,加入225 mL缓冲蛋白胨水,36℃培养18 h~24 h。
1.2.7.3 NASBA扩增及菌种鉴定
将上述增菌液提取总RNA,进行NASBA扩增,电泳观察结果。同时按照GB 4789.4-2010《食品安全国家标准食品微生物学检验沙门氏菌检验》进行沙门氏菌鉴定。
2 结果与分析
2.1 特异性试验
以鼠伤寒沙门氏菌、甲型副伤寒沙门氏菌、金黄色葡萄球菌和大肠埃希氏菌总RNA及无菌水(CK)作为模板,加入引物SM-F/SM-R,进行NASBA试验,结果见图1。结果显示,该对引物只有在模板为沙门氏菌属的扩增反应中出现明亮的条带,大小约为277 bp,并且两种沙门氏菌均能够扩增,而其余3种RNA未出现扩增信号,结果与预期相符,表明引物SM-F/SM-R的特异性较强。
2.2 灵敏度试验

图1 沙门氏菌特异性试验NASBA扩增结果Fig.1 The specificity test of Salmonella
从鼠伤寒沙门氏菌中提取的总RNA浓度为54.6ng/μL,稀释后浓度为:5.5ng/μL、550 pg/μL、55 pg/μL、5.5 pg/μL、550 fg/μL。分别用这些 RNA 作模板、SM-F/SM-R作引物进行NASBA扩增,结果表明(图2),当RNA稀释至10-5(即550 fg/μL)时,检测不到信号,因此该方法检测的灵敏度可达10-4,即5.5 pg/μL总RNA。
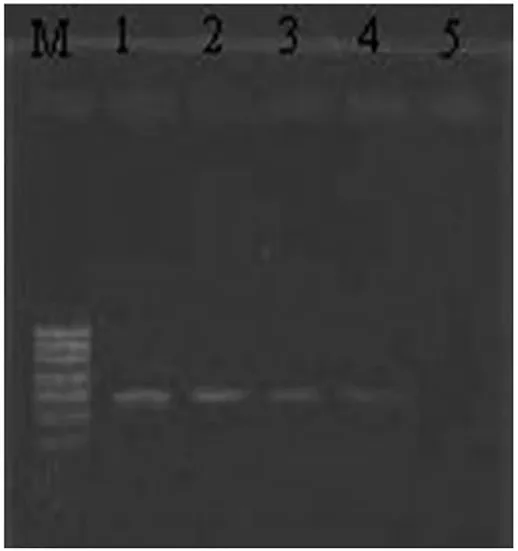
图2 鼠伤寒沙门氏菌灵敏度试验NASBA扩增结果Fig.2 The sensitivity test of Salmonella
2.3 人工污染样品的检测
以增菌后的9份人工污染样品RNA、阳性质控鼠伤寒沙门氏菌标准菌株RNA和阴性质控无菌水作为模板,SM-F/SM-R作为引物进行NASBA检测沙门氏菌的验证试验,结果见图3。结果显示,阳性质控出现约277 bp的明亮条带,阴性质控无条带,添加鼠伤寒沙门氏菌的4号、6~10号样品和添加甲型副伤寒沙门氏菌的1、5、7、8号样品均出现明亮的特异性条带,大小约为277 bp,其余2种样品RNA未出现扩增信号,结果与样品实际添加情况相符。

图3 沙门氏菌人工污染样品NASBA扩增结果Fig.3 Results for detecting Salmonella in artificially contaminated samples by NASBA
3 结论与讨论
本研究建立了食品中沙门氏菌的NASBA检测方法,进行了方法的特异性和灵敏度试验,同时验证了对样品检测的实际应用效果。结果表明:应用NASBA技术检测沙门氏菌特异性强,能够从背景复杂的样品中检测出目标菌,试验中无假阳性和假阴性结果;灵敏度高,对目标菌的检出限达到10-4,即pg/μL级总RNA;检测周期短,除增菌步骤外,只需要3 h~4 h即可得到结果,完成样品中目标菌的筛选。
需要注意的是,食品一般要经过加工、深加工、冷冻/冷藏、包装等步骤,在此过程中微生物很可能受到损伤,因此有必要先复苏样品中的受损菌,如果不经过增菌直接进行NASBA检测,则极有可能造成漏检。本研究建立的方法可大大缩短检测时间,虽然为保证样品的检出率和准确性,需要进行增菌复苏,但仍可将接收样品至出具报告整个流程缩短至最短24 h。NASBA检测的阳性结果仍需经生化确认。
另外,本研究为了更适用于基层检验机构和现场快速检测,对于NASBA产物采用了最直观、最简便的琼脂糖凝胶电泳检测方法,但这种方法只能对目标菌定性。如果需要进行定量研究,应考虑基于电化学发光原理的NASBA-ECL检测法、分子信标与NASBA结合的AmpliDet RNA技术以及原位NASBA(IS-NASBA)技术[14]。
[1]卫生部办公厅.卫生部办公厅关于2012年全国食物中毒事件情况的通报[EB/OL].中华人民共和国国家卫生和 计划生育委员会官方网站,(http://www.moh.gov.cn/mohwsyjbgs/s7860/201303/b70872682e614e4189d0631ae5527625.shtml),2013-02-26
[2]陈金顶,索青利,廖明,等.沙门氏菌的invA基因序列分析与分子检测[J].中国人兽共患病杂志,2004,20(10):868-871
[3]赵春艳.影响食品安全的食源性致病菌快速检测技术研究进展[J].西藏科技,2010(7):36-38
[4]Ramona L T,Arne S,AndreasM.Comparison of in-house PCR,rapid ELISA and NASBA technology for the detection of respiratory syncytial virus in clinical specimen[J].J Clin Virol,2008,41(2):168-169
[5]Nigel Cook.The use of NASBA for the detection of microbial pathogens in food and environmental samples[J].J Microbiol Methods,2003(53):165-174
[6]高闪电,常惠芸,丛国正.NASBA(依赖核酸序列的扩增)技术及其在病毒检测中的应用[J].中国生物工程杂志,2009,29(1):80-85
[7]Lau L T,ScottM R,Donald PK.Detection of foot-and-mouth disease virus by nucleic acid sequence-based amplification(NASBA)[J].VetMicrobiol,2008,126(13):101-110
[8]Yao J,Liu Z,Lung-Sang K,et al.Quantitative detection of HIV-1 RNA using Nucli Sens EasyQ HIV-1 assay[J].J Virol Methods,2005,129(1):40-46
[9]Van Strijp D,ZintiliniC,Deiman B,et al.HSV1 and HSV2 detection usingareal-time DNANASB Aassay[J].JClinVirol,2006,36(3):54
[10]Julie J,Doris H D.Multiplex nucleic acid sequence-based amplification for simultaneous detection of several enteric viruses in model ready-to-eat foods[J].Appl Environ Microbiol,2004,70(11):6603-6610
[11]Deiman B,Schrover C,Moore C,et al.Rapid and highly sensitive qualitative real-time assay for detection of respiratory syncytial virus A and B using NASBA and molecular beacon technology[J].J Virol Methods,2007,146(1/2):29-35
[12]骆利敏,黄建生,李明.应用NASBA定量检测HCV RNA的研究进展[J].Journal of Tropical Medicine,2002,2(1):64-66
[13]寇晓霞,吴清平,范宏英.轮状病毒NASBA检测研究[J].微生物学报,2006,46(2):328-330
[14]秦维超.NASBA和IS-NASBA的临床应用及研究进展[J].国际检验医学杂志,2006,27(3):158-163
