凝结芽孢杆菌芽孢高产固体发酵的研究*
2013-11-30张邑帆付利芝黄金秀周晓蓉杨飞云
杨 柳,郑 华,张邑帆,付利芝,黄金秀,周晓蓉,杨飞云*
(1.重庆市畜牧科学院,重庆 荣昌,402460;2.农业部养猪科学重点实验室,重庆 荣昌,402460;3.养猪科学重庆市市级重点实验室,重庆 荣昌,402460)
近些年来,在畜牧业生产中,许多活菌被选作益生菌用以调整动物肠道内正常的微生态平衡,其中的芽孢形成菌广泛地用作微生态饲料添加剂[1]。由于孢子具有对不良环境的抗性,长时间保存的特点,孢子就成为益生素菌种最优先选择的生物质形式[2]。凝结芽孢杆菌(B.coagulans)是一株目前公认为安全的芽胞形成菌[3],广泛地用作饲料添加剂的益生菌种(http://www.aafco.org/)。它能较好的防控腹泻、促进营养物质的消化吸收、提高猪平均日增重和降低饲料成本[4]。作为一株益生菌种,凝结芽孢杆菌的液体发酵研究比较深入,但由于该方法需要精密的仪器、专业的技术人员和大量的能源,以及产生大量的废弃物等的不足[5],推广很受限制。然而,由于固体发酵具有操作简单、可利用农副产物和几乎不产生废物的特征[6],近些年来固体发酵法在一些国家,特别是在发展中国家再次受到了高度的关注。
本研究凝结芽胞杆菌固体发酵中的底物、湿度、初始pH和添加营养物质等各项因素对芽胞形成的影响,确定了固体发酵的最佳条件,为提高菌种芽孢的产量、降低生产成本、促进工业化生产提供依据。
1 材料与方法
1.1 种子菌液的制备
将种子菌(即凝结芽孢杆菌重庆分离株1,B.coagulansCQ1)接种于LB平板培养基上,在37 ℃培养24 h,活化菌种。之后挑取单菌落,接入装有50 mL LB液体培养基的250 mL的三角瓶中,37 ℃,150 r/min振摇过夜培养,测定OD450值。
1.2 发酵条件的筛选
1.2.1 固体发酵与芽孢计数 称量底物20 g,装到250 mL三角瓶中,加入适当量的溶液,混合均匀后115 ℃灭菌30 min,冷却到室温。取2 mL种子菌液加到灭菌生理盐水中,混匀,添加到灭菌冷却底物之中,搅拌均匀,使固体发酵培养基的最终湿度达到约65%。37 ℃培养48 h。之后将发酵物低于50 ℃烤干,芽孢计数按照Prakasham的方法执行[7]。
1.2.2 底物的筛选 取不同底物(主要麦麸、玉米粉、谷草粉和糠粉)进行固体发酵和芽孢计数,根据芽孢形成的量,筛选出最佳底物。
1.2.3 添加物的筛选 按照文献8的方法,在筛选的底物中添加1.0 %的碳源(葡萄糖、乳糖、蔗糖、可溶性淀粉、果糖、麦芽糖和甘油)和氮源(硫酸铵、氯化铵、硝酸钠、蛋白胨、酵母粉和豆粉饼),以及盐类物质(KH2PO41.00%, NaH2PO41.00%, K2HPO41.50%, Na2HPO41.50%;MnSO40.10%,MCl20.10%),对照组中只加水,进行单因素固体发酵和芽孢计数。根据芽孢形成的量,筛选出最佳添加物。
1.2.4 湿度的筛选 在筛选的底物中添加适宜的水分,使湿度分别达到50%、55%、60%、65%、70%,进行固体发酵和芽孢计数。根据芽孢形成的量,筛选出最佳湿度。
1.2.5 pH的筛选 在筛选的底物中添加一定的水分,将初始pH调整到pH6.5、pH7.0、pH7.5、pH8.0、pH8.5、pH9.0、pH9.5和pH10.0,分别进行固体发酵和芽孢计数。根据芽孢形成的量,筛选出最佳pH。
1.2.6 培养基的优化配比 根据确定的最适碳源和氮源以及磷酸盐和金属锰离子,设计了L9(34)的正交试验表(见表1),优化B. coagulations CQ1菌株产生芽孢的固体发酵培养基最佳组分配比试验。发酵条件为:37 ℃,pH 7.5,湿度为60%,进行固体发酵与芽孢计数。采用正交设计软件“正交设计助手II”的直观分析法进行统计分析。

表1 L9(34)正交试验因素与水平Table 1 Factors and levels of L9(34) orthogonal test g/kg
1.2.7 优化发酵条件的验证 将优化的固体培养基与空白对照同时接种等量的种子菌,进行固体发酵及芽孢计数,分析优化固体培养基促进芽胞形成的效果。
2 结果与分析
2.1 不同底物对B. coagulans固体发酵的影响
由于农(副)产物的资源存量、价格和保存时间等是影响其选择为固体发酵底物的关键因素,试验结合实际选择以麦麸、糠粉、玉米粉和谷草粉等农副产物为发酵底物,它们对B. coagulans固体发酵形成芽孢的影响结果见图1。由图可知随着农副产物的不同,种子菌固体发酵形成芽孢的效果不一样,其中的麦麸是固态发酵生产芽孢的最佳底物物质,能提供较好的介面。由于固体发酵过程中,固体底物具有双重功能,一方面是底物为微生物生长繁殖提供营养物质,另一方面是提供微生物的粘附的功能。同时也暗示该菌能够较容易地破碎麦麸皮,并利用麦麸中的营养物质进行繁殖,这为深入开展麦麸作为底物的固体发酵生产芽孢奠定基础。
2.2 添加物质对种子菌固体发酵形成芽孢的影响
2.2.1 碳源的影响 向麦麸为底物的固体发酵培养基中添加1.0%碳源,对种子菌芽孢形成的影响见图2。结果表明葡萄糖、麦芽糖、淀粉和乳糖对芽孢的生产有较大影响。考虑到添加碳源物质的成本、溶解性和保存的特点,试验最终选择葡萄糖作为发酵培养基的碳源。
2.2.2 氮源的影响 向麦麸为底物的固体发酵培养基中添加1.0%氮源,对种子菌芽孢形成的影响见图3。数据显示有机物蛋白氮源(蛋白胨、酵母粉和豆饼粉)比无机物蛋白氮源(硫酸铵、氯化铵和硝酸钠)固体发酵形成芽孢的效果好。其中的蛋白胨形成芽胞的量最多,影响最明显。加上蛋白胨具有购买方便、价格较低、容易保存等特点,因此选择它作为发酵培养基的基本的氮源。

图1 不同底物固体发酵形成芽孢效果Fig.1 The effects of different substrates on spore production of B. coagulans using SSF
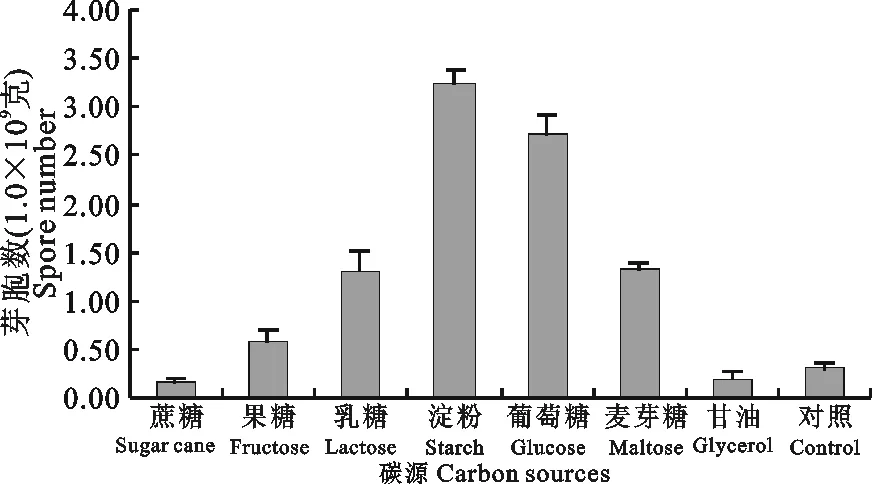
图2 碳源对B. coagulans形成芽孢的影响Fig.2 The effects of various carbon sources on spore production of B. coagulans using SSF
2.2.3 盐类的影响 菌种在不同盐分的固体培养基中发酵,形成芽孢的统计结果见图4。与对照组相比,KH2PO4、KH2PO4、Na2HPO4和NaH2PO4对芽孢的形成均有不同程度地促进作用,这一特征与文献9的报道相符,其中的KH2PO4盐促进产生芽孢的作用最明显,是对照组的两倍多。此外,锰盐对菌种固体发酵生产芽孢的影响也比较明显,表明Mn2+对芽孢的形成起到一定的促进作用,这一结果与相关文献描述的一致[10,11]。值得一提的是硫酸锰比氯化锰固体发酵促进芽孢的产生的效果明显,这可能是硫酸锰在提供锰盐的同时,还补充硫元素用于细菌的生长繁殖。基于KH2PO4和MnSO4对芽孢形成的促进作用,因此选择这两种物质作为缓冲物和金属盐用于固体发酵。

图3 氮源对B. coagulans形成芽孢的影响Fig.3 The effects of various nitrogens sources on spore production of B. coagulans using SSF

图4 湿度对B. coagulans固体发酵形成芽孢的影响Fig.4 The effects of various moisture content on spore production of B. coagulans using SSF
2.3 湿度对菌种固体发酵形成芽孢的影响
菌种在不同湿度的麦麸固体培养基中发酵,形成芽孢的统计结果见图5。结果表明:湿度对固态发酵产生芽孢的影响特别明显,促进芽孢形成的湿度范围特别窄,只有大约在60~65%之间时,发酵产物中芽孢的量最多。推测可能是:在此湿度范围内,细菌的通气和营养物质的转化达到最佳平衡,繁殖产生大量细菌,消耗了较多的养分,促进了芽孢形成。因此,实验选择湿度为60%时用于固体发酵。
2.4 pH对菌种固体发酵形成芽孢的影响
菌种在不同初始pH的固体培养基中发酵,形成芽孢的统计结果见图6。由图可知固体基质在pH7.0~pH9.5的范围内,都有较好的形成芽孢的效果,说明种子菌适应pH的范围较宽,pH变化对固态发酵形成芽孢的影响不明显。鉴于固体培养基初始值为pH7.5时,产生的芽孢数为最高。因此确定培养基最适初始值为pH7.5。

图5 磷酸盐和锰离子固体发酵形成芽孢影响Fig.5 The effects of phosphate and manganese salt on spore production of B. coagulans using SSF

图6 pH值对B.coagulans菌株固体发酵的影响Fig.6 The effects of substrate various pH on spore production of B. coagulans using SSF
2.5 固体发酵生产芽孢的培养基优化
根据单因素固体发酵的试验结果,为提高种子菌在固体发酵时促进芽胞形成的效率,以麦麸为底物,湿度为60%,初始pH7.5,选择添加葡萄糖为碳源、蛋白胨为氮源、磷酸二氢钾为缓冲物质和硫酸锰为促进芽胞形成刺激因子,设计了L9(34)正交组合下的固体发酵实验,各试验所得的数据见表2。分析实验的结果,表明影响种子菌固体发酵芽孢形成的主次因素为D>A>C>B,综合分析确定最佳发酵培养基配比为A1B3C2D1。

表2 正交试验结果Table 2 Results of the orthogonal test
注:添加物浓度的单位为克/千克,芽孢数表示三次测定值的平均值及标准差。Xi:表示在i水平下芽孢数的平均值。R:表示极差值。
Note:the unit of the additive concentration is g/kg, the spores represent the mean value and the standard deviation of three measurements. Xi: represents the average of spores at level i . R: represents the sum of deviation squares.
2.6 优化的固体培养基促进芽孢形成的验证
向优化组合(A1B3C2D1)和空白(水)的固体培养基中添加等量的种子菌液,进行固体发酵,发酵产物经低温烘干粉碎,芽胞计数。结果显示凝结芽孢杆菌的芽孢产量可以达3.80×1010个/g以上,明显高于对照组2.98×109个/g,表明此优化组合的发酵培养基能够大量提高B. coagulansCQ1的菌体数,进而提高了芽胞的形成。
3 讨 论
芽孢是芽孢形成菌在生长过程中于细胞内形成一个圆形或椭圆形的抗逆性休眠体[12],一般认为芽孢的形成源于缺乏外源营养物质,特别是碳源、氮源或磷酸盐的不足[13]。此外,一些研究还表明固态介质能促进芽孢形成,而且芽孢的形成与菌体所处的介面密切相关[14],我们在用凝结芽胞杆菌固体发酵生产芽孢制剂时,芽孢的产率受底物的物理和化学特质的影响十分明显,实验进一步证实固态介质影响的芽孢形成。在不添加任何营养物质的条件下,麦麸是较好的促进芽孢形成的固体介质,这可能是固体发酵时,麦麸本身能够为菌种提供较好的营养物质(因为麦麸的基本构成为71%碳源,13%蛋白质和16%脂肪,包含少量的维生素和矿物质[15])、较适宜的蓬松度以及持续供氧气能力的原因。
尽管麦麸有作为营养物质的潜力,但凝结芽胞杆菌单独利用其生长繁殖还是存在很大局限性。所以当在固体底物麦麸之中添加适量的外源营养物质后,发酵条件通过优化组合,经生物发酵验证,固体发酵产物中的芽孢产率明显上升。这说明添加的外源成分促发了细菌大量生长繁殖,同时产生了各种代谢物质,打碎麦麸形态,使细菌能够较好地利用麦麸中的碳源、氮源和一些重要的盐类物质来生长繁殖,扩大细菌菌体的数量,进而提高了芽孢的产量。
参考文献:
[1] Katsutoshia A, Shinichim M, Tadasih H, et al.Effect spore-bearing lacti-cacid-forming bacteria (B.coagulansSANK70258) administrationon the intestinal environment, defecation frequency, fecal characteristics and dermal characteristics in humans and rats[J].Microb Ecol in Health Dis, 2003,14(1):4-13.
[2] Hong H A,Duc L H,Cutting S M. The use of bacterial spore formers as probiotis[J]. FEMS Microbial Rev, 2005, 29:813-835.
[3] 张小燕,陈宏君,周 波.凝结芽孢杆菌TBC169片在治疗小儿便秘中的作用[J]. 中国妇幼保健, 2008,23:2 184-2 185.
[4] 李国建.凝结芽孢杆菌替代抗生素对猪生产性能的影响[J].河南农业科学, 2004,10(24):72-74。
[5] El-Bendary M A.Bacillus thuringiensis and Bacillus sphaericus biopesticides production[J]. J Basic Microbiol,2006, 46(2):158-70.
[6] Adams T T, Eiteman M A, Hanel B M. Solid state fermentation of broiler litter for production of biocontrol agents[J]. Bioresour Technol, 2002, 82:33-41.
[7] Prakasham R S, Rao C S,Sarma P N. Green gram husk-an inexpensive substrate for alkaline protease production by Bacillus sp.in solid [J]. Bioresour Technol, 2006.97:1 449-1 454.
[8] Shuminao Zhao, Nan Hu, Jun Huang, et al. High-yield spore production from Bacillus licheniform by solid state fermentation[J]. Biotechnol lett, 2008, 30:295-297.
[9] 陈洪章, 徐 建. 现代固态发酵原理及应用[M].北京:中国化学工业出版社,2004, 142-143.
[10] 徐世荣, 陈 骧, 吴云鹏. 细菌芽孢形成机制在微生态制剂生产中的应用[J].食品与生物技术学报, 2007, 26(4):121-126.
[11] 匡 群,孙 梅, 施大林. 酪酸状芽胞杆菌芽胞杆菌培养的研究[J].饲料工业,2005, 26 (10):36-39.
[12] 周德庆. 微生物学教程[M].北京:高等教育出版社,1993,33-38.
[13] 陶文沂. 工业微生物生理与遗传育种学[M].北京:中国轻工业出版社,1997,80-83.
[14] 王天云, 陈振风, 王福源. 一种促使乳酸芽孢杆菌大量生成芽孢的方法[J]. 工业微生物, 2001,31 (3):13-17.
[15] Vimala Devi P S,Ravinder T, Jaidev C. Cost-effective production of Bacillus thuringiensis by solid-state fermentation [J] Journal of Invertebrate Pathology,2005, 88:163-168.
