海南黑山羊MSTN基因的表达差异与发育性变化研究
2013-11-30周汉林侯冠彧王东劲徐铁山
管 凇,周汉林,侯冠彧,王东劲,徐铁山
(中国热带农业科学院 热带作物品种资源研究所,海南 儋州 571737)
肌肉生成抑制素(Myostatin, MSTN)是一种能够对肌肉生长起负调控作用的分泌蛋白[1],经研究发现,MSTN基因编码的蛋白质对骨骼肌有负调控作用,主要是控制和维持骨骼肌细胞的数量和体积[2]。研究还发现,如果动物缺乏MSTN基因,便出现肌肉增大,骨骼肌肌群分布广,且脂肪不增加等现象[3-4]。McPherron[3]等利用基因敲除技术研究发现,该基因敲除后鼠的体重是正常鼠体重的2~3倍,其肩、臀部的肌肉明显肥大,肌纤维数目增加,骨骼肌肌群分布更广泛[5]。目前世界著名的比利时兰牛(Belgian blue)和皮埃蒙特牛(Piedmontese),就是由于MSTN基因突变而出现的双肌现象[6],Lorenxen[7]在道赛特羊中也发现了双肌现象,并且这种现象能遗传给后代,其臀部肌肉比较发达,因而被称做Callipyge。
MSTN作为肌肉生长的负调控因子,研究其结构和功能,确定MSTN基因在各种动物的具体表达部位概况及表达量信息,对于阐明骨骼肌生长发育的调控机理具有十分重要的意义。在其表达丰度最高时,采取基因敲除术、抗体注射、转基因、反义核酸等技术,降低MSTN基因的表达量,从而会使肌肉充分发育,以提高产肉量、瘦肉量及饲料转化率[8],在畜牧生产上有极好的应用前景。目前,国内对MSTN多见其在猪、牛、羊、鸡上作为肉质性状候选基因的多态性研究[9-18]。本研究利用实时荧光定量PCR技术,探讨MSTN基因在海南黑山羊腿肌、腰肌、背肌等组织中的表达差异及其发育变化规律,为进一步研究MSTN基因对肉质性状的调控机理提供参考依据。
1 材料与方法
1.1 试验材料
选用中国热带农业科学院实验羊场的海南黑山羊2、3、4月龄公羔和12月龄公羊各3只(相同营养水平,相同饲养环境)屠宰后取腿肌、腰肌和背肌,置液氮速冻,-80 ℃保存备用。
1.2 主要试剂及仪器
所用主要仪器包括核酸提取仪Maxwell 16(Promega公司),荧光定量PCR仪(eppendorf),PCR仪(德国B-iometra),凝胶成像系统(法国VILBER),紫外分光光度计;RNA提取试剂盒(Maxwell 16 Total RNA Purification Kit)购自Promega公司;反转录试剂盒、荧光定量PCR试剂盒(SYBR Premix Ex TaqTM )购自大连宝生物。
1.3 荧光定量PCR
1.3.1 总RNA提取和反转录 利用核酸提取仪提取总RNA,操作步骤按照Maxwell 16 Total RNA Purification Kit试剂盒说明书进行操作,RNA用0.8%琼脂糖凝胶电泳检测,用紫外分光光度计测其浓度,将每个样品稀释成一致浓度备用。反转录体系为:5×prime ScriptTM Buffer (for Real Time)20 μL,终浓度1×,Prime ScriptTM RT Enzyme Mix I 1.0 μL,Oligo dT Primer (50 pM) 1.0 μL,终浓度20 pmol,Random 6 mers (100 μM) 1.0 μL,终浓度50 pmol,Total RNA 1.0 μL,Rnase Free ddH2O up to 15 μL。反转录条件为:37 ℃,15 min;85 ℃,5 s。反转录后的 cDNA 放置-30 ℃ 冰箱保存待用。
1.3.2 引物设计 参照GenBank已知序列,利用Primer5.0设计引物,送上海英俊生物技术有限公司合成,引物信息详见表1。

表1 荧光定量RT-PCR所用引物的相关信息Table 1 Real time RT-PCR primer information
注:β-actin为内参基因。
Notes:β-Actin used as housekeeping gene.
1.3.3 实时荧光定量 PCR 本试验采用SYBR Green I 染料法进行荧光定量PCR反应,在realplex4型实时荧光定量PCR仪上进行。PCR反应体系为25 μL:其中SYBR Premix Ex TaqTM 12.5 μL, 引物(10 pmol/μL)1 μL, cDNA模板2 μL,ddH2O 9.5 μL,95 ℃预热30 s,PCR循环参数为:95 ℃变性5s,57 ℃退火20 s;72 ℃延伸15 s,42个循环;根据扩增曲线和溶解曲线进行数据分析。
1.4 统计分析
在保证扩增效率的前提下,参照Winer等方法[19],用2-△△Ct法度量MSTN基因的mRNA相对表达量,以β-Actin为内参基因进行标准化校准。所得数据采用SPSS 14.0统计软件One-way ANOVA进行分析。
2 结果与分析
2.1 同一生长时期三种肌肉组织中MSTN基因表达差异
MSTN基因在同一生长时期三种肌肉组织之间的表达模式见图1(A,B,C,D),结果显示,该基因在2,3,4和12月龄之内的三种肌肉组织中的mRNA表达模式一致,即在背肌里的表达量最高,在腿肌里表达量最低,表达模式为:背肌>腰肌>腿肌,2月龄时,腰肌和背肌之间的表达差异不显著(P>0.05),腿肌的表达量极显著低于腰肌和背肌(P<0.01);3月龄时,腿肌和腰肌之间的表达差异不显著(P>0.05),背肌的表达量极显著高于腿肌和腰肌(P<0.01),4月龄时,三种组织间的表达量存在极显著差异(P<0.01),12月龄时,腿肌和腰肌之间的。表达差异不显著(P>0.05),在背肌里表达量极显著大于腿肌和腰肌(P<0.01)。
2.2 不同生长时期三种肌肉组织中MSTN基因的mRAN表达变化
MSTN基因在海南黑山羊不同生长时期三种肌肉组织中的mRNA表达变化见图2(A、B、C),结果显示,该基因在2、3、4和12月龄的腿肌和腰肌里的表达发育性变化模式一致,即在2、4月龄的表达量极显著低于3、12月龄(P<0.01),2、4月龄之间表达差异不显著(P>0.05),3、12月龄之间表达差异不显著(P>0.05),腿肌和腰肌的表达发育模式为12月龄>3月龄>4月龄>2月龄,而背肌的表达发育模式与腿肌和腰肌有所差异,背肌在三月龄的表达量极显著高于其他月龄(P<0.01),在2、3、4月龄之间的表达差异不显著(P>0.05),其表达模式为:3月零>12月零4月龄>2月龄。
整体而言,该基因在背肌里的表达量最高,腿肌里的表达量较低,三种肌肉组织均在2月零时,表达量较低,3月龄时极显著升高(P<0.01),4月龄时又极显著下降(P<0.01),12月龄时又极显著升高(P<0.01);背肌在前三个阶段表达模式与腿肌和腰肌一致,而在4月龄又极显著下降之后(P<0.01),12月龄时虽有所上升,但差异不显著(P>0.05)。

图1 MSTN基因在海南黑山羊同一生长时期3种肌肉组织中的表达差异Fig.1 The differences of MSTN mRNA in three muscle tissues at the same period of growth for Hainan Black Goat
注:不同的字母之间表示差异极显著(P<0.01),相同的字母之间表示差异不显著(P>0.05)。下同。
Note: Values with different letters mean extreme difference (P<0.01),those with same letter mean insignificant difference (P>0.05).The same below.
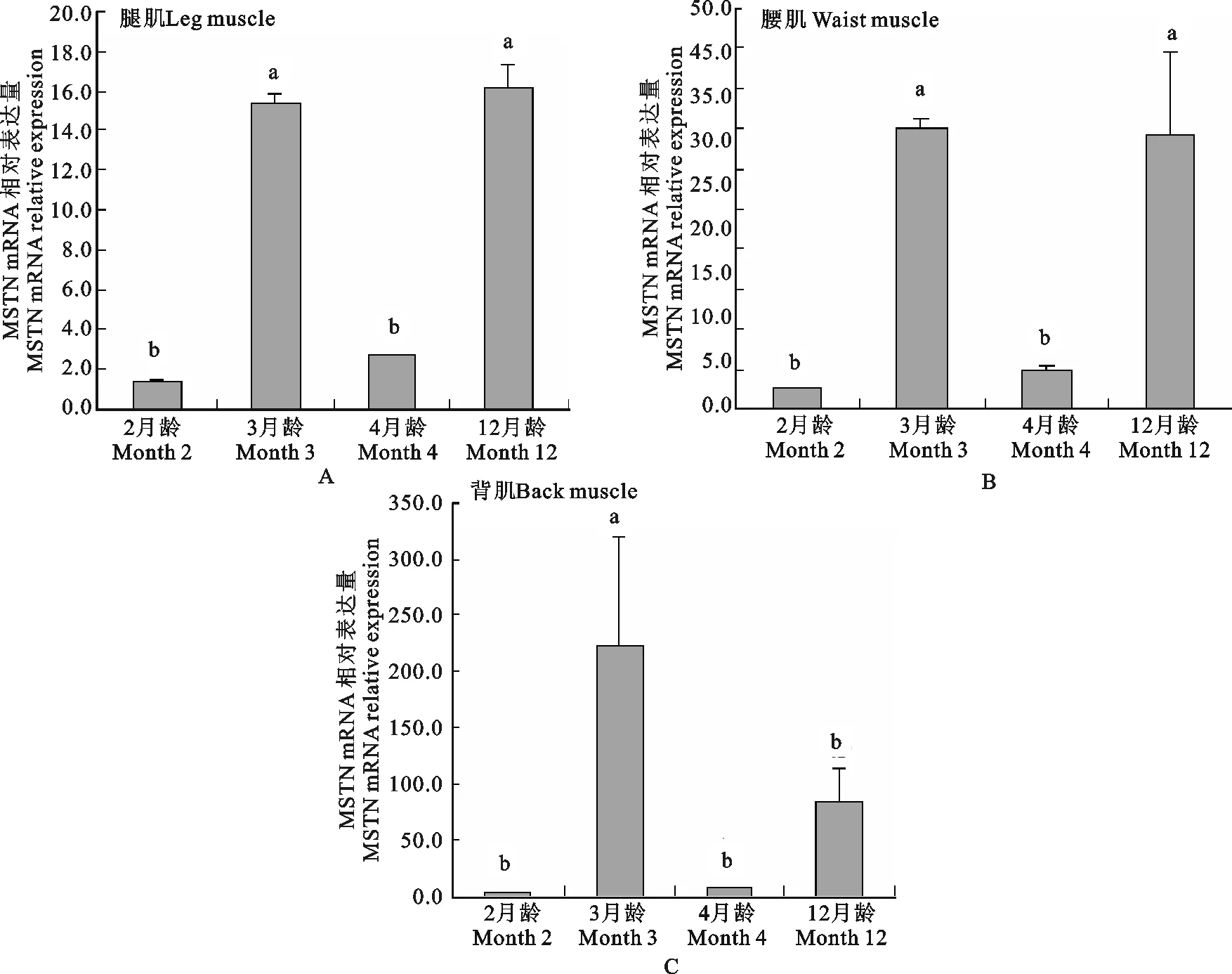
图2 MSTN基因在海南黑山羊不同生长时期三种肌肉组织中的表达变化规律Fig.2 The developmental changes of MSTN mRNA in three muscle tissues at different period of growth for Hainan Black Goat
3 讨 论
MSTN的生理作用主要是与动物产前胎儿期的肌肉增长有关[20]。但根据研究表明,在动物出生前和出生后骨骼肌中均能检测到MSTN mRNA[6,21]。目前,关于MSTN基因对出生后的动物肌肉生长发育调控机理尚未完全清楚。前人研究结果证明,MSTN除在骨骼肌中表达外[22-25],在牛心肌细胞和蒲肯野纤维[23]、猪的乳腺和脂肪组织中也有表达[26],另外,在罗非鱼的眼、鳃丝、肠、大脑和性腺中也发现MSTN mRNA[26]。潘英树等[28]对MSTN基因在朗德鹅组织中的分布情况进行了检测,结果表明,MSTN基因在大脑、小脑、心脏、肝脏、脾脏、肺脏、肾脏、胰脏、腹脂、皮下脂肪、骨骼肌中均有表达。胡兰等[29]检测了MSTN基因在大骨鸡骨骼肌、心肌、肾脏、脑、肠、舌中的表达情况,结果显示,MSTN基因在骨骼肌中表达水平较高,其他组织中有微量表达,但在肺、肝脏中未检测出MSTN mRNA,并且推测大骨鸡孵化后的早期阶段骨骼肌生长速度最快,随着日龄的增加,肌生成抑素水平提高,对骨骼肌的抑制作用增强。王娜等[30]对海兰鸡的研究结果表明,MSTN基因在胸肌、腿肌中的表达量显著高于心肌,且胸肌、腿肌表达量随着日龄的增加有所上升,28日龄时达到最高,心肌之间没有明显差异。Ji等[6]报道了猪妊娠后期胎儿MSTN基因的表达量显著提高,出生时背最长肌的MSTN mRNA丰度显著降低,到出生后2周时降到最低水平,随后MSTN mRNA水平上升,107 kg时MSTN mRNA上升水平达到一个平台期,随后表达量下降,并且发现MSTN仅在骨骼肌、心肌组织中表达。孙伟等[31]对湖羊的研究结果显示,湖羊MSTN基因在肌肉中的表达在60日龄之前先有增加的趋势,60日龄后随着年龄的增加有减少的趋势。
海南黑山羊是中国热带地区优良的地方品种,具有耐湿热、耐粗饲、抗逆性强,肉质优良,脂肪分布均匀,胶原蛋白丰富,食物膻味,羊胎素含量高等特点享誉海内外,位列海南省“四大名菜”之首。本试验以海南黑山羊为研究对象,对MSTN基因在其腿肌、腰肌和背肌里不同生长时期的mRNA表达差异及发育性变化规律进行研究,结果表明,在所研究的海南黑山羊四个生长阶段,MSTN基因均是在背肌里的表达量最高,腿肌里的表达量较低;表达模式为:背肌>腰肌>腿肌;三种肌肉组织均在2月零时,表达量较低,3月龄时极显著升高(P<0.01),4月龄时又极显著下降(P<0.01),12月龄时又极显著升高(P<0.01);表达模式为:腿肌和腰肌的表达模式为:12月龄>3月龄>4月龄>2月龄;背肌在前三个阶段表达模式与腿肌和腰肌一致,且在3月龄时达到最高水平,而在4月龄又极显著下降之后(P<0.01),12月龄时虽有所上升,但差异不显著(P>0.05),表达模式为:3月零>12月零4月龄>2月龄。由此,本研究认为,该基因在不同部位的肌肉组织中均呈现不同的表达模式,且同一种组织在不同的生长阶段呈更复杂的表达调控模式。根据前人研究结果认为,MSTN基因在动物出生后的肌肉组织中其表达量并不是随着日龄的增加而一直增加或下降的趋势,而是在某个时间分割点对肌肉的增长起正调控或负调控作用,分割的时间点在不同物种间可能不同。此外,不同生长阶段之间的MSTN基因表达量大都存在显著或极显著差异[30]。本研究由于样品采集受限,所的数据论据需要更多系统的、连续性的研究结果辅助再做进一步探讨。关于MSTN基因在海南黑山羊其他生长阶段、其他组织中表达规律还需要进一步研究。
参考文献:
[1] 徐良梅,李仲玉,单安山.肌肉生成抑制素(MSTN)基因及其在畜牧业上的应用[J].东北农业大学学报,2008,39(6):141-144.
[2] Antoniou E , Grosz M. PCR based detection of bovine myostation Q204X mutation[J]. Anim Genet Jun,1999,30(3):231-232.
[3] McPherron A C, Lee S J. Suppression of body fat accumulation in myostatin-deficient mice[J].J Clin Invest, 2002, 109(5):595-601.
[4] Kambadur R, Sharma M, Smith T P L, et al. Mutations in myostatin (GDF-8) in double muscled Belgian Blue and Piedmontese cattle[J]. Genome Res, 1997, 7(9):910-916.
[5] Joulia D, Bernardi H, Garandel V, et al. Mechanisms involved in the inhibition of myoblast proliferation and differentiation by myostatin[J]. Exp Cell Res,2003,286(2):263-275.
[6] Ji S, Losinski R L, Cornelius S G, et al. Myostatin expression in porcine tissues: tissue specificity and developmental and post natal regulation[J]. American Journal of Physiology-Regulatory,1998, 275:1265-1273.
[7] Lorenxen C R. Protein kinetics in callipyge lambs[J]. Anim Sci, 2000(78):78- 871.
[8] 王 娜,胡 兰,刘 梅,等.海兰鸡MSTN基因的表达检测[J].上海畜牧兽医通讯,2005 (2):25-26.
[9] 岳敏.西藏小型猪MSTN基因多态性及其生长发育特性的研究[D].广州:南方医科大学,2008.
[10] 姜运良,李 宁,杜立新,等.猪肌生成抑素基因5'调控区T>A与生长性状的关系分析[J].遗传学报,2002,29(5):413-416.
[11] 梁春年,阎 萍,刑成峰,等.牦牛MSTN基因内含子Ⅱ遗传多样性研究[J].华北农学报,2009 ,24 (5):16-19.
[12] 冀德君,常 洪,常春芳.蒙古牛MSTN基因序列分析及多态性研究[J].家畜生态学报,2008,29(1):21-24.
[13] 刘铮铸,李祥龙,巩元芳,等.绵羊MSTN 基因内含子2 和外显子3部分序列的SNP检测和单倍型分析[J].遗传育种,2010,4(7):9-11.
[14] 张晓强,姚继广,张春香,等. 3个绵羊品种MSTN基因多态性的比较分析[J]. 中国草食动物科学,2012,2:12-15.
[15] 冯会利,石照应,田兴贵,等. 贵州黑山羊和黔北麻羊MSTN基因DraI酶切多态性分析[J]. 西南农业学报, 2012,25(1):282-285.
[16] 贺三刚,陈芯,刘晨曦,等.绵羊MSTN 基因启动子区SNPs分析[J]. 华北农学报,2012,27(3):81-85.
[17] 温彦涛,武子寅,赵振华,等.鸡MSTN基因多态性及其与屠体性状的关联分析[J].中国家禽,2012,34(16):29-36.
[18] 张跟喜,丁馥香,赵秀华,等.肌肉生长抑制素基因外显子3的多态性及其与边鸡繁殖性状的关联分析[J].2012,48(1):9-11.
[19] Winer J, Jung C K, Shackel I, et al. Development and validation of real-time quantitative reverse tran-Scriptase-polymerase chain reaction for monitoring gene expression in cardiac myocytes in vitro[J].Anal Biochem,1999,270(1):41-49.
[20] Ji S Q, Wills G M, Scott R R, et al. Partial cloning and expression of the bovine Leptin gene[J]. Animal Biotechnology,1998, 9(1):1-14.
[21] Kambadur R, Sharma M, Smith T P L, et al. Mutations in myostatin (GDF-8) in double-muscled belgian blue and piedmontese cattle[J].Genome Research,1997,7:910-915.
[22] Mcpherron A C, Lawler A M, Lee S J, et al. Regulation of skeletal muscle mass in mice by a new TGF-β superfamily member[J].Nature,1997,387(6628):83-89.
[23] Mcpherron A C, Lee S J. Double muscling in cattle due to mutations in the myostatin gene [J]. Proc Natl Acad Sci USA, 1997, 94 (23):12 457-12 461.
[24] Massague J. TGF2β signal transduction[J].Annu Rev Biochem,1998,67:753-791.
[25] Reardon K A , Davis J , Kapsa R M , et al. Myostatin, insulin like growth factor-1, and leukemia inhibitory factor mRNA are upregulated in chronic human disuse muscle atrophy [J].Muscle Nerve,2001,24(7):893-899.
[26] Roberts S B, Goetz F W. Differential skeletal muscle expression of myostat in across to leost species, and the isolation of multiple myostatin isoforms[J].FEBS Lett,2001,491(3):212-216.
[27] 孙玉鹏, 胡蕴玉.β转化生长因子研究进展[J].中华骨科杂志,1994,14(8):505-507.
[28] 潘英树,张永宏,郭丽君,等.朗德鹅肌生成抑制素基因组织分布研究[J].中国畜牧兽医,2008,35(5):45-46.
[29] 胡 兰,郭东新,胡 锐,等.大骨鸡中MSTN基因表达规律性的研究[J].动物科学与动物医学,2003,20(11):42-44.
[30] 王 娜,胡 兰,刘 梅,等.海兰鸡MSTN基因的表达检测[J].上海畜牧兽医通讯,2005,2:25-26.
[31] 孙 伟,王 鹏,丁家桐,等.湖羊Myostain和Myogenin基因表达的发育性变化及与屠宰性状的关联分析[J].中国农业科学,2010,43(24):5129-5136.
