应用RT-PCR方法检测鸭病毒性肝炎新型和I型病毒
2013-11-30柴顺秀赵隆寿
柴顺秀,马 花,韩 英,赵隆寿
(青海省湟中县动物卫生监督所, 青海 湟中 811600)
鸭病毒性肝炎(duck viral hepatitis,DVH)是由鸭病毒性肝炎病毒(duck hepatitis virus,DHV)引起的、主要危害雏鸭的一种重要病毒性传染病,该病发病迅速,发病率高,死亡率高,给养鸭业带来巨大的经济损失,严重制约了养鸭业的健康、可持续发展[1-5]。由于鸭病毒性肝炎病毒存在毒株变异,且变异程度较大,2007年台湾和韩国学者先后证实新型DHV与典型的DHV-I在基因序列上表现出很大差异,且新型DHV与DHV-I不产生血清学交叉反应[6-12],增加了鸭病毒性肝炎综合防控的难度。为了加快本病的病原检测,本研究在分析I型和新型鸭病毒性肝炎病毒基因组序列的基础上,选取两种毒株的变异区分别设计了特异性检测引物,建立了可以同时检测鸭病毒性肝炎I型病毒和新型病毒的复合RT-PCR鉴别检测方法,实现了鸭病毒性肝炎I型病毒和新型病毒的快速鉴别诊断,将为该鸭病毒性肝炎的快速检测与诊断提供有效帮助。
1 材料与方法
1.1 毒 株
鸭病毒性肝炎病毒I型毒株(I-DHV)、鸭病毒性肝炎病毒新型毒株(N-DHV)、鸭瘟病毒(DEV)、新城疫病毒(NDV)、鸭坦布苏病毒(DTMUV)均由青海省西宁市动物疾病中心实验室分离并保存。
1.2 试剂与试剂盒
Taq DAN聚合酶、一步法RT-PCR试剂盒、pMD18-T克隆载体、EcoRI与HindIII内切酶购自大连宝生物工程有限公司;病毒基因组DNA/RNA提取试剂盒、质粒提取试剂盒、胶回收试剂盒购自北京百泰克生物技术有限公司。
1.3 病毒基因组DNA/RNA的提取
用病毒基因组DNA/RNA提取试剂盒分别提取鸭病毒性肝炎病毒I型毒株(I-DHV)、鸭病毒性肝炎病毒新型毒株(N-DHV)、鸭瘟病毒(DEV)、新城疫病毒(NDV)、鸭坦布苏病毒(DTMUV)RNA,-70 ℃保存备用。
1.4 设计与合成引物
根据GeneBank上两种毒株的基因组序列,选取两种毒株的变异区分别设计了特异性检测引物(表1),引物由上海生工生物工程有限公司合成。在设计引物的过程中,所选的引物最适宜的退火温度接近。
1.5 RT-PCR扩增反应
分别以鸭病毒性肝炎I型病毒RNA,鸭病毒性肝炎新型病毒RNA,鸭病毒性肝炎病毒I型和新型的混合RNA为模板,进行一步法RT-PCR扩增。
反应体系(25 μL)如下:引物(20 μmol/μL)各0.5 μL、I-DHV RNA 5 μL或N-DHV RNA 5 μL或I-DHV和N-DHV混合RNA 5 μL、one step enzyme Mix 1 μL、分别加入one step buffer至25 μL体系,RT-PCR扩增条件为:50 ℃ 60 min;95 ℃ 4 min;94 ℃ 45 s,51 ℃ 45 s,72 ℃ 60 s,30个循环;72 ℃ 10 min。
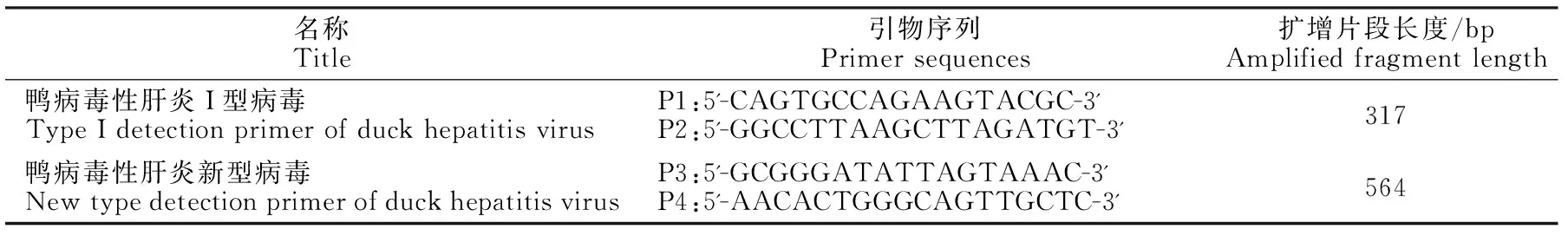
表1 引物序列表Table 1 Primer sequence
1.6 RT-PCR扩增产物的测序鉴定
分别取5 μL RT-PCR扩增产物跑琼脂糖凝胶核酸电泳,初步观察检测扩增片段的大小。将扩增片段连接至pMD18-T克隆载体,提取质粒DNA,EcoRI/HindIII双酶切鉴定得到阳性重组质粒,送上海生工生物工程股份有限公司进行测序鉴定。
1.7 特异性试验
分别以提取的鸭病毒性肝炎病毒I型毒株(I-DHV)、鸭病毒性肝炎病毒新型毒株(N-DHV)、鸭瘟病毒(DEV)、新城疫病毒(NDV)、鸭坦布苏病毒(DTMUV)、健康鸭肝组织的RNA为模板,同时加入四条引物,按照上面的反应条件进行PCR扩增,确定该检测方法的特异性。
1.8 敏感性试验
将提取的鸭病毒性肝炎病毒I型和新型的混合RNA定量,然后10倍梯度稀释到10-6,分别取不同稀释度的RNA 5 μL为模板进行PCR扩增,确定该检测方法的敏感性。
1.9 重复性试验
利用建立的一步RT-PCR检测方法分别对鸭病毒性肝炎病毒I型毒株(I-DHV)、鸭病毒性肝炎病毒新型毒株(N-DHV)、鸭瘟病毒(DEV)、新城疫病毒(NDV)、鸭坦布苏病毒(DTMUV)、2份鸭病毒性肝炎I型阳性病料、2份鸭病毒性肝炎新型阳性病料、1份鸭病毒性肝炎I型和新型都阳性的病料、健康鸭肝组织重复检测3次,确定该检测方法的稳定性和重复性。
1.10 符合率试验
对本研究建立的一步RT-PCR检测方法检测结果为阳性的2份鸭病毒性肝炎I型病料、2份鸭病毒性肝炎新型病料、2份鸭病毒性肝炎I型和新型均阴性的病料接种10日龄鸭胚,按常规方法进行病毒的分离鉴定试验,比较本研究建立的一步RT-PCR检测方法与病毒分离鉴定的符合率。
1.11 临床样品检测
利用建立的一步RT-PCR检测方法检测临床送检疑似鸭病毒性肝炎病毒感染的组织病料56份,对阳性的PCR扩增产物全部进行克隆和测序鉴定,以验证本检测方法的临床适用性和准确性。
2 结果与分析
2.1 RT-PCR扩增结果
如图1所示,鸭病毒性肝炎新型病毒的扩增片段大小为564 bp、鸭病毒性肝炎I型病毒的扩增片段大小为317 bp,鸭病毒性肝炎病毒I型和新型的混合RNA同时扩增出564 bp和317 bp的片段,与预期大小相一致。如图2所示,RT-PCR扩增产物分别连接T载体所构建的克隆重组质粒经EcoRI和HindIII双酶切鉴定分别得到564 bp、317 bp的特异性条带,表明RT-PCR扩增片段已经连接到T载体。经上海生工生物有限公司的测序鉴定表明,RT-PCR扩增片段分别为鸭病毒性肝炎病毒新型和I型的特异性片段。
2.2 特异性试验结果
如图3所示,鸭病毒性肝炎病毒I型毒株(I-DHV)、鸭病毒性肝炎病毒新型毒株(N-DHV)分别出现特异的与预期大小一致的片段,而鸭瘟病毒(DEV)、新城疫病毒(NDV)、鸭坦布苏病毒(DTMUV)、健康鸭肝组织均没有出现扩增片段,说明所设计的引物可以特异性的扩增鸭病毒性肝炎病毒I型毒株(I-DHV)和鸭病毒性肝炎病毒新型毒株(N-DHV),该检测方法有良好的特异性。
2.3 敏感性试验结果
鸭病毒性肝炎病毒I型和新型的混合RNA定量浓度为6 μg/μL,10倍梯度稀释到10-4后,取5 μL作为RT-PCR扩增模板,检测结果仍为阳性(如图4所示),说明该检测方法可以最低检出3 pg含量的病毒RNA,具有良好的敏感性。

图1 RT-PCR扩增结果Fig.1 Result of RT-PCR amplification productM. DL 2000 DNA Marker; 1.I-DHV;2.N-DHV;3.I-DHV andN-DHV;4.Control
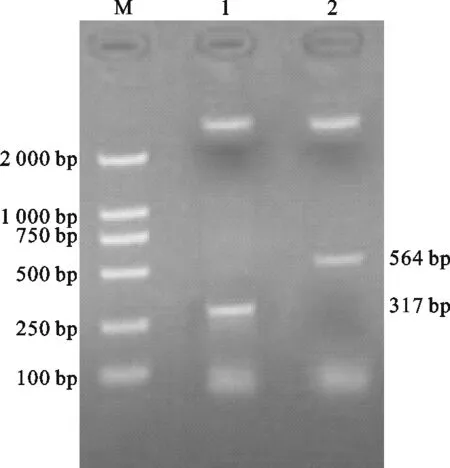
图2 克隆载体的双酶切鉴定Fig.1 Identification of cloning vectorM. DL 2000 DNA Marker; 1.I-DHV digested with EcoRI/HindIII;2.N-DHV digested with EcoRI/HindIII
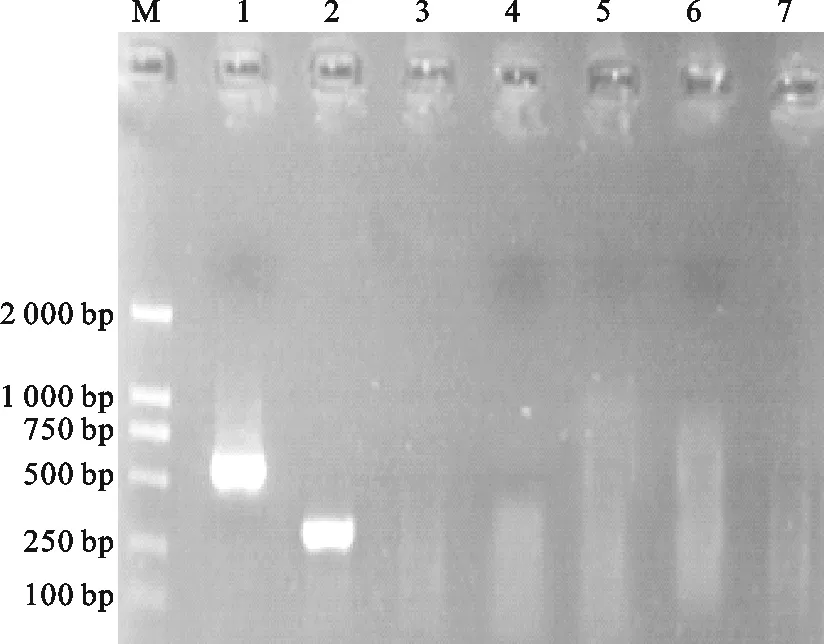
图3 特异性试验结果Fig.3 Result of specificity testM. DL 2000 DNA Marker; 1.N-DHV; 2.I-DHV; 3.DEV;4.NDV; 5.DTMUV; 6.Healthy duck constitution; 7.Control
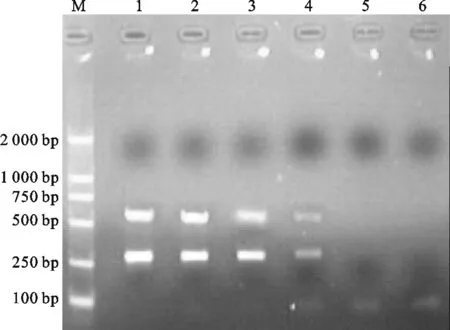
图4 敏感性试验结果Fig.4 Result of sensitive testM.DNA Marker DL 2000; 1.10-1; 2.10-2;3.10-3;4.10-4;5.10-5;2.10-6
2.4 重复性试验结果
经过3次重复检测,鸭病毒性肝炎病毒I型毒株(I-DHV)、鸭病毒性肝炎病毒新型毒株(N-DHV)、鸭瘟病毒(DEV)、新城疫病毒(NDV)、鸭坦布苏病毒(DTMUV)、2份鸭病毒性肝炎I型阳性病料、2份鸭病毒性肝炎新型阳性病料、1份鸭病毒性肝炎I型和新型都阳性的病料、健康鸭肝组织结果一致,证明该检测方法有良好的稳定性和重复性。
2.5 符合率试验结果
本研究建立的一步RT-PCR检测方法检测结果为阳性的2份鸭病毒性肝炎I型病料和2份鸭病毒性肝炎新型病料均分别分离到了鸭病毒性肝炎I型和鸭病毒性肝炎新型病毒,而2份阴性病料均没有分离到病毒,RT-PCR检测方法与病毒分离鉴定的符合率达100 %。
2.6 临床样品检测结果
利用建立的复合PCR检测方法检测青海湟中县、湟源县、大通县及德令哈市临床送检病料共计56份,检出鸭病毒性肝炎I型病毒阳性25份,鸭病毒性肝炎新型病毒阳性13份,鸭病毒性肝炎I型和新型混合感染阳性6份,对阳性的PCR扩增产物进行克隆和测序,结果均为鸭病毒性肝炎I型或新型特异性毒株。
3 讨 论
鸭病毒性肝炎病毒由于高致死率给养鸭业带来了沉重的经济损失,近年来众多养鸭场不断出现了不能被DHV-1弱毒疫苗或其抗血清完全控制的鸭肝炎流行,由于DHV-1的变异株新型DHV的出现,给本病的诊断和防控提出了更高要求[13]。由于新型鸭肝炎与I型鸭肝炎在临床症状、剖检变化等方面极为相似,如死前均出现明显的神经症状,死后呈典型的角弓反张姿势,剖检变化主要表现为肝脏的出血性坏死性变化,通过常规的临床诊断方法很难进行鸭肝炎的鉴别诊断,这就要借助于分子生物学方法[14],PCR检测方法是最适合临床病料快速检测的分子生物学诊断技术,通过PCR可以快速准确的对病原进行确诊,复合PCR是用多对引物同时扩增几条DNA片段的方法,在复合PCR中,所有引物Tm值应相近。如果两对引物Tm值差异过大,会使扩增产物的量明显不同,其中一种扩增产物或目的条带很难观察到。另外,靶DNA的长度也应相近,差别大时短片的靶DNA会优先扩增,因此,会产生不同产量的扩增产物。本研究在设计引物的时候考虑到传统毒株和新型变异株的不同基因组序列,分别选取可以进行鉴别诊断的特异性引物序列,在设计引物的时候,考虑到快速PCR检测的需要,将所有的引物放在一个PCR反应体系中,两种引物PCR反应的退火温度都为51 ℃,这样就可以实现毒株的同时扩增,既节约了试剂又节省了时间。
参考文献:
[1] Kang M S, Jang H, Kim M C, et al. Development of a stabilizer for lyophilization of an attenuated duck viral hepatitis vaccine[J]. Poult Sci, 2010, 89(6):1 167-1 170.
[2] Wang Y, Li C, Chen Z, et al. Complete genome comparison of duck hepatitis virus type 1 parental and attenuated strains[J]. Virus Genes, 2012, 45(2):398-401.
[3] Fu Y, Chen Z, Li C, et al. Establishment of a duck cell line susceptible to duck hepatitis virus type 1[J]. J Virol Methods, 2012, 184(1-2):41-45.
[4] 付玉志, 张洪辉, 李传峰, 等. I型鸭肝炎病毒在鸭胚成纤维细胞系中的增殖特性研究[J].中国预防兽医学报,2013,35(2):110-113.
[5] 袁率珍, 范书才,李 虹,等. 新型鸭肝炎病毒全基因组序列分析[J].中国预防兽医学报, 2010,32(7):507-511.
[6] Tseng C H, Knowles N J, Tsai H J. Molecular analysis of duck hepatitis virus type 1 indicates that it should be assigned to a new genus [J]. Virus Res, 2007, 123(2):190-203.
[7] Ding C, Zhang D. Molecular analysis of duck hepatitis virus type 1[J].Virology,2007,361 (1):9-17.
[8] Wang M, Zhang J, Zhou J H, et al. Analysis of codon usage in type 1 and the new genotypes of duck hepatitis virus[J].Biosystems, 2011,106(1):45-50.
[9] 范书才,李 虹,袁率珍, 等. 新型鸭肝炎病毒的分离鉴定[J].中国预防兽医学报, 2009,31(10): 770-775.
[10] 赵金花, 沈志强, 朱 辉, 等. 新型鸭肝炎病毒的分离鉴定及VP1基因序列分析[J].中国预防兽医学报, 2011,33(10):772-780.
[11] 马超英. 新型鸭肝炎病毒的分离鉴定[J]. 中国畜牧兽医,2012,39 (12): 177-179.
[12] Gu C Q, Xie C Q, Hu X Y, et al. Cytokine gene expression in the livers of ducklings infected with duck hepatitis virus-1 JX strain[J]. Poult Sci, 2012, 91(3):583-591.
[13] 张艳芳, 罗 薇, 刘内生, 等. 鸭肝炎病毒的研究进展[J].中国畜牧兽医,2011,38(7):171- 175.
[14] 苗立中, 谢金文,李 峰, 等. 鸭肝炎病毒分子生物学研究进展[J].动物医学进展, 2012, 33(7):93-96.
