西洛他唑与氯吡格雷对ACS患者抗炎作用研究
2013-11-22李晓英陈还珍郑娴勇王兆宏刘国英
李晓英,陈还珍,郑娴勇,王兆宏,刘国英
抗血小板药物可能通过抗炎作用预防动脉粥样硬化,促进斑块稳定[1]。本研究观察氯吡格雷、西洛他唑对急性冠脉综合征(ACS)患者血清白细胞(WBC)计数、血脂和炎性因子水平的影响,探讨二者对ACS患者斑块稳定性和炎症抑制的作用、机制及与他汀类药物的协同作用。
1 资料与方法
1.1 研究对象 选择ACS患者82例,男性44例,女性38例;年龄28岁~79岁(60.5岁±9.4岁)。ACS诊断依据 WHO标准,其中65例经冠状动脉造影确诊。排除:感染、肿瘤、结核、自身免疫性疾病、家族性高胆固醇血症、甲状腺疾病、肝肾疾病、他汀类过敏、血小板减少等抗凝,抗血小板聚集治疗禁忌证。入选前均未正规调脂,未服用西洛他唑或氯吡格雷。
1.2 分组 根据入院先后顺序将82例ACS患者随机分成3组。A组(常规用药+阿托伐他汀)20例,B组(氯吡格雷+常规用药)32例,C组(西洛他唑+常规用药)30例。3组年龄、性别、病种、伴发疾病、心血管危险因素(如肥胖指数、高血压、高血脂、高血糖、吸烟)无统计学意义。
1.3 治疗方法 入院后均行冠心病常规治疗:阿司匹林、低分子肝素、硝酸酯类、β受体阻滞剂等药物,均包括阿托伐他汀(立普妥,Godecke GmbH生产,辉瑞制药有限公司分装,国药准字:J20030048)每20mg。B组加用氯吡格雷(波立维,Sanofi Withrop Industrie生产,杭州赛诺菲圣德拉堡制药有限公司分装,国药准字:J2004006)每早75mg。C组加用西洛他唑(培达,日本大冢制药有限公司研制,浙江大冢制药有限公司生产,国药准字:H10960014)50mg,2次/天。共服用3周。
1.4 观察指标 临床疗效:观察胸痛发作次数、程度、持续时间、缓解情况、发生心血管事件情况等。治疗前后hs-CRP和TNF-α、IL-1β水平的变化。检测血脂、血常规,观察 WBC计数及血脂各项水平的变化。观察用药期间药物不良反应,密切监测相关指标。
1.5 检测方法 治疗前及治疗3周后清晨空腹采取肘静脉血5mL。hs-CRP采用酶联免疫吸附法,试剂盒购自美国DSL公司(批号为RD1029)。TNF-α、IL-1β采用放射免疫法,试剂盒均购自北京北方生物技术研究所(批号分别为20060901A、20060820),TNF-α、IL-1β检测的敏感度分别为6fmol/mL、0.1 ng/mL;批内CV<10%、12%,批间CV<15%、13%。
1.6 统计学处理 采用SPSS11.5处理,组内用配对t检验,用均数±标准差(x±s)表示;组间用单因素方差分析和SNK-q检验,α=0.05;相关分析采用直线相关分析。
2 结 果
2.1 3组各项检测指标变化(见表1~表3)

表1 3组治疗前后血脂水平比较(x±s) mmol/L
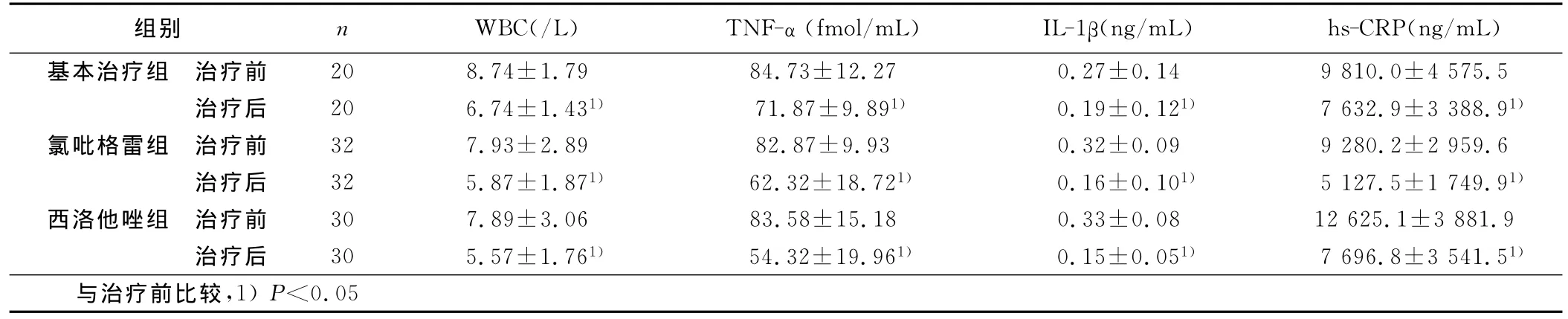
表2 3组TNF-α、IL-1β等水平比较(x±s)

表3 3组治疗后血脂及炎性因子等下降幅度比较(x±s)
2.2 相关性分析 西洛他唑组治疗前后hs-CRP下降幅度与TNF-α、IL-1β下降幅度呈正相关(r=0.380,P=0.038;r=0.376,P=0.040),治疗前后 HDL-C变化值与TNF-α、IL-1β的变化值呈负相关(r=-0.38,P=0.04;r=-0.39,P=0.03)。
2.3 安全性观察 氯吡格雷、西洛他唑两组胸痛程度较基本治疗组减轻,发作次数及持续时间明显少于基本治疗组。观察期间基本治疗组有2例发生心脏性死亡退出研究,氯吡格雷、西洛他唑两组均无心性死亡病例。2例有轻度恶心,1例1月后出现GPT轻度升高<2倍正常值,1例服用氯吡格雷1周后出现皮肤局部出血点外。两组患者肝肾功能均无明显变化,未发现严重出血及其他不良反应。
3 讨 论
动脉粥样硬化(AS)是一种涉及血小板、白细胞等多种炎症细胞和因子的慢性炎症反应[2,3]。ACS患者循环血炎性细胞因子水平升高,细胞因子间通过合成分泌的相互调节,受体表达的相互调控,生物学效应的相互影响而形成复杂的细胞因子网络影响炎症过程。其中,TNF-α、IL-1β是两种重要的促炎因子,主要来源于单核或巨噬细胞,TNF-α是细胞因子网络的关键部分,它可诱导IL-1β等的释放,IL-1β、TNF-α可活化内皮细胞,逆转其正常生理功能,引起细胞死亡、LDL氧化、白细胞黏附、血小板聚集、血栓形成、平滑肌细胞(SMC)增生、基质金属蛋白酶(MMPs)表达增加[4]、影响脂代谢,促动脉粥样硬化;另外,IL-1β、TNF-α还可进一步活化单核或巨噬细胞、T淋巴细胞、SMC,加强斑块内炎症,促进MMPs纤溶酶原激活物的释放,加速细胞外基质的降解,诱发ACS的发生[5]。CRP是反映粥样硬化炎症进程的敏感指标,又与血小板活化密切相关[6],它与LDL-C相互作用损害细胞膜,激活补体系统,促进炎症反应,刺激炎性介质的释放和表达。Hs-CRP被认为是急性心血管事件最强的炎性标记物[7],而且其水平变化与ACS的发生、发展及病变严重度密切相关。因此有效降低患者TNF-α、IL-1β、炎症细胞和Hs-CRP水平可以作为判定疗效指标及药物发挥抗炎作用的机制之一。
血小板作为一种炎症细胞,在AS的发生发展中起着重要的作用[8]。临床试验证实抗血小板药物在冠心病(CHD)、ACS等AS相关疾病中能够明显降低血管事件的发生率和病死率,传统观念认为这主要得益于抗血小板药物抑制血小板聚集和血栓形成的作用。抗血小板药物不仅减少血栓形成,还减轻局部炎症反应[9],抑制AS斑块进展[10],通过抗炎作用起到预防动脉粥样硬化,促进斑块稳定的作用,但其作用机制并不十分明确。近年来,人们认识到新型二磷腺苷(ADP)受体阻断剂氯吡格雷和磷酸二酯酶Ⅲ抑制剂西洛他唑在抗血小板聚集和血栓形成过程中起着重要作用,此外西洛他唑不仅具有抗血栓和血管扩张作用,还能抑制血管平滑肌细胞的增殖等。而且,目前二者已广泛用于治疗冠心病(CHD)、ACS,以及预防经皮冠状动脉介入治疗(PCI)术后再狭窄,降低心血管事件的发生[11-13]。
本研究察氯吡格雷和西洛他唑对hs-CRP、TNF-α和IL-1β的作用,结果显示在常规用药基础上阿托伐他汀加用氯吡格雷治疗的ACS患者和阿托伐他汀加用西洛他唑治疗的ACS患者治疗3周后血清hs-CRP、TNF-α和IL-1β水平均明显降低,与单用阿托伐他汀组比较差异显著(P<0.05),这证实氯吡格雷和西洛他唑均都可通过降低ACS患者TNF-α、CRP等致炎因子水平来抑制炎症、促进斑块稳定。而氯吡格雷和西洛他唑两组间下降幅度无明显差异,说明二者在抗血小板聚集的同时又具有相似的抗炎作用。氯吡格雷和西洛他唑对炎症细胞的影响,研究结果中显示,三组治疗后白细胞计数水平虽均有下降趋势,组间却无显著差异,可能是因为不少患者观察期间应用抗生素治疗所致。有资料显示[14],他汀类药物可降低ACS患者TNF-α、CRP水平。本研究也观察到基本治疗组治疗3周后,血清TNF-α、IL-1β、Hs-CRP均降低,说明包含他汀类药物的基本治疗也可通过降低炎性细胞因子水平起到抑制炎症的作用。但基本治疗组血清TNF-α、IL-1β、Hs-CRP降低的幅度低于氯吡格雷、西洛他唑两联合用药组,可见在他汀类药物治疗基础上联用氯吡格雷或西洛他唑可进一步降低致炎因子浓度,抑制血小板活化,促进斑块稳定,这为临床ACS患者应用和选择抗血小板药提供进一步的理论依据。本研究中,3组在治疗3周后血清血脂水平改善(P<0.05)。Elam等[15]报道西洛他唑可以降低动脉硬化患者血清TG水平,升高HDL-C水平,在2周时对HDL-C作用明显,4周时对TG的作用明显。本研究中也观察西洛他唑治疗3周后可显著升高HDL-C,而对TG的影响无统计学意义,可能与用药时间短及心梗后血脂水平应激性下降有关。西洛他唑组治疗前后TNF-α、IL-1β变化值与HDL-C变化值呈负相关。而HDL可通过抑制LDL氧化、减少TNF-α和IL-1β等炎症细胞因子的释放及抑制转录因子NF-κB的激活来减轻炎症反应[16,17],这也可能是上述指标呈负相关的原因。观察期间内未发生心血管恶性事件;3周也无严重出血、肝肾功能损害等副作用。
氯吡格雷和西洛他唑均为具有多重生物学活性的抗血小板药物,对于ACS患者在常规治疗基础上,阿托伐他汀联用氯吡格雷或西洛他唑较单用阿托伐他汀均可进一步降低致炎因子水平,抑制血小板活化,即通过多重机制促进斑块稳定,减少心脏事件,且二者具有相似的抗炎作用;其中西洛他唑还可通过升高高密度脂蛋白,与他汀类药物发挥更好的协同作用;联用后方便可行,安全可靠。
[1] Cyrus T,Sung S,Zhao L,et al.Effect of low-dose aspirin on vascular inflammation,plaque stability,and atherogenesis in low-density lipoprotein receptor deficient mice[J].Circulation,2002,106(10):1282-1287.
[2] Libby P,Ridker PM,Maseri A.Inflammation and atherosclerosis[J].Circulation,2002,105(9):1135-1143.
[3] 李艳,黄从新.重要炎性因子在冠心病病理过程中的作用[J].微循环学杂志,2004,14(1):47-49.
[4] Ferreios ER,Boissonnet CP,Pizarro R,et al.Independent prognostic value of elevated C-reactive protein in unstable angina[J].Circulation,1999,100(19):1958-1963.
[5] Prediman K,Shah MD.Plaque disruption and thrombosis:Potential role of inflammation and infection[J].Cardiol Rev,2000,8(3):32-39.
[6] Muir KW,Weir CJ,Alwan W,et al.C-reactive protein and outcome after ischemic stroke[J].Stroke,1999,30(5):981-985.
[7] Rosenson RS,Koenig W.High-sensitivity C-reactive protein and cardiovascular risk in patients with coronary heart disease[J].Curr Opin Cardiol,2002,17(4):325-331.
[8] Huo Y,Schober A,Forlow SB,et al.Circulating activated platelets exacerbate atherosclerosis in mice deficient in apolipoprotein E[J].Nature Medcine,2003,9(1):61-67.
[9] 顾晴,陈纪林,阮英茆,等.阿司匹林、氯吡格雷及合用对兔动脉粥样硬化病变进展的抑制作用[J].中国医学科学院学报,2004,27(1):87-91.
[10] 唐熠达,陈纪林,阮英茆,等.不同剂量阿司匹林对兔动脉粥样硬化斑块进展的抑制作用[J].中华心血管病杂志,2003,31(8):609-612.
[11] Douglas JS,Weintraub WS,Holmes D.Rationale and design of the randomized,multicenter,cilostazol for restenosis(CREST)trial[J].Clin Cardiol,2003,26(10):451-454.
[12] Park SW,Lee CW,Kim HS,et al.Effects of cilostazol on angiographic restenosis after coronary stent placement[J].Am J Cardiol,2000,86(5):499-503.
[13] 王长华,胡大一.氯吡格雷在缺血性心脏病中的应用[J].心血管病进展,2005,26(1):52-55.
[14] Musial J,Undas A,Gajewski P,et al.Anti-inflammatory effects of simvastatin in subjects with hypercholesterolemia[J].Int J Cardiol,2001,77(2-3):247-253.
[15] Elam MB,Heckman J,Crouse JR,et al.Effect of the novel antiplatelet angent cilostazol on plasma lipoprteins in patients with intermittent claudication[J].Arterioscler Thromb Vasc Biol,1998,18(12):1942-1947.
[16] Cockerill GW,Huehns TY,Weerasinghe A,et al.Elevation of plasma high-density lipoprotein concentration reduces interleukin-1induced expression of E-selectin in an in vivo model of acute inflammation[J].Circulation,2001,103(1):108-112.
[17] Randolph GJ,Beaulieu S,Lebecque S,et al.Differentiation of monocytes into dendritic cells in a model of transendothelial trafficking[J].Science,1998,282(5388):480-483.
