甲基橙皮苷和人血清白蛋白相互作用的光谱研究
2013-11-21李金华王素敏朱金花
李金华,王素敏,朱金花
(1.西安工业大学 材料科学与化工学院,陕西 西安 710032; 2.河南大学 化学化工学院,河南 开封 475004)
血清白蛋白是循环系统中可溶性蛋白质的重要组成部分,是血浆中含量最丰富的蛋白质,具有很多生理学上的功能[1]. 蛋白质作为载体能和许多药物及其他具有生物活性的小分子、大分子相互作用. 研究药物与血清白蛋白相互作用对于医药化学和临床医学来说是非常重要的. 从不同角度考察药物分子与蛋白质的作用对于了解药物的转运和代谢过程以及阐明生物大分子与药物小分子相互作用的化学本质都有重要意义[2-5]. 中药是我国的传统医药,历史悠久,研究中药活性组分与蛋白质的作用可为中药的发展与更有效地推广应用提供可靠的理论基础,为合理给药提供理论依据[6].
黄酮类化合物具有抗心律失常、抗病毒、抗癌、抗菌、抗炎症、抗糖尿病并发症等功能[7-8]. 甲基橙皮苷(methyl hesperidin,MH)是橙皮苷经甲基化而生成的一种黄酮类化合物,结构式见图1,其生物活性比橙皮苷强,可增加毛细管的抵抗力,防止动脉硬化症引起的功能紊乱,与维生素C共同使用可增加其药效[9-10]. 关于MH和蛋白质的相互作用未见报道. 作者利用光谱法研究了MH与HSA的相互作用,求得不同温度下药物与BSA相互作用的结合常数及位点数,并根据热力学常数确定了MH与HSA之间的作用力类型.
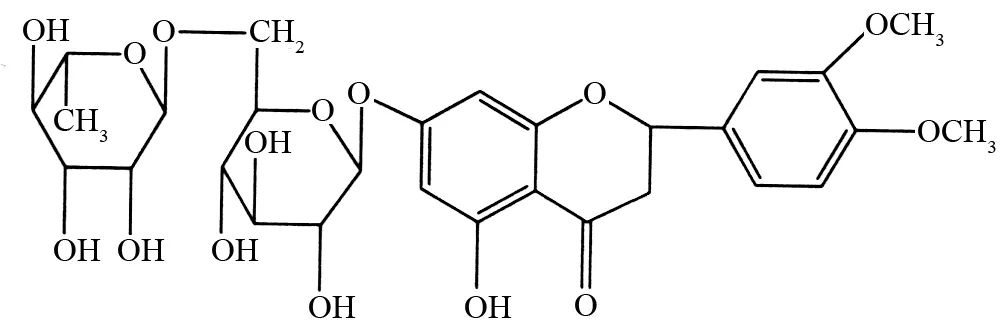
图1 甲基橙皮苷的结构图Fig.1 The chemical structure of MH
1 实验部分
1.1 仪器和试剂
RF-5301PC(日本, Shimadzu)荧光光度计用于记录样品荧光光谱和荧光强度,使用150 W氙灯与1 cm石英比色池,狭缝宽度为5 nm. 实验过程中用电子循环水浴(NTT-2100, EYELA, 日本)控制样品温度. Nexus670 傅立叶变换红外光谱仪(美国Nicolet 公司),衰减全反射附件(ATR, ZnSe晶体),DTGS 检测器,OMNIC52 数据处理软件.
HSA购于Sigma-Aldrich(美国)生物技术公司,使用时未进一步纯化. MH标准品购于中国药品生物制品检定所. 氯化钠、盐酸、三(羟基甲基)氨基甲烷(Tris)均为分析纯,实验用水均为二次蒸馏水.
1.2 实验方法
荧光光谱测定:设置激发波长280 nm,在2.0 mL含有3.0×10-6mol/L HSA的溶液中连续滴加MH储备液,在300~550 nm范围内扫描MH-HSA体系的发射光谱.
荧光滴定实验:在2.0 mL含有3.0×10-6mol/L HSA的溶液中,以微量注射器逐次加入不同体积的MH储备液,MH的最终浓度为5.0~ 47.6 μmol/L, 每次滴加MH后反应2 min. 在HSA最大发射波长337 nm处,记录296、303和310 K下体系的荧光强度,所得数据用于计算结合常数和结合位点数.
红外光谱的采集及谱图处理:分辨率为4 cm-1,取样次数为60. 同样条件下采集缓冲溶液的光谱,然后从HSA样品溶液光谱中减去缓冲溶液的吸收就得到HSA溶液的红外光谱图.
2 结果与讨论
2.1 MH对HSA的荧光猝灭
HSA的内源荧光主要来源于色氨酸残基和酪氨酸残基[11]. 图2显示了HSA与不同浓度的MH混合后的荧光光谱图.
从图2可以看出,在激发波长为280 nm,发射波长为337 nm时,HSA有很强的荧光(此荧光来源于色氨酸残基),MH几乎没有荧光. 随着MH的不断加入,HSA的荧光强度逐渐下降,这种猝灭现象说明了HSA和MH之间发生了相互作用,改变了色氨酸残基周围的微环境,使得色氨酸残基的荧光强度下降.
2.2 结合常数和结合位点数
根据荧光滴定数据,利用Scatchard方程(1)计算结合常数和结合位点数:
r/Df=nK-rK
(1)
其中r是每摩尔HSA结合MH的摩尔数,Df是游离MH的浓度,K与n分别是结合常数与结合位点数.
图3为296、303和310 K下MH-HSA体系的Scatchard图,可以看出在不同温度下,r/Df与r都呈现良好的线性关系,说明MH和HSA之间只有一种键合位,这与所求得的结合位点数一致. 从表1可以看出,各个温度下的结合常数均达1×104L· mol-1以上,说明了MH和HSA之间有较强的结合,结合常数随着温度的升高而升高.

c(HSA) = 3.0 μmol·L-1, 从a到g c(MH)依次为: 0, 5.0, 9.9, 14.7, 19.6, 24.4, 29.1 μmol·L-1; h为 MH 溶液,c(MH) = 0.5 μmol·L-1.激发波长280 nm图2 296 K时MH-HSA体系的荧光光谱图Fig.2 The fluorescence emission spectra of MH-HSA system at 296 K

pH 7.40, c(HSA) = 3.0 μmol·L-1; (■) 296 K; (●) 303 K; (▲) 310 K. λex = 280 nm, λem = 337 nm图3 MH-HSA体系的Scatchard图Fig.3 The Scatchard plots of MH-HSA

T(K)K(L· mol-1)nΔG0 (kJ·mol-1)ΔS0 (J· mol-1·K-1)ΔH0 (kJ· mol-1)2961.77×1041.58-27.92211.1834.593032.65×1041.30-29.40211.1834.593103.53×1041.16-30.87211.1834.59
2.3 作用力类型的确定
小分子和蛋白质等生物大分子通常是通过疏水作用力、静电力、氢键和范德华作用力等结合形成超分子复合物的[12]. 根据反应的热力学参数(熵变、焓变等)可确定作用力类型,为此,采用荧光光谱技术测定了不同温度下的结合常数(见表1). 当温度变化不太大时,反应的焓变可看作一个常数,此时的熵变和焓变可通过Van′t Hoff方程计算:
lnKT= -ΔH0/RT+ ΔS0/R
(2)
式中,KT为不同温度下的结合常数,R是气体常数. 由lnK对1/T作图,由斜率与截距分别可以计算出焓变ΔH0、熵变ΔS0,再由下式
ΔG0= ΔH0-TΔS0
(3)

pH 7.40. MH to HSA (3.0×10-5 mol·L-1) ratio: 2∶1图4 HSA(a)和MH-HSA体系(b)的红外光谱图Fig.4 FT-IR spectra of free HSA (a) and MH-HSA system (b)
可以计算出反应的自由能变化ΔG0. 所得的结果列于表1,从表1可以看出,结合反应的焓变ΔH0为正值,自由能变ΔG0为负值,说明MH与HSA的结合是一个吸热过程,同时也是一个自发的过程. 从热力学的角度来考虑,正ΔS通常认为是疏水相互作用,而且,水溶液中离子间的静电作用一般是以正ΔS与负ΔH为标志的,相反对于范德华力,ΔH以及ΔS却均为负值. 负焓在静电作用中可能起一定作用,但在真正的静电作用中焓变非常小几乎等于零[13]. 在MH和HSA的相互作用中,ΔS,ΔH均为正值说明疏水作用占主导地位,但也不排除氢键作用的存在,因为在MH的分子中存在氧原子.
2.4 MH对HSA二级结构的影响

3 结论
应用光谱技术对MH和HSA的相互作用进行了研究. 结果表明,MH与HSA之间有很强的结合,改变了HSA的二级结构. 键合模式结果表明二者之间的结合以疏水作用为主,但也不排除氢键作用的存在.
参考文献:
[1] ERCELEN S, KLYMCHENKO A S, MÉLY Y. The binding of novel two-color fluorescence probe FA to serum albumins of different species [J]. Int J Biol Macromol, 2005, 35(5): 231-242.
[2] 缘 萍,宋玉民,李清萍,等.铈配合物与人血清白蛋白相互作用的研究[J].化学研究与应用,2010,22(10):1248-1254.
[3] TIAN Jian Niao, LIU Jia Qin, XIE Jian Ping, et al. Binding of wogonin to human serum albumin: a common binding site of wogonin in subdomain IIA [J]. J Photochem Photobiol A, 2004, 74(1): 39-45.
[4] 张怀斌, 丽 英,荣先国. 灯盏花素与牛血清白蛋白相互作用的荧光光谱研究[J]. 化学研究, 2012,23(2):13-16.
[5] 马亚娣,张国文,刘钰红. 乙基麦芽酚与牛血清白蛋白相互作用的光谱[J]. 南昌大学学报,2011,35(6):545-549.
[6] 余军平. 荧光光谱法在药物分析及药物与生物分子作用中的应用研究[D]. 武汉: 武汉大学, 2004.
[7] 龚盛昭.黄酮类化合物保健食品大有开发价值[J]. 广州食品工业科技, 2007, 18(1):63-64.
[8] 宋 慧,李 勇.黄酮类化合物的保健作用[J].中国食品与营养,2004,4(11):45-47.
[9] 马世昌.化学物质辞典[M]. 陕西: 陕西科学技术出版社,1999: 246.
[10] 索志荣,郑建斌,朱小红. 复方三维亚油酸胶丸I中甲基橙皮苷和维生素C的HPLC分析[J]. 药物分析杂志, 2005,25(9): 1012-1014.
[11] 刘家琴,田 建,边清泉,等. 马兜铃酸与牛血清白蛋白的相互作用研究[J]. 光谱学与光谱分析, 2006, 26(4): 715-719.
[12] JIANG Chong Qiu, GAO Ming Xia, MENG Xian Zhe. Study of the interaction between daunorubicin and human serum albumin, and the determination of daunorubicin in blood serum samples [J]. Spectrochim Acta A, 2003, 59 (7): 1605-1610.
[13] LAKOWICZ J R. Principles of fluorescence spectroscopy [M]. Newyork: Kluwer Academic Publishers/Plenum Press, 1999:237-259.
[14] BIAN Qing Quan, LIU Jia Qin, TIAN Jian Niao, et al. Binding of genistein to human serum albumin demonstrated using tryptophan fluorescence quenching[J]. Int J Biol Macromol, 2004, 34(5): 275-279.
