抗柯萨奇B病毒性心肌炎胶囊复方新制剂对柯萨奇B3病毒感染的人喉癌上皮细胞的影响※
2013-11-15姚荣妹马会霞韩淑英包巨太
徐 静 姚荣妹 马会霞 李 洁 韩淑英 包巨太
(河北联合大学2011级硕士研究生,河北 唐山 063000)
抗柯萨奇B病毒性心肌炎胶囊(K-CoxB-JN)复方是本课题组(抗柯萨奇B病毒性心肌炎胶囊活性成分的提取及其优化研究)开发的一种中药制剂。本课题组前期实验表明,抗柯萨奇B中药胶囊可以提高患者抵抗力,增强免疫功能,激活自然杀伤(NK)细胞细胞活性[1]。通过正交试验证实,K-CoxB-JN优化方与原方都具有相似的提高小鼠抗应激反应能力的作用[2],但此方临床应用剂量较大,因此本课题组对该复方进行了新的工艺提取,研制出K-CoxB-JN复方新制剂,实验证明K-CoxB-JN复方新制剂对病毒性心肌炎具有较好的效果[3-5]。本实验拟通过柯萨奇B3(CVB3)病毒感染人喉癌上皮(Hep-2)细胞,观察不同浓度K-CoxB-JN复方新制剂对CVB3感染Hep-2细胞的影响。
1 材料与方法
1.1 材料
1.1.1 实验细胞与病毒 Hep-2细胞与CVB3病毒均由中国中医科学院中药研究所ABSL-2生物安全实验室惠赠。
1.1.2 实验药物 K-CoxB-JN复方新制剂(药物组成:西洋参、黄芪、牡丹皮、麦门冬、北五味子、莱菔子及王不留行),按处方量取复方药物10剂,加10倍量70%乙醇,回流提取2次,每次1.5 h,滤过,合并提取液,浓缩后药液离心,收取沉淀,减压干燥成干膏;乙醇提取后的药渣,水煎煮3次,加水量分别10、8、8倍,每次1.5 h,合并水煎液减压浓缩,加乙醇至含醇量60%,放置过夜,离心,取沉淀,用等容积95%乙醇清洗2次,减压干燥成干膏。合并两部分干膏,粉碎,混合,分装,每粒含0.4 g,相当生药量4 g,由颈复康药业集团有限公司负责加工提供。利巴韦林颗粒,四川百利药业有限责任公司,国药准字H51023508。
1.1.3 仪器与试剂 生物安全柜(美国Thermo Scientific公司);超净工作台(苏州安泰空气技术有限公司);Thermo 371型二氧化碳培养箱(美国Thermo Scientific公司);Eppendorf离心机(德国Eppendorf公司);Olympus倒置显微镜(日本Olympus公司);Rayto RT-6000酶标仪(美国Rayto雷杜公司);特级胎牛血清、DMEM高糖培养基(美国Gibco公司);溴化噻唑蓝四氮唑(MTT,美国Sigma公司)。
1.2 实验方法
1.2.1 CVB3病毒扩增 将生长良好的Hep-2细胞,接种于一次性培养瓶,当细胞长至80%左右时,更换为细胞维持液(含2%胎牛血清),加CVB3病毒液100 μL/瓶,置37 ℃、5%二氧化碳培养箱中培养,待细胞病变达到75%后,收集细胞,重复冻融3次,以1 500 r/min离心30 min,吸取含病毒的上清液,分装,置超低温冰箱中保存备用。
1.2.2 CVB3病毒毒力滴定(TCID50测定)[6]将Hep-2细胞配制成浓度为104/mL的细胞悬液,加入96孔培养板中,当细胞长至80%左右时,弃培养板中的生长液,以PBS缓冲液洗涤各培养孔1次。用含2%胎牛血清的维持液,将CVB3病毒以10倍浓度从10-1稀释到10-8,加入96孔板中,每孔100 μL,每个浓度设4个复孔,另设4个正常对照孔各加100 μL的2%细胞维持液,置于37℃、5%二氧化碳培养箱中培养,48 h后观察细胞病变情况,按Reed-Muench法计算TCID50为10-7.5/0.1 mL。
1.2.3 药物毒性实验[7]将生长良好的Hep-2细胞经胰酶消化后,稀释成浓度为104/mL的细胞悬液,接种于96孔板中,当细胞长至80%左右时,弃培养板中的生长液,以PBS缓冲液洗涤各培养孔1次。用含2%胎牛血清的维持液将K-CoxB-JN复方新制剂和利巴韦林颗粒从原液25 mg/mL开始配制成8个浓度,即原液、1∶2、1∶4、1∶8、1∶16、1∶32、1∶64、1∶128,8个浓度,用一次性滤器滤过,将不同浓度的药物加入96孔板中的细胞中,每孔200 μL,每个浓度设4个复孔,另设4个加2%细胞维持液的正常对照孔,置于37℃、5%二氧化碳培养箱中培养,分别于24、48 h观察细胞生长状态,参考正常对照孔细胞形态,观察细胞病变,以不引起细胞病变的最大药物稀释浓度为最大无毒浓度(TC0)。-表示无细胞病变,+表示细胞病变为0%~25%,++表示细胞病变为25%~50%,+++表示细胞病变为50%~75%,++++表示细胞病变为75%~100%。
1.2.4 药物对细胞的保护作用 将Hep-2细胞配制成浓度为104/mL的细胞悬液,加入96孔培养板中,24 h后加入从药物TC0起始稀释4个浓度的K-CoxB-JN复方新制剂(原液、1∶2、1∶4、1∶8)及利巴韦林颗粒(原液、1∶2、1∶4、1∶8)的生长液,每孔100 μL,每个浓度设4个复孔,正常对照组和病毒对照组加100 μL含2%胎牛血清的细胞维持液,放入37 ℃、5%二氧化碳培养箱中培养,2 h后给药组和病毒对照组加入100 TCID50的CVB3病毒液,每孔100 μL,正常对照组加100 μL的2%细胞维持液,放入37 ℃、5%二氧化碳培养箱中培养,每日在显微镜下观察细胞情况,当细胞病变达“+++”时,加入5 mg/mL的MTT,每孔100 μL,继续培养4 h,当黄色的MTT被活细胞的线粒体脱氢酶还原成蓝色的甲簪结晶,小心吸出MTT,加二甲基亚砜,每孔100 μL,震荡混匀,10 min后于酶联免疫检测仪570 nm处测量各孔的吸光值(OD值),OD值与活细胞的数量呈正相关[8-9]。
1.2.5 药物直接抗病毒 将生长良好的Hep-2细胞经胰酶消化后,稀释成浓度为104/mL的细胞悬液,接种于96孔板中,24 h后用2%细胞维持液将K-CoxB-JN复方新制剂及利巴韦林颗粒从药物TD0起始稀释4个浓度(原液、1∶2、1∶4、1∶8),将含有不同浓度的药物各100 μL和CVB3病毒液100 μL混合,放入37℃、5%二氧化碳培养箱中培养,2 h后倒掉96孔板中的细胞培养液,将药物和病毒混合的培养液加入到96孔板中,每孔200 μL,正常对照组加2%细胞维持液,每孔200 μL,病毒对照组加入100 TCID50的CVB3病毒液,每孔200 μL,放入37 ℃、5%二氧化碳培养箱中培养,每日在显微镜下观察细胞情况,当细胞病变达“+++”时做MTT,方法同1.2.4。
1.2.6 药物对病毒释放的影响 将Hep-2细胞配制成浓度为104/mL的细胞悬液,加入96孔培养板中,24 h后加入100 TCID50的CVB3病毒液,每孔100 μL。另设正常对照组和病毒对照组,放入37 ℃、5%二氧化碳培养箱中培养,2 h后加入从药物TD0起始稀释4个浓度(原液、1∶2、1∶4、1∶8)的含K-CoxB-JN复方新制剂和利巴韦林颗粒的生长液,每孔100 μL,每个浓度设4个复孔,正常对照组和病毒对照组加100 μL含2%胎牛血清的细胞维持液,放入37 ℃、5%二氧化碳培养箱中培养,每日在显微镜下观察细胞情况,当细胞病变达“+++”时做MTT,方法同1.2.4。
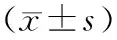
2 结 果
2.1 K-CoxB-JN复方新制剂及利巴韦林颗粒不同浓度对细胞的保护作用 见表1。

表1 K-CoxB-JN复方新制剂及利巴韦林颗粒不同浓度对细胞的保护作用
由表1可见,不同浓度的K-CoxB-JN复方新制剂组及利巴韦林颗粒组OD值均高于病毒对照组(P<0.05),但低于正常对照组(P<0.05)。说明K-CoxB-JN复方新制剂及利巴韦林颗粒药物能保护细胞,当K-CoxB-JN复方新制剂浓度为0.781 25 mg/mL、利巴韦林颗粒浓度为3.125 mg/mL时对细胞的保护作用最明显。2.2 K-CoxB-JN复方新制剂及利巴韦林颗粒不同浓度的抗病毒作用 见表2。

表2 K-CoxB-JN复方新制剂及利巴韦林颗粒不同浓度的抗病毒作用
由表2可见,不同浓度的K-CoxB-JN复方新制剂组及利巴韦林颗粒组OD值均高于病毒对照组(P<0.05),但低于正常对照组(P<0.05)。说明不同浓度的K-CoxB-JN复方新制剂及利巴韦林颗粒均有明显的抗病毒作用,且随着药物浓度的增加,细胞存活率逐渐升高,表现出良好的量效关系。
2.3 K-CoxB-JN复方新制剂及利巴韦林颗粒不同浓度对病毒释放的影响 见表3。

表3 K-CoxB-JN复方新制剂及利巴韦林颗粒不同浓度对病毒释放的影响
由表3可见,不同浓度的K-CoxB-JN复方新制剂组及利巴韦林颗粒组OD值均高于病毒对照组(P<0.05),但低于正常对照组(P<0.05)。
2.4 K-CoxB-JN复方新制剂及利巴韦林颗粒不同浓度对细胞的毒性作用 见表4。

表4 K-CoxB-JN复方新制剂与利巴韦林颗粒不同剂量对细胞的毒性作用
由表4可见,多次实验发现药物对Hep-2毒性表现为细胞增殖缓慢,折光性差,边界模糊,但未见脱落坏死,48 h后观察细胞病变反应,测得K-CoxB-JN复方新制剂TC0为1.562 5 mg/mL,利巴韦林颗粒TC0为6.25 mg/mL。
说明不同浓度的K-CoxB-JN复方新制剂及利巴韦林颗粒均能抑制病毒的释放,且抑制病毒释放作用随着药物浓度的增加而增加,表现出良好的量效关系。
3 讨 论
病毒性心肌炎(viral myocarditis,VMC)是由各种病毒感染引起的急、慢性心肌炎症反应,很多病毒都可能引起心肌炎,其中CVB3是引起VMC的主要病原体之一[10]。MTT法又称MTT比色法,其检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲簪并沉积在细胞中,而死细胞无此功能,该法已被应用于细胞系的体外抗癌药物筛选及肿瘤临床的化疗药敏测定[11]。利巴韦林属于人工合成核苷,具有广谱抗RNA和DNA病毒的作用,能抑制病毒的复制[12],治疗VMC有较好疗效[13]。本实验通过不同的加药和加病毒方式,用MTT法检测CVB3感染的Hep-2细胞的活性,观察K-CoxB-JN复方新制剂对CVB3感染的Hep-2细胞的影响。结果表明,当K-CoxB-JN复方新制剂浓度为0.781 25 mg/mL、利巴韦林浓度为3.125 mg/ml时对CVB3感染的Hep-2细胞保护作用最明显;当K-CoxB-JN复方新制剂浓度为1.562 5 mg/mL、利巴韦林浓度为6.25 mg/mL时直接抗病毒和抑制病毒释放作用最明显,并且表现出良好的量效关系。不同浓度的K-CoxB-JN复方新制剂对CVB3感染的Hep-2细胞具有保护作用,能直接抗CVB3病毒,并且能抑制病毒的释放,本实验结果为进一步进行K-CoxB-JN复方新制剂的体内外实验提供了研究依据。
[1] 邢继萍,包巨太,李志田,等.抗柯萨奇B中药胶囊治疗病毒性心肌炎的临床疗效评价[J].中国临床药理学与治疗学,2003,8(6):701-703.
[2] 储金秀,韩淑英,余红,等.抗柯萨奇B病毒性心肌炎胶囊复方的优化及抗应激作用[J].中国实验方剂学杂志,2011,17(6):153-156.
[3] 徐静,马会霞,李洁,等.抗柯萨奇B病毒性心肌炎胶囊复方新制剂对CVB3感染小鼠的治疗作用[J].时珍国医国药,2013,24(6):1341-1344.
[4] 徐静,马会霞,郑彩慧,等.抗柯萨奇B病毒性心肌炎胶囊复方新制剂抗CVB3作用[J].时珍国医国药,2013,24(5):1076-1078.
[5] 包巨太,徐静,马会霞,等.抗柯萨奇B病毒性心肌炎胶囊复方新制剂体外抗柯萨奇B3病毒作用[J].中医杂志,2013,54(11):953-957.
[6] 黄祯祥.医学病毒学基础及实验技术[M].北京:科学出版社,1990:661-693.
[7] 鄂征.组织培养和分子细胞学技术[M].北京:北京出版社,1995:202-206.
[8] 王达理,曾爱萍,南柏松.噻唑蓝代谢比色分析法用于存活心肌细胞的测定[J].中华实验和临床病毒学杂志,2000,14(1):88.
[9] Takeuchi H,Baba M,Shigeta S,et al.An application of tetrazolium (MTT) colorimetric assay for the screening of anti-herpes simplex virus compounds[J].J Virol Methods,1991,33(1-2):61-71.
[10] Merchant D,Si X,Luo H,et al.The impact of CVB3infection on host cell biology[J].Curr Top Microbial Immunol,2008,323:177-198.
[11] Ulukaya E,Colakogullari M,Wood EJ.Interference by anti-cancer chemotherapeutic agents in the MTT-tumor chemosensitivity assay[J].Chemotherapy,2004,50(1):43-50.
[12] Rezkalla S,Kloner RA,Khatib G,et al.Effect of metoprolol in acute coxsackievirus B3murine myocarditis[J].J Am Coll Cardiol,1988,12(2):412-414.
[13] 姜宏磊,韩秀珍,马沛然,等.利巴韦林对病毒性心肌炎的疗效及机制的实验研究[J].实用儿科临床杂志,2005,20(11):1117-1119.
