氧化亚铜的电化学沉积
2013-11-10陈长毅
陈长毅
( 淮安市产品质量监督检验所,江苏淮安 223001)
0 引言
自TiO2电极在紫外光作用下可分解水被发现以来,光催化剂的研究引起了人们的广泛关注。这一领域的研究重点集中在针对TiO2的改性研究和考察其他半导体材料用于光催化的可能性。作为一种古老的半导体材料,窄禁带p型Cu2O因具有光氧阴极作用,能被可见光激发,可与表面吸附的O2生成高活性的物质,而且其具有材料来源丰富、无毒、制备成本低廉等特点,因此被认为是一种极具前景的光催化材料。
目前,制备纳米氧化亚铜的方法尤其引人关注。常用方法有化学沉积法、电化学法、辐照法和多元醇法等,但难以获得粒径小、分布均匀的产物。电化学沉积方法具有可在各种结构复杂的基体上均匀沉积;通常在室温或稍高于室温的条件下进行;电化学沉积的量由Faraday定律控制,通过控制工艺条件(如:电流、电位、溶液pH值、温度、浓度、组成等)可精确控制沉积层的厚度及化学组成和结构等;电化学沉积的速度可由电位来控制,越大的过电位,沉积速度越快等特点。因此,电化学沉积法是一种经济的制备纳米金属氧化物的方法。
本文拟在铟锡金属氧化物导电玻璃 (Indium Tin Oxides,ITO)电极上通过电化学沉积的方法制备纳米氧化亚铜,考察实验参数对产物尺寸和形貌的影响。
1 实验部分
1.1 试剂和仪器
硝酸铜(Cu(NO3)2)、硝酸钾(KNO3)、乙二胺四乙酸二钠(EDTA)等皆为分析纯,实验用水为去离子水。
CHI 660C型电化学工作站(上海辰华)、XRL/XTRA型X-射线衍射仪(瑞士ARL公司,λ=0.154056 nm)、S -3000N 型扫描电子显微镜(日本日立)。
1.2 氧化亚铜的制备
采用三电极体系进行电化学沉积,工作电极为ITO(Indium Tin Oxides,铟锡金属氧化物)导电玻璃,对电极为铂片电极,参比电极为饱和甘汞电极(SCE),文中给出的电位为相对于SCE。沉积在室温下进行。
具体的沉积过程为:将经丙酮和去离子水清洗后的ITO电极插入一定比例的Cu(NO3)2与KNO3的混合溶液中,通N2除氧15分钟后,在一定的沉积电位下沉积一定时间后,取出ITO并用去离子水洗涤多次后,自然晾干。
2 结果与讨论
2.1 X-射线衍射结果分析
图1 示出 10.0 mmol/L Cu(NO3)2在-0.8V下沉积3000s所得产物的XRD图谱。经与标准的XRD比较,所得产物为Cu2O,产物XRD图谱中的衍射峰归属于立方晶系的Cu2O(JCPDS卡号78-2076,晶胞参数为 a=4.267 A。)。产物 XRD 谱图中未见其它衍射峰,说明所得产物的纯度较好。产物的(111)晶面的衍射强度和其它晶面的衍射强度比值约为标准谱图中相应的比值的1.5倍,说明本方法制备的Cu2O晶体在(111)晶面上更易优先生长。
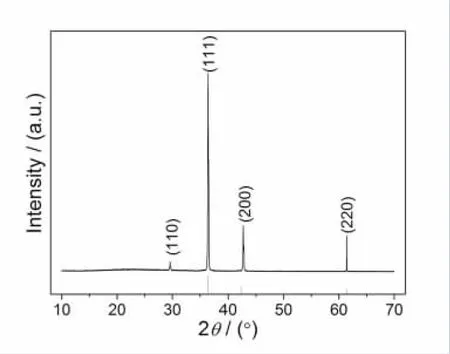
图1 10.0 mmol/L Cu(NO3)2在 -0.8V 下沉积3000S产物的XRD图
2.2 沉积电位的影响
电化学沉积 Cu2O的机理可能为:Cu2+和NO3-水合离子分别被电还原产生 Cu2+离子和OH-离子,然后 Cu+离子和 OH-离子结合生成Cu2O。因此,沉积电位是影响Cu2O制备的重要因素之一。
图2示出10.0 mmol/L Cu(NO3)2在不同电位下沉积2 000秒的SEM图。随着沉积电位变负,单位电极面积上所沉积的Cu2O的量增加。沉积电位为-0.6 V时,沉积产物为类似海胆状的微小颗粒聚集体(图2(A)),其大小约为500 nm左右;当沉积电位为-0.8 V时,聚集体的形状基本不变,而其大小
约为600~700nm,参见图2(B);而当沉积电位为-1.0 V时,海胆状聚集体几乎全部连在一起,可以清晰地看出组成海胆聚集体的为长约100~300nm、直径约为30nm的棒状Cu2O,如图2(C)所示。

图2 10.0 mmol/L Cu(NO3)2在不同积电位下沉积2 000 S时产物的SEM图
2.3 沉积时间的影响
图3示出10.0 mmol/L的 Cu(NO3)2在-0.8 V下沉积不同时间所得产物的SEM图。单位电极面积上的产物量随着沉积时间的增加而增加。当沉积时间为200 s时,所得产物的量较少且为不规则颗粒的聚集体,聚集体的尺寸在200~900 nm之间,如图3(A)所示;当沉积时间为1 000s时,如图3(B)所示,产物的量增加且颗粒尺寸变大,其大小在0.6 ~1.0 μm 之间;当沉积时间达到3 000 s时,颗粒继续变大且相邻聚集体之间相互连接,参见图3(C);继续增加沉积时间达到6000 s时,电极表面被一层致密的棒状Cu2O所覆盖,单个棒状Cu2O的长度约为100~300 nm、直径约为30 nm,如图3(D)所示。实验结果表明,调节沉积电位或沉积时间皆可控制氧化亚铜的形貌和尺寸。

图3 10.0 mmol/L Cu(NO3)2在-0.8 V下沉积不同时间所得产物的SEM图
2.4 Cu2+浓度的影响
Cu2+浓度的影响见表4。

图4 不同浓度的Cu(NO3)2在-0.8 V下沉积2 000 s所得产物的SEM图
图4示出不同Cu2+浓度的电解液在-0.8V下沉积2000s时的 SEM图。当 Cu2+浓度为5.0mmol/L时,所得产物为不规则小颗粒组成的聚集体,聚集体大小约为200~400 nm,且不同聚集体之间几乎连在一起,如图4(A)所示;当Cu2+浓度达到10.0 mmol/L时,所得产物颗粒逐渐积聚成分离的聚集体,聚集体颗粒大小约为0.5~1.0μm(如图4(B)所示);当 Cu2+浓度为 20.0mmol/L时,电极单位面积内的聚集体数量明显少于Cu2+浓度为5.0和10.0mmol/L时的聚集体数量,如图4(C)所示,聚集体的大小约为1.0 ~1.5μm。电极表面产物的聚集程度以及所得聚集体的尺寸随着铜离子的浓度增加而增加,因此,通过控制Cu2+浓度的方法可以控制氧化亚铜产物的形貌。
2.5 EDTA 的影响
在电解液中加入EDTA时,一方面EDTA和Cu2+离子产生螯合作用,降低了电解液中自由的Cu2+离子浓度;另一方面,EDTA可充当表面活性剂来调控产物的形貌。当Cu(NO3)2的起始浓度为5.0 mmol/L时,不同Cu2+和EDTA摩尔比的电解液在-0.8 V下沉积3 000 s所得产物的电镜照片如图5所示。

图5 不同Cu2+和EDTA比例的电解液在-0.8 V下沉积3 000 s的扫描电镜图
当电解液中Cu2+:EDTA=1:1时,所得产物呈不规则的花瓣状颗粒,大小在1.0 μm左右,如图5(A)所示;当电解液中Cu2+:EDTA=1:2时,如图5(B)所示,所得产物呈近球形颗粒,直径在0.1 ~0.3 μm 之间;当电解液中 Cu2+:EDTA=1:4时,产物为较为规则的球或少量球的聚集体,球形颗粒的约为0.2 μm,参见图5(C);当电解液中Cu2+:EDTA=1:10时,所得产物为100 nm左右的球状颗粒(图5(D))。随着电解液中EDTA浓度的增加,产物从不规则的大颗粒聚集体逐渐变为分散性较好的球状小颗粒。因此,通过调节电解液中Cu2+和EDTA摩尔比的方法可以控制氧化亚铜的形貌和颗粒大小。
3 结论
以Cu(NO3)2作为单一前驱物,采用电化学沉积的方法成功制备了立方晶系的Cu2O。实验结果表明,通过改变沉积时间、沉积电位和前驱物的浓度以及前驱物和EDTA的比例可控制产物的形貌和颗粒大小。
[1]Fujishima A.,Honda K.Electrochemical Photolysis of Water at a Semiconductor Electrode[J].Nature,1972,238(5358):37-38.
[2]盛国栋,李家星,王所伟,等.提高TiO2可见光催化性能的改性方法[J].化学进展,2009,21(12):2492-2504.
[3]Ni M.,Leung M.K.H.,Leung D.Y.C.,et al.A review and recent developments in photocatalytic watersplitting using TiO2 for hydrogen production[J].Renewable& Sustainable Energy Reviews,2007,11(3):401-425.
[4]Choi W.Pure and modified TiO2photocatalysts and their environmental applications[J].Catalysis Surveys Asia,2006,10(1):16 -28.
[5]Asahi R.,Morikawa T.,Ohwaki T.,et al.Visible-light photocatalysis in nitrogen-doped titanium oxides[J].Science,2001,293(5528):269-271.
[6]Jang J.S.,Hwang D.W.,Lee J.S.CdS-AgGaS2 photocatalytic diodes for hydrogen production from aqueous Na2S/Na2SO3 electrolyte solution under visible light(λ≥ 420 nm)[J].Catalysis Today,2007,120(2):174 -181.
[7]Omata T.,Otsuka- Yao- Matsuo S.Photocatalytic behavior of titanium oxide-perovskite type Sr(Zr1-xYx)O3-delta composite particles[J].Journal of Photochemistry and Photobiology A -Chemistry,2003,156(1-3):243-248.
[8]Maeda K.,Teramura K.,Lu D.L.,et al.Photocatalyst releasing hydrogen from water-Enhancing catalytic performance holds promise for hydrogen production by water splitting in sunlight[J].Nature,2006,440(7082):295-295.
[9]Zou Z.G.,Ye J.H.,Sayama K.,et al.Direct splitting of water under visible light irradiation with an oxide semiconductor photocatalyst[J].Nature,2001,414(6864):625-627.
[10]Yan S.C.,Li Z.S.,Zou Z.G.Photodegradation Performance of g-C3N4 Fabricated by Directly heating Melamine[J].Langmuir,2009,25(17):10397 -10401.
[11]田蒙奎,上官文峰,王世杰,等.可见光响应光解水制氢的半导体光催化剂[J].化学进展,2007,19(5):680-688.
[12]Zhu H.,Chen Q.,Niu H.,et al.Growth of cuprite nanocubes under acidic conditions[J].Chinese Journal of Inorganic Chemistry,2004,20(10):1172 -1176.
[13]Zhou Y.,Switzer J.Effect of bath temperature on the phase composition and microstructure of galvanostatic electrode posited cuprous oxide films[J].Chinese Journal of Materials Research,1996,10(5):512-516.
[14]Zhu Y.,Qian Y.,Zhang N.,et al.Preparation and charalterization of nanocrystalline powders of cuprous oxide by using γ-radiation[J].Materials Research Bulletin,1994,29(4):377-383.
[15]陈祖耀,朱玉瑞,陈文明,等.紫外射线辐照制备Cu2O超细粉及其宏观动力学[J].金属学报,1997,33(3):330-335.
[16]Feldmann C.,Jungkh O.Polyol-mediated preparation of nanoscale oxide particles[J].Angewandte Chemie -International Edition,2001,40(2):359 -362.
