用铜钨合金废料制备氧化亚铜
2016-02-14魏成文何沁华尚通明刘维桥
魏成文,何沁华,尚通明,刘维桥
(江苏理工学院 化学与环境工程系,江苏 常州 213001)
用铜钨合金废料制备氧化亚铜
魏成文,何沁华,尚通明,刘维桥
(江苏理工学院 化学与环境工程系,江苏 常州 213001)
用硝酸浸取铜钨合金废料中的铜,再用亚硫酸钠还原硝酸铜制备氧化亚铜。采用X射线衍射仪对氧化亚铜进行表征,考察了氧化亚铜产品对溶液中甲基橙的光催化效果,并与分析纯五水硫酸铜制备的氧化亚铜进行了对比。实验结果表明:在硝酸浓度为5.6 mol/L,硝酸用量为2.5 mL/g(为理论用量的1.5倍),浸取温度为40℃,浸取时间为6 h的最优浸取条件下,铜浸取率稳定在87%以上;在还原反应温度为80 ℃、还原反应时间为4 h、硝酸铜浓度为0.8 mol/L的条件下,可制备得到较高纯度的氧化亚铜;在甲基橙质量浓度为20 mg/L、氧化亚铜加入量为2 g/L,500 W氙灯照射时间为2.5 h的条件下进行光催化反应,甲基橙降解率可达93%以上。与分析纯五水硫酸铜制备的氧化亚铜相比,两者形貌相似、光催化效果基本相当。
废铜钨合金;氧化亚铜;浸取;还原;光催化剂;甲基橙
随着电子信息产业的飞速发展,铜钨合金废料的产生量越来越大。钨基合金具有熔点高、难溶于酸碱等特点,如何将合金废料中的金属有效回收利用,成为废钨基合金当前的研究重点。当前,回收利用废铜钨合金的工艺,仅仅做到利用硝酸初步分离回收铜钨合金废料中的有价金属,没有进一步对废料中有价金属的深加工利用,本工作就废合金中金属铜的深加工利用——制备氧化亚铜[1]产品做了进一步研究。
制备氧化亚铜的液相法主要包括:液相还原法[2-5]、溶剂热法[6-7]、水热法[8-9]、电化学法[10]。其中,液相还原法工艺简单,操作简便。
本工作为实现铜钨合金废料中有价金属的高值化利用,以铜钨合金废料为原料,采用硝酸浸取法分离浸取铜,进而采用亚硫酸钠还原法制备具有催化活性的氧化亚铜,优化了浸取铜以及制备氧化亚铜的工艺参数,并考察了氧化亚铜的光催化性能。
1 实验部分
1.1 试剂和原料
硝酸,亚硫酸钠,甲基橙,五水硫酸铜:分析纯。
铜钨合金废料:取自常州某电子元器件生产厂,其成分及性能见表1。

表1 铜钨合金废料的成分及性能
1.2 实验方法
1.2.1 氧化亚铜的制备
取12 g铜钨合金废料,加入一定浓度、一定用量的硝酸进行浸取,得含硝酸铜的浸取液。再向浸取液中加入50 mL浓度为1 mol/L的亚硫酸钠溶液进行还原反应,将沉淀物抽滤分离,得氧化亚铜。在相同条件下,以分析纯五水硫酸铜为原料制备氧化亚铜对照样。
1.2.2 氧化亚铜对甲基橙的光催化降解
取50 mL质量浓度为20 mg/L的甲基橙溶液,加入制备得到的氧化亚铜 0.1 g(加入量为2 g/L),在500 W氙灯的照射下进行光催化反应2.5 h,考察反应后甲基橙溶液的降解情况。同时,在相同条件下,对比氧化亚铜对照样对甲基橙的催化降解效果[11-12]。
1.3 分析与表征
采用PerkinElmer公司2100DV型电感耦合等离子体原子发射光谱仪(ICP-AES)测定铜离子质量浓度,工作参数:等离子体流量15 L/min,辅助气流量0.2 L/min,泵进样量1.5 mL/min,射频功率1 300 W,雾化器流量0.8 L/min。
采用PANalytical 公司Xpert Powder型 X射线衍射光谱仪(XRD)表征氧化亚铜,工作参数:连续扫描,2θ范围10°~80°,步长0.013°,计数时间8.67 s/步,工作温度25 ℃,工作电压40 kV,工作电流40 mA。
采用上海仪电分析仪器有限公司765型紫外-可见分光光度计测定光催化反应前后甲基橙溶液于464 nm处的吸光度,计算降解率。
2 结果与讨论
2.1 硝酸浸取合金中的铜
2.1.1 硝酸浓度对铜浸取率的影响
在硝酸用量为2.5 mL/g、浸取温度为30 ℃、浸取时间为8 h的条件下,硝酸浓度对铜浸取率的影响见图1。由图1可见:硝酸浓度为0.8 mol/L时,铜浸取率为16.01%;随着硝酸浓度的增加,铜浸取率逐渐增加;当硝酸浓度达到5.6 mol/L时,铜浸取率最大,达到87.65%;当硝酸浓度继续增加时,铜浸取率稍有降低。考虑到硝酸铜溶液浓度过高时,浸取液冷却后易于结晶而造成后续处理困难,故硝酸浓度选用5.6 mol/L。

图1 硝酸浓度对铜浸取率的影响
2.1.2 硝酸用量对铜浸取率的影响
在硝酸浓度为5.6 mol/L、浸取温度为30 ℃、浸取时间为8 h的条件下,硝酸用量对铜浸取率的影响见图2。

图2 硝酸用量对铜回收率的影响
由图2可见:随着硝酸用量的增加,铜浸取率逐渐增加;当硝酸用量超过2.5 mL/g(即理论用量的1.5倍)后,铜浸取率趋于平稳。因此,最佳硝酸用量为2.5 mL/g(即理论用量的1.5倍)。
2.1.3 浸取温度对铜浸取率的影响
在硝酸浓度为5.6 mol/L、硝酸用量为2.5mL/g、浸取时间为8 h的条件下,浸取温度对铜浸取率的影响见图3。
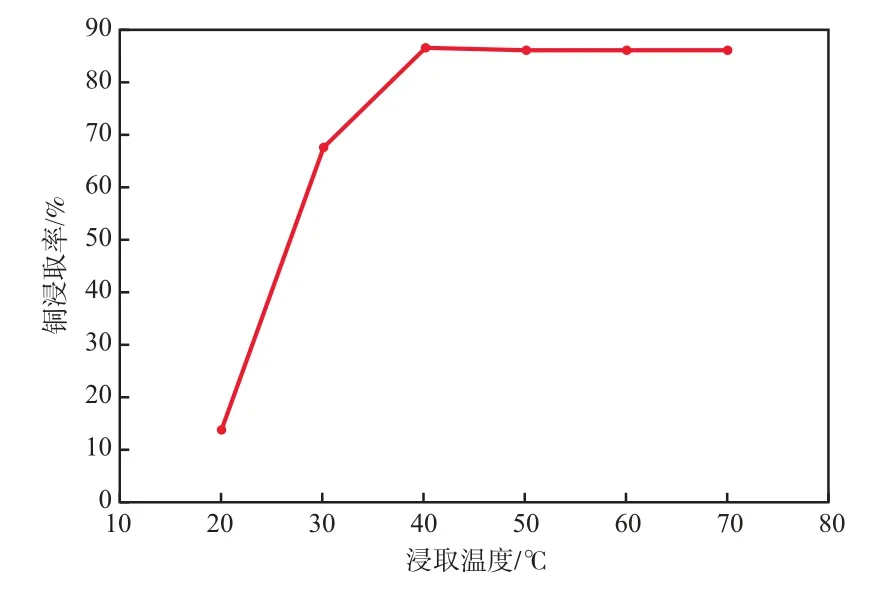
图3 浸取温度对铜浸取率的影响
由图3可见:铜浸取率随温度的升高而逐渐增加;在40 ℃时,铜浸取率达到最高,为87 %左右,继续增加浸取温度,铜浸取率趋于平稳。所以本实验浸取温度以40 ℃为最佳。
2.1.4 浸取时间对铜浸取率的影响
在硝酸浓度为5.6 mol/L、硝酸用量为2.5 mL/ g、浸取温度为40 ℃的条件下,浸取时间对铜浸取率的影响见图4。由图4可见:随着浸取时间的延长,铜浸取率逐渐增加;浸取6 h后铜浸取率为86.43%;再继续延长浸取时间,铜浸取率基本维持不变。故选择浸取时间为6 h。
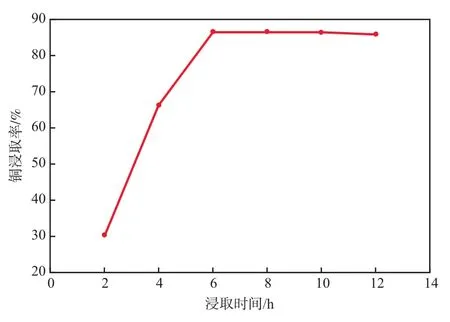
图4 浸取时间对铜浸取率的影响
2.1.5 小结
在硝酸浓度为5.6 mol/L、硝酸用量为2.5 mL/ g、浸取温度为40 ℃、浸取时间为6 h的最优浸取条件下进行铜浸取实验,结果见表2。由表2可见,铜浸取率稳定在87%以上。

表2 铜浸取实验结果
2.2 氧化亚铜的制备
2.2.1 还原反应温度对氧化亚铜纯度的影响
在还原反应时间为4 h、硝酸铜浓度为0.8 mol/ L的条件下,不同还原反应温度下氧化亚铜产物的XRD谱图见图5。由图5可见:还原反应温度为60 ℃时,产品氧化亚铜中含有杂质峰,表明反应过程中间产物没有及时转化为产物;还原反应温度为80 ℃时,氧化亚铜的衍射峰峰位分别位于29.64°,36.34°,42.42°,61.32°,73.42°处,其对应的晶面指数分别为(110)、(111)、(200)、(220)、(311),这与标准谱图库中氧化亚铜的谱图(JCPDS05-667)一致,表明溶液中硝酸铜完全转化为氧化亚铜,同时,谱图中并没有出现铜单质和氧化铜的衍射峰,表明还原反应温度为80℃所制备的氧化亚铜具有较高纯度,不存在副产物;而还原反应温度为100 ℃时,谱图在42°处出现一杂峰。因此本实验选择80 ℃为最佳还原反应温度。
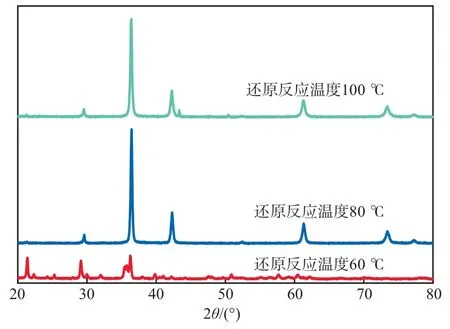
图5 不同还原反应温度下氧化亚铜产物的XRD谱图
2.2.2 还原反应时间对氧化亚铜纯度的影响
在还原反应温度为80 ℃、硝酸铜浓度为0.8 mol/L的条件下,不同还原反应时间下氧化亚铜产物的XRD谱图见图6。由图6可见:还原反应时间为2 h时,在20°左右处产物氧化亚铜中含有杂质峰,表明反应过程中间产物没有及时转化为产物,该中间产物可能为亚硫酸铜;还原反应时间为4 h和6 h时,氧化亚铜的特征衍射峰都极为清晰明显,且谱图中并没有出现铜单质和氧化铜的衍射峰,表明还原反应时间为4 h时所制备的氧化亚铜已具有较高纯度,不存在副产物。
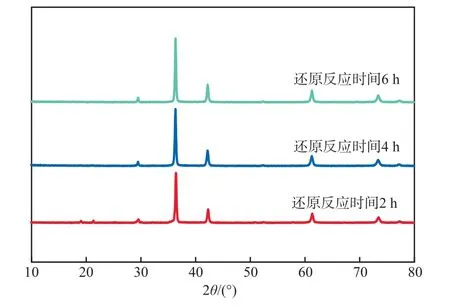
图6 不同还原反应时间下氧化亚铜产物的XRD谱图
2.2.3 硝酸铜浓度对氧化亚铜纯度的影响
在还原反应时间为4 h、还原反应温度为80℃的条件下,不同硝酸铜浓度下氧化亚铜产物的XRD谱图见图7。由图7可见:硝酸铜浓度为0.6 mol/L和0.8 mol/L时,XRD图谱中氧化亚铜的几个衍射峰峰位都较明显;而当硝酸铜浓度达到1.0 mol/L时,氧化亚铜产物在20°左右处出现一些细小杂峰,说明硝酸铜浓度不宜过高。所以选择硝酸铜溶液浓度为0.8 mol/L。
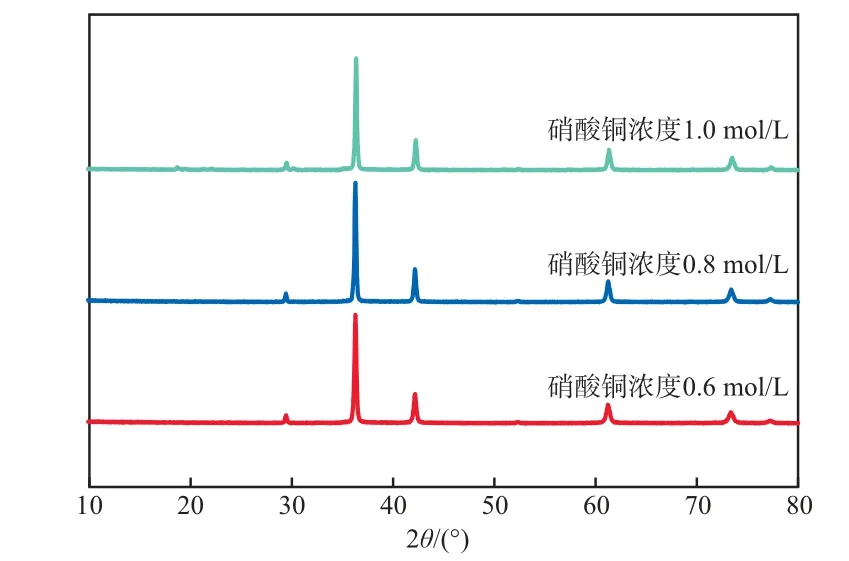
图7 不同硝酸铜浓度下氧化亚铜产物的XRD谱图
2.3 氧化亚铜性能对比
2.3.1 XRD谱图对比
氧化亚铜的5个主要特征峰为29.64°,36.34°, 42.42°,61.32°,73.42°。氧化亚铜产物与氧化亚铜对照样的XRD谱图见图8。由图8可见,氧化亚铜产物与氧化亚铜对照样的5个氧化亚铜主要特征峰基本类似,说明分析纯五水硫酸铜制备的氧化亚铜和从废铜钨合金中回收制备的氧化亚铜两者从晶体结构上并无区别。

图8 氧化亚铜产物与氧化亚铜对照样的XRD谱图
2.3.2 光催化效果对比
在氙灯功率为500 W、氧化亚铜用量为2 g/L、甲基橙溶液质量浓度为20 mg/L、光催化反应时间为2.5 h的条件下进行光催化实验。实验结果表明,氧化亚铜对照样的甲基橙降解率达到96%左右,而氧化亚铜产物的甲基橙降解率达到93%以上,说明回收制备的氧化亚铜与分析纯五水硫酸铜制备的氧化亚铜的光催化效果基本相当,且本方法实现了废旧金属的循环利用,在不影响催化效果的情况下大大降低了成本,更适用于工业生产。
3 结论
a)采用硝酸浸取铜钨合金废料中的铜。在硝酸浓度为5.6 mol/L,硝酸用量为2.5 mL/g(为理论用量的1.5倍),浸取温度为40 ℃,浸取时间为6 h的最优浸取条件下,铜浸取率稳定在87%以上。
b)将含硝酸铜的废铜钨合金浸取液进行常压下亚硫酸钠液相还原,制备氧化亚铜。在还原反应温度为80 ℃、还原反应时间为4 h、硝酸铜浓度为0.8 mol/L的条件下,可制备得到较高纯度的氧化亚铜。
c)回收废铜钨合金制备的氧化亚铜与分析纯五水硫酸铜制备的氧化亚铜相比,两者形貌相似、光催化效果基本相当。在甲基橙质量浓度为20 mg/L、氧化亚铜加入量为2 g/L,500 W氙灯照射时间为2.5 h的条件下进行光催化反应,甲基橙降解率均可达93%以上。相对于分析纯五水硫酸铜制备氧化亚铜的工艺,回收废铜钨合金制备氧化亚铜的工艺更具经济效益。
[1] Xu Haolan,Wang Wenzhong,Zhu Wei. A facile strategy to porous materials:Coordination-assisted heterogeneous dissolution route to the spherical Cu2O single crystallites with hierarchical pores[J]. Microporous Mesoporous Mater,2006,95:321 - 328.
[2] 郭萍,郭璇. 利用亚硫酸钠还原硫酸铜制备氧化亚铜粉体的实验研究[J]. 江西化工,2008(1):52 - 53.
[3] 王岳俊,周康根,蒋志刚. 葡萄糖还原氢氧化铜制备球形氧化亚铜及其粒度控制研究[J]. 无机化学学报,2011,27(12):2405 - 2412.
[4] 张萍,刘恒,李大成. 亚硫酸钠还原法制备超细氧化亚铜粉末[J]. 四川有色金属,1998(2):16 - 18.
[5] 刘军刚,杜芳林. 还原法制备八面体结构的氧化亚铜微晶及其催化性能[J]. 稀有金属材料与工程,2007,36(2):763 - 765.
[6] 魏明真,伦宁,马西骋,等. 溶剂热法制备铜与氧化亚铜纳米晶[J]. 无机盐工业,2007,39(1):21 -22.
[7] 梁建,董海亮,赵君芙,等. 溶剂热法制备不同微米结构的氧化亚铜[J]. 功能材料,2011(S5):794 -798.
[8] Chen Zhizhan,Shi Erwei,Zheng Yanqing,et al. Growth of hex-pod-like Cu2O whisker under hydrothermal conditions[J]. J Cryst Growth,2003,294 (1/2):294 - 300.
[9] 霍建振,魏明真,温树林. 氧化亚铜微米晶的水热合成与生长机理[J]. 无机盐工业,2007,39(7):30 -32.
[10] 陈善亮,朱耿刚,应鹏展,等. 纳米氧化亚铜电化学法制备及光催化研究进展[J]. 环境化学,2011,30(5):976 - 982.
[11] 黄艳娥,琚行松. 纳米二氧化钛光催化降解水中有机物污染物的研究进展[J]. 化工环保,2002,22 (1):23 - 27.
[12] 杨英杰,陈建林,王仪春,等. Bi2WO6催化剂的合成和表征及其光催化活性[J]. 化工环保,2007,27 (6):501 - 505.
(编辑 叶晶菁)
Preparation of cuprous oxide from copper-tungsten alloy scrap
Wei Chengwen,He Qinhua,Shang Tongming,Liu Weiqiao
(Department of Chemical and Environmental Engineering,Jiangsu University of Technology,Changzhou Jiangsu 213001,China)
Copper in copper-tungsten alloy scrap was leached using nitric acid,and cuprous oxide was prepared from the copper nitrate-containing leaching solution by sodium sulfi te reduction. The cuprous oxide product was characterized by XRD. The photocatalytic effect of the product on methyl orange in solution was studied and contrasted with that of cuprous oxide prepared from analytically pure copper sulfate pentahydrate. The experimental results show that:Under the optimum leaching conditions of nitric acid concentration 5.6 mol/L,nitric acid dosage 2.5 mL/g (1.5 times of theoretical dosage),leaching temperature 40 ℃and reaction time 6 h,the copper leaching rate keeps more than 87%;When the reduction temperature is 80 ℃,the reduction time is 4 h and the cupric nitrate concentration is 0.8 mol/L,cuprous oxide with high purity can be prepared;When the photocatalytic reaction is carried out under the conditions of methyl orange mass concentration 20 mg/L,cuprous oxide dosage 2.0 g/L and irradiation time 2.5 h with 500 W xenon lamp,the degradation rate of methyl orange is above 93%. Contrasted with cuprous oxide prepared from analytically pure copper sulfate pentahydrate,the conclusions and photocatalytic effects of them are same.
copper-tungsten alloy scrap;cuprous oxide;leaching;reduction;pholocatalyst;methyl orange
X76
A
1006-1878(2016)05-0567-05
10.3969/j.issn.1006-1878.2016.05.018
2015 - 12 - 23;
2016 - 06 - 15。
魏成文(1991—),男,硕士生,电话 15961288582,电邮 838234362@qq.com。联系人:尚通明,电话 13912301266,电邮 shangtm@jsut.edu.cn。
