胰岛素通过活性氧的产生促进VEGF表达及血管平滑肌细胞迁移和增殖*
2013-11-07梅爱红刘俊许陈思锋
梅爱红, 刘俊许, 陈思锋, 孟 丹△
高胰岛素血症是2型糖尿病胰岛素抵抗的特征 之一。研究表明,高于生理浓度的胰岛素(insulin)可促进血管平滑肌细胞的增殖和迁移,在糖尿病病人动脉粥样硬化和血管成形术后再狭窄的发生和发展过程中起关键作用[1]。
活性氧(reactive oxygen species,ROS)是反应活性极强的代谢分子,主要包括超氧自由基(O-·2)、过氧化氢(H2O2)和羟自由基(·OH)。虽然过多的ROS会引起细胞的衰老和凋亡[2-3],但是低水平的ROS可作为许多刺激因子的第二信使,参与调节细胞的多种功能[4]。我们以往研究发现,ROS参与了胰岛素样生长因子I(insulin-like growth factor I,IGFI)引起的血管平滑肌细胞的增殖和迁移[5-6]。研究表明,胰岛素促进血管平滑肌细胞 ROS的产生[7],但是ROS在胰岛素引起的血管平滑肌细胞增殖和迁移中的作用和分子机制还不十分清楚。本文中我们研究了ROS在胰岛素促进的血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)表达及血管平滑肌细胞迁移和增殖中的作用,为临床寻找有效的抗动脉粥样硬化干预靶点提供理论基础。
材料和方法
1 材料
8周龄健康雄性SD大鼠(Sprague-Dawley rats,体重约150 g)由中国科学院上海实验动物中心提供。DMEM培养基、胎牛血清和胰酶购于Invitrogen。2’,7’-二氯荧光素二乙酸酯(2’,7’-dichlorofluorescein diacetate,DCF-DA)购于 Molecular Probes。胰岛素(insulin)、过氧化氢酶(catalase)、NADPH氧化酶抑制剂二亚苯基碘鎓(diphenylene iodonium,DPI)和夹竹桃麻素(apocynin)购于Sigma。抗大鼠p-ERK 1/2和 ERK2抗体购于 Santa Cruz,抗大鼠 p-Akt、Akt、p70 S6 激酶 1(p70 S6 kinase 1,p70S6K1)和p-p70S6K1购于Cellular Signaling。大鼠VEGF酶联免疫吸附试剂盒购自武汉博士德生物工程有限公司。SYBR Green购于Bio-Rad。CCK-8试剂盒购自日本同仁化学研究所。
2 大鼠血管平滑肌细胞的原代培养
无菌操作取出SD大鼠胸主动脉,分离中膜平滑肌组织,用DMEM培养液洗涤3次,剥去结缔组织与外膜,纵轴剖开,剥除内膜,剪切成1 mm×1 mm×1 mm方块,接种于25 cm2培养瓶中。加入含20%胎牛血清的DMEM培养液,置37℃、5%CO2培养箱中,每周更换培养液1次,20 d后可见平滑肌细胞自移植块边缘长出并形成致密单层时,即开始传代培养,之后的传代培养用含10%FBS的DMEM培养液。平滑肌细胞通过形态学和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)免疫组化方法鉴定。实验选用第3~6代细胞。
实验共分4组,分别是:对照组、胰岛素组、胰岛素+过氧化氢酶catalase组、胰岛素+NADPH氧化酶抑制剂DPI组。
3 细胞内ROS水平检测
细胞内ROS水平采用DCF-DA荧光探针法检测。将细胞种于6孔板中,无血清处理12 h后,用catalase(1.5 ×106U/L)、DPI(5 μmol/L)或 apocynin(20 μmol/L)预处理细胞30 min,然后加入胰岛素(100 nmol/L)处理细胞5 min,再加入 DCF-DA(5 μmol/L)避光37℃孵育15 min。细胞用PBS洗3次后,消化细胞成悬液,用流式细胞仪(Beckman Coulter)检测细胞荧光强度,激发波长480 nm,发射波长540 nm。
4 蛋白免疫印迹
血管平滑肌细胞无血清处理后,预处理catalase(1.5 ×106U/L)和 DPI(5 μmol/L)30 min,加入胰岛素(100 nmol/L)孵育30 min,然后裂解细胞,离心后取上清。用蛋白测定试剂盒(Bio-Rad)检测蛋白浓度。蛋白上样量50 μg,SDS-聚丙烯酰胺凝胶电泳,湿转法将蛋白转移至PVDF膜、5%脱脂牛奶封闭1 h后分别加 p-Akt、Akt、p-p70S6K1、p70S6K1、p-ERK 1/2和ERK2抗体(1∶1 000),4℃孵育过夜;TBST洗3次,加上HRP标记的Ⅱ抗(1∶3 000),室温孵育1 h 30 min,TBST洗4次后进行ECL显色发光。X光胶片用ImageJ图像分析软件进行蛋白定量分析。
5 实时定量PCR
收集细胞,采用Trizol法提取细胞总RNA。按照逆转录试剂盒(Fermentas)说明书采用随机引物进行逆转录合成cDNA。采用实时定量PCR试剂盒(Bio-Rad),以SYBR Green为荧光探针,在real-time analyzer(Bio-Rad)仪器上进行实时定量PCR反应并分析结果,以GAPDH作为内参照。引物序列如下:VEGF164上游引物 5’-ATCTTCAAGCCGTCCTGTGTGC-3’,下游引物 5’-CAAGGCTCACAGTGAACGCT-3’;GAPDH 上游引物5’-CCATCTTCCAGGAGCGAGATC-3’,下游引物 5’-GCCTTCTCCATGGTGGTGAA-3’。
6 报告基因荧光素酶检测
按照Invitrogen公司说明书,用脂质体(Lipofectamine 2000)转染的方法,将含有VEGF启动子片段(2.4 kb)的报告基因和β-半乳糖质粒共转染到血管平滑肌细胞,以转染对照质粒pGL2为空白对照。转染24 h后,细胞无血清处理12 h,用catalase(1.5×106U/L)和 DPI(5 μmol/L)预处理细胞 30 min,然后加入胰岛素(100 nmol/L)孵育20 h,制备细胞裂解物。按照萤光素酶报告基因分析系统(Luciferase Reporter Assay System;Promega)的说明书,在萤光素酶报告分析仪上检测裂解物的萤光值。β-半乳糖酶活性的检测是将裂解物与β-半乳糖酶检测底物在37℃孵育1 h,然后置于酶标仪上,在420 nm波长下测吸光度值。萤光素酶报告基因的萤光值与内参照β-半乳糖酶活性的比值即代表所检测的VEGF启动子片段的转录调控活性。
7 酶联免疫吸附(ELISA)法检测培养上清中VEGF水平
细胞预处理catalase或DPI,加入胰岛素孵育24 h后收集培养上清,上清中 VEGF的含量用大鼠VEGF ELISA试剂盒检测,按照说明书步骤进行。通过VEGF的标准曲线计算上清中VEGF的含量,并用细胞蛋白含量作校正,以ng/(g protein)表示。
8 细胞迁移实验
将细胞种于培养皿中,当细胞密度达到90%以上时,用无菌枪头在培养皿底部作直线划痕,PBS洗后将划痕处拍照作为初始对照,然后加入catalase或DPI,并与胰岛素孵育。24 h后显微镜下随机选取10个视野进行拍照,与初始划痕比较,测量划痕两边细胞迁移的距离,取均值。
9 细胞增殖实验
细胞预处理catalase或DPI,加入胰岛素孵育24 h后将加有药物的培养液吸出,加入含CCK-8的培养液,CCK-8与培养液的体积比例为1∶10,放置37℃细胞培养箱中孵育2 h,在酶标仪上测定450 nm吸光度。
10 统计学处理
采用Prism 5.0统计软件进行分析。数据用均数±标准误(mean±SEM)表示,两组间比较用独立样本t检验,多组间比较用单因素方差分析(One-way ANOVA),以P<0.05为差异有统计学意义。
结 果
1 胰岛素通过NADPH氧化酶途径促进ROS产生
如图1所示,胰岛素处理血管平滑肌细胞5 min后,ROS水平与对照组相比明显升高(P<0.05),catalase、DPI或 apocynin处理后,与胰岛素组相比ROS水平明显下降(P<0.01),提示胰岛素通过NADPH氧化酶途径促进ROS产生。

Figure 1.Effects of catalase,DPI and apocynin on the generation of ROS in VSMCs induced by insulin.Serum starved VSMCs were pre-incubated with catalase(1.5× 106U/L),DPI(5 μmol/L)or apocynin(20 μmol/L)for 30 min,and then stimulated with insulin(100 nmol/L)for 5 min.Mean ± SEM.n=6.*P <0.05 vs control;##P <0.01 vs insulin alone.图1 Catalase、DPI和apocynin对胰岛素诱导的血管平滑肌细胞ROS水平的影响
2 胰岛素产生的ROS介导了Akt/p70S6K1和ERK信号通路的激活
Western blotting结果显示胰岛素明显刺激血管平滑肌细胞p-Akt(P<0.01 vs对照组)、p-p70S6K1(P<0.05 vs对照组)和p-ERK1/2(P<0.01 vs对照组)蛋白的表达。Catalase和DPI可明显抑制胰岛素促进的p-Akt(P<0.01 vs胰岛素组)、p-p70S6K1(P<0.05 vs胰岛素组)和p-ERK1/2(P<0.01 vs胰岛素组)蛋白的表达。这提示胰岛素产生的ROS介导了Akt/p70S6K1和ERK信号通路的激活,见图2。
3 ROS参与了胰岛素促进的VEGF表达
胰岛素增加VEGF mRNA表达(图3A)和蛋白表达(图3B),而且增加VEGF的转录活性(图3C)(P<0.01 vs对照组)。Catalase和DPI明显降低胰岛素促进的VEGF mRNA表达(P<0.01 vs胰岛素组,图3A)和蛋白表达(P<0.01胰岛素+catalase组vs胰岛素组;P<0.05胰岛素+DPI组 vs胰岛素组,图3B)以及VEGF的转录激活(P<0.01 vs胰岛素组,图 3C)。
4 降低ROS产生抑制胰岛素促进的血管平滑肌细胞迁移和增殖
Ctalase和DPI明显抑制胰岛素促进的血管平滑肌细胞迁移(P<0.01 vs胰岛素组,图4)和增殖(P<0.01 vs胰岛素组,图5)。

Figure 2.Effects of catalase and DPI on the expression of p-Akt,p-p70S6K1 and p-ERK1/2 in VSMCs induced by insulin.Serum starved VSMCs were pre-incubated with catalase(1.5 ×106U/L)or DPI(5 μmol/L)for 30 min,and then stimulated with insulin(100 nmol/L)for 30 min.Relative protein expression levels were expressed as the ratios of p-Akt/Akt,p-p70S6K1/p70S6K1 and p-ERK/ERK,and then normalized to the control.Mean ± SEM.n=3.*P < 0.05,**P <0.01 vs control;#P<0.05,##P<0.01 vs insulin alone.图2 Catalase和DPI对胰岛素促进的p-Akt、p-p70S6K1和p-ERK1/2蛋白表达的影响
讨 论
2型糖尿病患者常伴有高胰岛素血症,高浓度胰岛素促进血管平滑肌细胞的增殖和迁移,参与动脉粥样硬化斑块的发生和发展[8]。ROS作为许多刺激因子的第二信使,参与调节细胞的增殖和迁移,但ROS在胰岛素引起的血管平滑肌细胞增殖和迁移中的作用和分子机制还不十分清楚。因此阐明胰岛素促血管平滑肌细胞增殖和迁移的分子机制,将为寻找有效的抗动脉硬化和血管再狭窄的干预靶点提供新的思路。
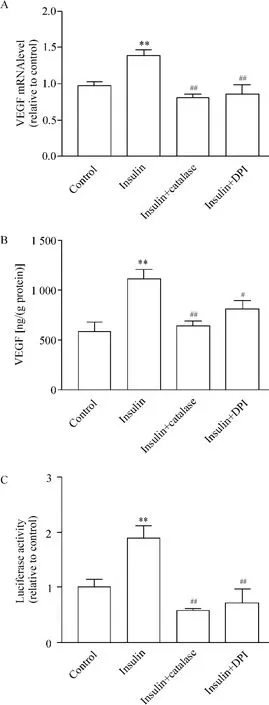
Figure 3.Effects of catalase and DPI on the mRNA and protein expression of VEGF,and transcriptional activation of VEGF induced by insulin.A:the relative VEGF mRNA level was determined by real-time PCR;B:the VEGF content in the supernatants was determined by ELISA assay;C:the relative luciferase activity was determined by the ratio of luciferase to β-galactosidase activity and normalized to the control.Mean ± SEM.n=3.**P <0.01 vs control;#P <0.05,##P <0.01 vs insulin alone.图3 Catalase和DPI对胰岛素促进的VEGF mRNA和蛋白表达以及转录活性的影响

Figure 4.Effects of catalase and DPI on insulin-induced VSMC migration.Mean±SEM.n=3.**P <0.01 vs control;##P <0.01 vs insulin alone.图4 Catalase和DPI对胰岛素促进的血管平滑肌细胞迁移的影响
NADPH氧化酶是血管细胞最主要的ROS来源。NADPH氧化酶主要由跨膜结构(Nox亚基和p22phox)和胞浆成分(p47phox、p67phox、p40phox及 Rac1)组成[9]。研究表明,许多生长因子如血管紧张素II、血小板源生长因子、表皮生长因子等可引起NADPH氧化酶的激活,促进血管平滑肌细胞 ROS的生成[10]。本文研究证实用过氧化氢酶或NADPH氧化酶抑制剂DPI抑制胰岛素刺激的血管平滑肌细胞ROS产生及细胞的迁移和增殖,提示胰岛素通过NADPH氧化酶途径促进ROS产生,ROS介导了血管平滑肌细胞的迁移和增殖。这与Mahadev等[11]的研究结果一致,他们证实在脂肪细胞上NADPH氧化酶亚基Nox4介导了胰岛素引起的ROS产生。我们以往研究也证实Nox4参与了IGF-I刺激的血管平滑肌细胞ROS生成和细胞迁移[6]。

Figure 5.Effects of catalase and DPI on insulin-induced VSMC proliferation.Cell proliferation was detected by CCK-8 assay.Mean ± SEM.n=3.** P < 0.01 vs control;##P <0.01 vs insulin alone.图5 Catalase和DPI对胰岛素促进的血管平滑肌细胞增殖的影响
胰岛素与靶细胞表面的胰岛素受体结合,激活酪氨酸激酶导致一系列胰岛素受体底物磷酸化,进而激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/Akt/p70S6K1两条信号转导途径[12]。本实验结果表明,用过氧化氢酶或DPI阻止 ROS产生,可抑制胰岛素引起的 Akt/p70S6K1和ERK信号通路的激活,提示ROS介导了胰岛素刺激的Akt/p70S6K1和ERK通路。研究表明,胞浆内ROS增高可激活蛋白酪氨酸激酶并抑制蛋白酪氨酸磷酸酯酶(如 PTP1B、PTEN等)活性[11,13],进而经 PI3K/Akt途径激活下游信号分子。本实验结果与以上结论一致。
VEGF是重要的促血管生成因子,其可促进血管平滑肌细胞的迁移和增殖[14]。研究表明,PI3K抑制剂Wortmannin和ERK信号通路的抑制剂U0126能明显抑制VEGF促进的血管平滑肌细胞迁移和增殖[15-16],提示 PI3K和 ERK信号通路在 VEGF介导的血管平滑肌细胞迁移和增殖中起重要作用。本研究证实,抑制 ROS产生明显降低胰岛素促进的VEGF转录激活以及mRNA和蛋白表达。以往研究表明,胰岛素通过PI3K和MAPK信号通路调控血管平滑肌细胞VEGF的表达[17],因此我们推测胰岛素促进的 VEGF表达是通过ROS介导的 PI3K和MAPK信号通路激活完成的。最近的研究证实,在视网膜微血管内皮细胞中ROS的产生参与了胰岛素刺激的VEGF表达[18],这与我们的实验结果一致。
总之,本研究表明,胰岛素通过NADPH氧化酶途径促进血管平滑肌细胞ROS产生;ROS介导了胰岛素促进的Akt/p70S6K1和ERK信号通路的激活、VEGF表达及血管平滑肌细胞的迁移和增殖。这项研究为阐明NADPH氧化酶来源的ROS调控胰岛素促血管平滑肌细胞增殖和迁移的分子机制提供了理论依据。
[1] Anfossi G,Russo I,Doronzo G,et al.Contribution of insulin resistance to vascular dysfunction[J].Arch Physiol Biochem,2009,115(4):199-217.
[2] 郭宝磊,杨茂伟,梁 单,等.高糖通过提高ROS水平和钙超载诱导小鼠MC3T3-E1成骨细胞凋亡[J].中国病理生理杂志,2012,28(2):292-297.
[3] 肖 骏,马 渝,邓松柏,等.芪苈强心对心肌梗死后大鼠心肌细胞凋亡的影响[J].中国病理生理杂志,2012,28(6):1045-1050.
[4] Manea A.NADPH oxidase-derived reactive oxygen species:involvement in vascular physiology and pathology[J].Cell Tissue Res,2010,342(3):325-339.
[5] Meng D,Shi X,Jiang BH,et al.Insulin-like growth factor-I(IGF-I)induces epidermal growth factor receptor transactivation and cell proliferation through reactive oxygen species[J].Free Radic Biol Med,2007,42(11):1651-1660.
[6] Meng D,Lv DD,Fang J.Insulin-like growth factor-I induces reactive oxygen species production and cell migration through Nox4 and Rac1 in vascular smooth muscle cells[J].Cardiovasc Res,2008,80(2):299-308.
[7] Yang M,Yang Y,Zhang S,et al.Insulin-stimulated hydrogen peroxide increases guanylate cyclase activity in vascular smooth muscle[J].Hypertension,2003,42(4):569-573.
[8] Rains JL,Jain SK.Oxidative stress,insulin signaling,and diabetes[J].Free Radic Biol Med,2011,50(5):567-575.
[9] Takac I,Schroder K,Brandes RP.The Nox family of NADPH oxidases:friend or foe of the vascular system?[J].Curr Hypertens Rep,2012,14(1):70-78.
[10] Seshiah PN,Weber DS,Rocic P,et al.Angiotensin II stimulation of NAD(P)H oxidase activity:upstream mediators[J].Circ Res,2002,91(5):406-413.
[11] Mahadev K,Motoshima H,Wu X,et al.The NAD(P)H oxidase homolog Nox4 modulates insulin-stimulated generation of H2O2and plays an integral role in insulin signal transduction[J].Mol Cell Biol,2004,24(5):1844-1854.
[12] Breen DM,Giacca A.Effects of insulin on the vasculature[J].Curr Vasc Pharmacol,2011,9(3):321-332.
[13] Ray PD,Huang BW,Tsuji Y.Reactive oxygen species(ROS)homeostasis and redox regulation in cellular signaling[J].Cell Signal,2012,24(5):981-990.
[14] Spanholtz TA,Theodorou P,Holzbach T,et al.Vascular endothelial growth factor(VEGF165)plus basic fibroblast growth factor(bFGF)producing cells induce a mature and stable vascular network:a future therapy for ischemically challenged tissue[J].J Surg Res,2011,171(1):329-338.
[15] Banerjee S,Mehta S,Haque I,et al.VEGF-A165induces human aortic smooth muscle cell migration by activating neuropilin-1-VEGFR1-PI3K axis [J]. Biochemistry,2008,47(11):3345-3351.
[16] Yang GY,Yao JS,Huey M,et al.Participation of PI3K and ERK1/2 pathways are required for human brain vascular smooth muscle cell migration [J].Neurochem Int,2004,44(6):441-446.
[17] Jiang ZY,He Z,King BL,et al.Characterization of multiple signaling pathways of insulin in the regulation of vascular endothelial growth factor expression in vascular cells and angiogenesis[J].J Biol Chem,2003,278(34):31964-31971.
[18] Wu H,Jiang C,Gan D,et al.Different effects of lowand high-dose insulin on ROS production and VEGF expression in bovine retinal microvascular endothelial cells in the presence of high glucose[J].Graefes Arch Clin Exp Ophthalmol,2011,249(9):1303-1310.
